名校
1 . 完成下列问题。
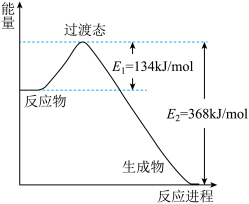
(1)如图NO2(g)和CO(g)反应生成CO2(g)和NO(g)过程中能量变化图。该反应是_______ (填“放热”或“吸热”)反应,该反应物的总焓_______ 生成物的焓(填“小于”或“大于”)。请写出NO2和CO反应的热化学方程式_______ ;
(2)有如下三个热化学方程式:
H2(g)+ O2(g)═H2O(g) △H1=akJ•mol﹣1
O2(g)═H2O(g) △H1=akJ•mol﹣1
H2(g)+ O2(g)═H2O(l) △H2=bkJ•mol﹣1
O2(g)═H2O(l) △H2=bkJ•mol﹣1
2H2O(l)═2H2(g)+O2(g) △H3=ckJ•mol﹣1
①请写出b、c的关系式_______ ;判断c_______ 0(填“>”或“<”)。
②试比较△H1_______ △H2(填“>”或“<”)。
③相同条件下,1molH2O(g)比1molH2O(l)更_______ (填“稳定”或“不稳定”)
(1)如图NO2(g)和CO(g)反应生成CO2(g)和NO(g)过程中能量变化图。该反应是

(2)有如下三个热化学方程式:
H2(g)+
 O2(g)═H2O(g) △H1=akJ•mol﹣1
O2(g)═H2O(g) △H1=akJ•mol﹣1H2(g)+
 O2(g)═H2O(l) △H2=bkJ•mol﹣1
O2(g)═H2O(l) △H2=bkJ•mol﹣12H2O(l)═2H2(g)+O2(g) △H3=ckJ•mol﹣1
①请写出b、c的关系式
②试比较△H1
③相同条件下,1molH2O(g)比1molH2O(l)更
您最近一年使用:0次
2022-09-23更新
|
91次组卷
|
2卷引用:四川省南充市白塔中学2020-2021学年高一下学期4月月考化学试题
名校
解题方法
2 . 按要求填空
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
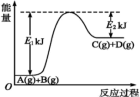
①该反应是_______ (填“吸热”或“放热”)反应,反应的ΔH=_______ kJ· mol-1(用含E1、E2的代数式表示)。
②该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.
Ⅲ.
①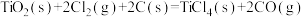 的
的
_______ 。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

①该反应是
②该反应过程中,断裂旧化学键吸收的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.


Ⅱ.

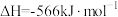
Ⅲ.

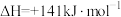
①
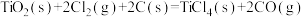 的
的
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
您最近一年使用:0次
2022-09-18更新
|
256次组卷
|
3卷引用:西藏拉萨市第二高级中学2021-2022学年高二上学期期中考试化学试题
3 . 可逆反应2NO2 (g)⇌N2O4 (g) ΔH= −56.9 kJ·mol−1在平衡移动时的颜色变化可以用来指示放热过程和吸热过程。下面是某同学的部分实验报告。
(1)甲烧杯中NO2球的红棕色变浅,说明平衡2NO2 (g)⇌N2O4 (g)向_______ (填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是_______ (填“放热”或“吸热”)过程。
(2)根据乙烧杯中的现象,补全CaO与H2O反应过程的能量变化示意图_______ 。

(3)改变下列条件都可使反应的反应速率改变,其中通过降低活化能加快反应速率的是_______ 。
a.浓度 b.压强 c.温度 d.催化剂
 | 1.向甲烧杯中加入NH4NO3晶体,此烧杯中NO2球的红棕色变浅。 2.向乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色变深。 |
(2)根据乙烧杯中的现象,补全CaO与H2O反应过程的能量变化示意图

(3)改变下列条件都可使反应的反应速率改变,其中通过降低活化能加快反应速率的是
a.浓度 b.压强 c.温度 d.催化剂
您最近一年使用:0次
4 . “长征七号”喷出的火焰颜色和喷口燃气的温度与以往相同。_______
您最近一年使用:0次
2022-08-29更新
|
65次组卷
|
2卷引用:北京市宣武外国语实验学校2020-2021学年高一下学期期中考试化学试题
5 . 在100℃时,将0.10mol的四氧化二氮气体充入2L的固定体积的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格数据:
已知:四氧化二氮为无色气体
请回答下列问题:
(1)该反应的化学方程式为__________ 。
(2)已知该反应的能量变化关系如图,该反应为__________ (填“吸热”或“放热”)反应。

(3)在0~20s内,N2O4的平均反应速率为__________ 。
(4)如图所示,表示NO2变化曲线的是__________ 。
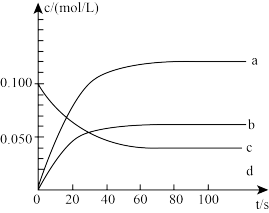
(5)不能说明该反应已达到平衡状态的是__________ (填序号)。
(6)达到平衡时N2O4的转化率为__________ 。表中n1__________ n4(填>、<”或=”)。
 | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.100 | 0.070 | 0.050 | n1 | n2 | n3 |
| n(NO2) | 0 | 0.060 | n4 | 0.120 | 0.120 | 0.120 |
请回答下列问题:
(1)该反应的化学方程式为
(2)已知该反应的能量变化关系如图,该反应为

(3)在0~20s内,N2O4的平均反应速率为
(4)如图所示,表示NO2变化曲线的是

(5)不能说明该反应已达到平衡状态的是__________ (填序号)。
| A.N2O4的质量保持不变 |
| B.容器内压强保持不变 |
| C.混合气体的颜色不再改变 |
| D.容器内气体的密度保持不变 |
您最近一年使用:0次
2022-08-22更新
|
166次组卷
|
2卷引用:广东省江门市2020-2021学年高一下学期期末调研考试化学试题
名校
解题方法
6 . 已知H2 ( g ) + 1/2O2 ( g ) = H2O ( g ) ,反应过程中能量变化如图: 请回答下列问题:

(1)图中a,b分别代表什么意义?
a._______ ;b._______ 。
(2)该反应的∆H_______ (填“< 0”或“> 0”)。

(1)图中a,b分别代表什么意义?
a.
(2)该反应的∆H
您最近一年使用:0次
7 . 已知 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
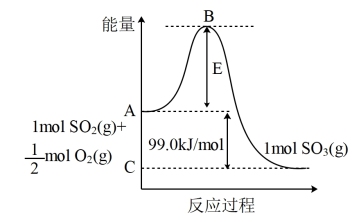
(1)由图可知 为
为___________ (填“吸热”或“放热”)反应。
(2)图中C点表示___________ 。E所代表的能量是___________ ;E的大小对该反应的反应热___________ (填“有”或“无”)影响。
(3)请求出反应
___________ 。
(4)又知 ,请根据题给条件求出反应
,请根据题给条件求出反应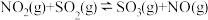 的焓变
的焓变
___________ 。
 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
(1)由图可知
 为
为(2)图中C点表示
(3)请求出反应

(4)又知
 ,请根据题给条件求出反应
,请根据题给条件求出反应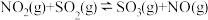 的焓变
的焓变
您最近一年使用:0次
2022-04-04更新
|
325次组卷
|
6卷引用:湖南省嘉禾县第一中学2021-2022学年高二上学期10月月考化学试题
解题方法
8 . 回答下列问题:
(1)在一 定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+C12(g) =2HCl(g) ΔH= - 184.6 kJ•mol-1;该反应属于___________ (填“热吸”或“放热”)反应 。
(2)常温常压下,1 mol乙醇完全燃烧生成CO2气体和液态水放出的热量为1367 kJ,写出乙醇燃烧热的热化学方程式:___________
(3)根据盖斯定律计算
P4(白磷,s)+5O2(g)=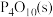 △H=-2983.2 kJ·mol-1 ①
△H=-2983.2 kJ·mol-1 ①
P(红磷,s)+ O2(g)=
O2(g)=
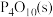 △H=-738.5 kJ·mol-1 ②
△H=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为___________
(4)已知破坏1 mol H-H 键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ 。则由氢气和碘单质反应生成2molHI 需要放出___________ kJ 的热量。
(1)在一 定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+C12(g) =2HCl(g) ΔH= - 184.6 kJ•mol-1;该反应属于
(2)常温常压下,1 mol乙醇完全燃烧生成CO2气体和液态水放出的热量为1367 kJ,写出乙醇燃烧热的热化学方程式:
(3)根据盖斯定律计算
P4(白磷,s)+5O2(g)=
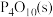 △H=-2983.2 kJ·mol-1 ①
△H=-2983.2 kJ·mol-1 ①P(红磷,s)+
 O2(g)=
O2(g)=
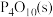 △H=-738.5 kJ·mol-1 ②
△H=-738.5 kJ·mol-1 ②则白磷转化为红磷的热化学方程式为
(4)已知破坏1 mol H-H 键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ 。则由氢气和碘单质反应生成2molHI 需要放出
您最近一年使用:0次
2022-03-19更新
|
980次组卷
|
2卷引用:福建省福州市协作体四校2021-2022学年高二上学期期中联考化学试题
名校
9 . 基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂,它能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图1所示。

(1)这种微胶囊吸收CO2的原理是___________ (用离子方程式解释),此过程是________ (填“吸收”或“放出”)能量的过程。
(2)生活中,经常用热的碳酸钠溶液清洗油污,结合化学用语,用必要的文字说明原因:________ 。
(3)太阳能热电化学(STEP)生产水泥法可使二氧化碳排放量为零。基本原理如图2所示。利用熔融的碳酸钠为电解质,碳酸钙先分解成为CaO和CO2,最后得到石灰(CaO)、碳和氧气。石墨电极的电极反应式是________ 。


(1)这种微胶囊吸收CO2的原理是
(2)生活中,经常用热的碳酸钠溶液清洗油污,结合化学用语,用必要的文字说明原因:
(3)太阳能热电化学(STEP)生产水泥法可使二氧化碳排放量为零。基本原理如图2所示。利用熔融的碳酸钠为电解质,碳酸钙先分解成为CaO和CO2,最后得到石灰(CaO)、碳和氧气。石墨电极的电极反应式是

您最近一年使用:0次
10 . 断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为_______ (填“吸热”或“放热”)反应,其中ΔH=_______ (用含有a、b的关系式表示)。
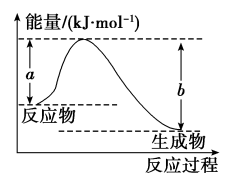
(2)若图示中表示反应H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=_______ kJ·mol-1,x=_______ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为_______ 。若忽略温度和压强对反应热的影响,根据题给有关数据及前面的计算结果,计算当反应中有1 mol电子转移时,反应的能量变化为_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应为

(2)若图示中表示反应H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
您最近一年使用:0次
2022-02-18更新
|
331次组卷
|
12卷引用:河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题
河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题河南省温县第一高级中学2021-2022学年高二上学期开学考试化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷新疆自治区北京大学附属中学新疆分校2018-2019学年高二上学期10月月考化学试题福建省晋江市季延中学2018-2019学年高二(理)上学期期中考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题安徽省潜山第二中学2019-2020学年高二上学期第一次月考化学试题浙江省丽水市松阳县第二中学2019-2020学年高一4月线上教学检测化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1安徽省定远县育才学校2020-2021学年高二上学期第一次月考化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题第一章 第一节 反应热 第1课时 反应热 焓变



