名校
1 . 反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示,请回答下列问题:
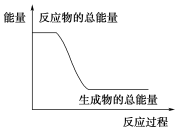
(1)该反应为_______ 反应选(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜极上发生的电极反应为_______ ,另一个电极的材料是_______ (填名称),该电极上发生的电极反应为_______ ,外电路中电子由_______ 极(选填“正”或“负”,下同)向_______ 极移动,电解质溶液中的阴离子向_______ 极移动。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
| A.改铁片为铁粉 |
| B.改稀硫酸为98%的浓硫酸 |
| C.升高温度 |
| D.将2.4 mol·L-1的稀硫酸改为4.8 mol·L-1稀盐酸 |
您最近一年使用:0次
2021-10-09更新
|
218次组卷
|
3卷引用:辽宁省清原满族自治县第二高级中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
2 . 现有反应①Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑②Fe+H2SO4=FeSO4+H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是___________ (填序号,下同),能设计成原电池的是___________ 。
(2)铁铜原电池的装置如图所示。
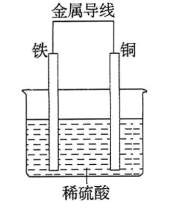
①铁作___________ (填“正极”或“负极”),溶液中的H+向___________ (填“铁”或“铜”)电极方向移动。
②正极的现象是___________ 。负极的电极方程式为___________ 。
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为___________ L。
(1)两反应中属于吸热反应的是
(2)铁铜原电池的装置如图所示。

①铁作
②正极的现象是
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为
您最近一年使用:0次
2021-10-08更新
|
762次组卷
|
7卷引用:6.1.2 化学反应与电能(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)
(已下线)6.1.2 化学反应与电能(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)河南省开封市五县联考2020-2021学年高一下学期期中考试化学试题吉林省长春市2020-2021学年高一下学期期末联考化学试题河北省保定市2016-2017学年高一下学期期中考试化学试题广东省清远市2021-2022学年高一下学期期中调研考试化学试题甘肃省永昌县第一高级中学2021-2022学年高一下学期期中合格性考试化学试题(已下线)【期末复习】必刷题(2)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
名校
解题方法
3 . 按要求填空
(1)在①Ar、②N2、③SiO2、④K2S、⑤NH4Cl五中物质中,只存在共价键的是___________ ;只存在离子键的是___________ ;既有离子键,又有共价键的是___________ ;不存在化学键的是___________
(2)将Ba(OH)2•8H2O晶体研细后与NH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,闻到有刺激性气味的气体产生,此反应为___________ (“吸热”或“放热”)反应,反应的方程式为___________
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,则负极材料是_______ (写名称),正极电极反应为________ ;溶液中 向
向_________ 极移动
(4)工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。已知拆开1mol化学键所需要的能量叫键能。相关键能数据如表:
结合表中所给信息,计算生成2molNH3时_______ (填“吸收”或“放出”)的热量是______ kJ。
(1)在①Ar、②N2、③SiO2、④K2S、⑤NH4Cl五中物质中,只存在共价键的是
(2)将Ba(OH)2•8H2O晶体研细后与NH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,闻到有刺激性气味的气体产生,此反应为
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,则负极材料是
 向
向(4)工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。已知拆开1mol化学键所需要的能量叫键能。相关键能数据如表:
| 共价键 | H﹣H | N≡N | N﹣H |
| 键能(kJ•mol-1) | 436.0 | 945.0 | 391.0 |
您最近一年使用:0次
解题方法
4 . Ⅰ.化学反应伴随能量变化,获取化学反应中的能量有多条途径。
(1)下列反应中,属于放热反应且是氧化还原反应的是_______(填字母).
(2)如图为反应 的能量变化示意图。
的能量变化示意图。
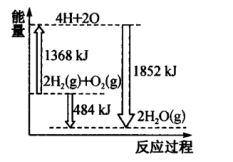
①由 和
和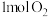 变成
变成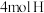 、
、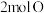 需要
需要_______ (“放出”或“吸收”)能量。
② 和
和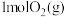 反应生成
反应生成 ,共放出
,共放出_______  能量。
能量。
Ⅱ.燃料电池在工作时,从负极连续通入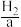 、
、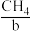 、
、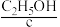 等燃料,从正极连续通入
等燃料,从正极连续通入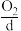 ,以
,以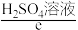 或
或 溶液为电解质溶液,发生反应生成
溶液为电解质溶液,发生反应生成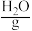 、
、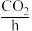 或
或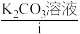 等,同时产生电能,目前已研制成功
等,同时产生电能,目前已研制成功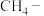 空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
(3)在上述画横线的九种物质中,属于电解质的是_______ (填序号,下同);属于非电解质的是_______ 。
(4)用 和
和 组合形成的质子交换膜燃料电池的结构如图所示:
组合形成的质子交换膜燃料电池的结构如图所示:
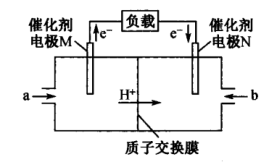
①电极M是_______ (填“正极”或“负极”),电极N的电极反应式为_______ 。
②若该燃料电池消耗 (标准状况下)
(标准状况下) ,则理论上电路中转移
,则理论上电路中转移_______  电子。
电子。
(1)下列反应中,属于放热反应且是氧化还原反应的是_______(填字母).
A. 与 与 反应 反应 | B. 的燃烧反应 的燃烧反应 | C.高温煅烧 | D.C与 反应 反应 |
 的能量变化示意图。
的能量变化示意图。
①由
 和
和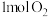 变成
变成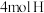 、
、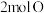 需要
需要②
 和
和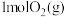 反应生成
反应生成 ,共放出
,共放出 能量。
能量。Ⅱ.燃料电池在工作时,从负极连续通入
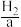 、
、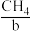 、
、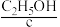 等燃料,从正极连续通入
等燃料,从正极连续通入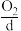 ,以
,以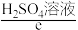 或
或 溶液为电解质溶液,发生反应生成
溶液为电解质溶液,发生反应生成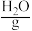 、
、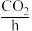 或
或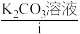 等,同时产生电能,目前已研制成功
等,同时产生电能,目前已研制成功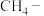 空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。(3)在上述画横线的九种物质中,属于电解质的是
(4)用
 和
和 组合形成的质子交换膜燃料电池的结构如图所示:
组合形成的质子交换膜燃料电池的结构如图所示:
①电极M是
②若该燃料电池消耗
 (标准状况下)
(标准状况下) ,则理论上电路中转移
,则理论上电路中转移 电子。
电子。
您最近一年使用:0次
2021-09-25更新
|
267次组卷
|
2卷引用:河南省商丘开封大联考2020-2021学年高一下学期期末考试化学试题
名校
解题方法
5 . 利用如图装置可以很方便地测得某反应是放热反应还是吸热反应。回答下列问题:
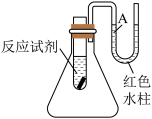
(1)将铁片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是_______ ,小试管中看到的现象是_______ 。
(2)弯管中A端液面_______ (填“上升”或“下降”),原因是_______ ;说明此反应是_______ (填“放热”或“吸热”)反应。
(3)由实验推知,FeCl2溶液和H2的总能量_______ (填“大于”、“小于”或“等于”)铁片和盐酸的总能量。

(1)将铁片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是
(2)弯管中A端液面
(3)由实验推知,FeCl2溶液和H2的总能量
您最近一年使用:0次
2021-09-24更新
|
294次组卷
|
2卷引用:贵州省毕节市金沙县第一中学2021-2022学年高二上学期第一次月考化学试题
6 . 已知某反应A(g)+B(g)⇌C(g)+D(g),反应过程中的能量变化如图所示。
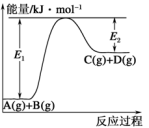
该反应是_______ 反应(填“吸热”或“放热”),该反应的ΔH=_______ kJ·mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量_______ (填“高”、“低”或“高低不一定”)。

该反应是
您最近一年使用:0次
7 . 回答下列问题
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为___________  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
②已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___________ 。
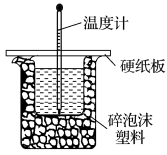
(2)实验室用50mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为___________ ;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应选择___________ mol/L的溶液进行实验。
(3)写出下列反应的热化学方程式:
①16gCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量___________ 。
②0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为___________ 。
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。②已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)实验室用50mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为

(3)写出下列反应的热化学方程式:
①16gCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量
②0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为
您最近一年使用:0次
2021-09-15更新
|
319次组卷
|
2卷引用:黑龙江省绥化市青冈县第一中学校2021-2022学年高二上学期开学考试化学试题
8 .  和CO均是有害气体,可在
和CO均是有害气体,可在 表面转化为无害气体,其反应原理如下:
表面转化为无害气体,其反应原理如下: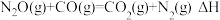 。有关化学反应的能量变化过程(图1)及物质变化过程(图2)如下。
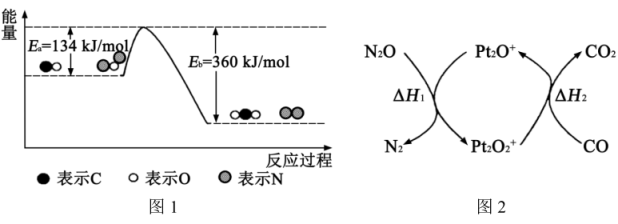
。有关化学反应的能量变化过程(图1)及物质变化过程(图2)如下。
回答下列问题:
(1)图1中反应是_______ (填“放热”或“吸热”)反应,该反应_______ (填“需要”或“不需要”)环境先提供能量,该反应的
_______ 。
(2)该反应的逆反应活化能是_______ 。
(3)若没有 参与该转化过程,则
参与该转化过程,则
_______ ,
_______ 。(填“不变”“变大”“变小”)。
(4) 、
、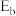 、
、 、
、 四者的数值关系式是
四者的数值关系式是_______ 。
 和CO均是有害气体,可在
和CO均是有害气体,可在 表面转化为无害气体,其反应原理如下:
表面转化为无害气体,其反应原理如下: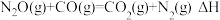 。有关化学反应的能量变化过程(图1)及物质变化过程(图2)如下。
。有关化学反应的能量变化过程(图1)及物质变化过程(图2)如下。
回答下列问题:
(1)图1中反应是

(2)该反应的逆反应活化能是
(3)若没有
 参与该转化过程,则
参与该转化过程,则

(4)
 、
、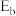 、
、 、
、 四者的数值关系式是
四者的数值关系式是
您最近一年使用:0次
2021-09-08更新
|
323次组卷
|
5卷引用:四川省成都市蓉城名校联盟2021-2022学年高二上学期入学联考化学试题
名校
9 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面_______ (填字母)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水
(3)已知:2mol 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。
①该反应的能量变化可用图中的_______ (填字母)表示。

②写出 燃烧生成液态水的热化学反应方程式:
燃烧生成液态水的热化学反应方程式:_______ 。
(4)表中是部分共价键的键能。
根据表中的数据写出工业合成氨的热化学反应方程式:_______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水 B.浓硫酸和水
(3)已知:2mol
 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。①该反应的能量变化可用图中的

②写出
 燃烧生成液态水的热化学反应方程式:
燃烧生成液态水的热化学反应方程式:(4)表中是部分共价键的键能。
| 共价键 |  |  |  |
键能( ) ) | 436 | 946 | 391 |
您最近一年使用:0次
2021-09-08更新
|
908次组卷
|
5卷引用:广西崇左市高级中学2021-2022学年高二上学期开学考试化学试题
广西崇左市高级中学2021-2022学年高二上学期开学考试化学试题安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题(已下线)第04讲 第一章《化学反应的热效应》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)广东省深圳市观澜中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高一下学期第一次月考化学试题
10 . 某化学兴趣小组学习Na2O2的性质后,进行过氧化钠与水反应的探究实验。回答下列问题:
(1)探究该反应的热效应
实验装置如图所示,调节U型管内两侧液面相平,向试管中加入a g Na2O2粉末,再滴加10 mL蒸馏水及2~3滴酚酞试液,试管内产生大量气泡,溶液先变红后褪色。

①观察到U型管内液面_______ (填标号),说明该反应为放热反应。
A.左侧较高 B.右侧较高 C.左、右两侧一样高
②写出该反应的离子方程式_______ 。
(2)探究溶液红色褪去的原因
限选仪器及试剂:试管、胶头滴管、温度计、蒸馏水、酚酞试液、MnO2粉末。
①提出合理猜想:
猜想一:反应放热,酚酞受热分解,使溶液红色褪去;
猜想二:_______ 。
②设计方案证明猜想:向a g Na2O2中加入10 mL蒸馏水,所得溶液分别置于试管1和试管2中,请将实验操作、现象和结论补充完整:
③在试管2中,加入少量MnO2粉末的作用是_______ 。
(1)探究该反应的热效应
实验装置如图所示,调节U型管内两侧液面相平,向试管中加入a g Na2O2粉末,再滴加10 mL蒸馏水及2~3滴酚酞试液,试管内产生大量气泡,溶液先变红后褪色。

①观察到U型管内液面
A.左侧较高 B.右侧较高 C.左、右两侧一样高
②写出该反应的离子方程式
(2)探究溶液红色褪去的原因
限选仪器及试剂:试管、胶头滴管、温度计、蒸馏水、酚酞试液、MnO2粉末。
①提出合理猜想:
猜想一:反应放热,酚酞受热分解,使溶液红色褪去;
猜想二:
②设计方案证明猜想:向a g Na2O2中加入10 mL蒸馏水,所得溶液分别置于试管1和试管2中,请将实验操作、现象和结论补充完整:
| 实验操作 | 实验现象 | 实验结论 |
| 将试管1中溶液冷却至室温,滴加2~3滴酚酞 | 猜想一不成立 | |
| 向试管2中加入少量MnO2粉末,充分振荡,滴加2~3滴酚酞 | 振荡时,产生大量气泡;滴加酚酞后, | 猜想二成立 |
您最近一年使用:0次



