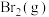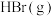名校
1 . A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的结构式是______ 。
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;______ ;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是______ 。
已知
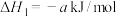
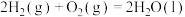
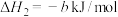
(4)已知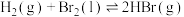
 ;蒸发1mol
;蒸发1mol 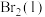 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为______ 。
(5)以NaCl等为原料制备 的过程如下:
的过程如下:
①在无隔膜、微酸性条件下电解,发生反应: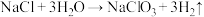 (未配平)。
(未配平)。
②在电解后溶液中加入KCl发生复分解反应,降温结晶,得
③一定条件下反应: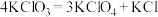 ,将产物分离得到
,将产物分离得到 。
。
该过程制得的 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: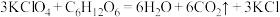 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度______ (用含c、V的代数式表示)。

(1)E的结构式是
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和
 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是已知

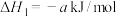
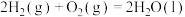
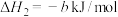
(4)已知
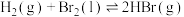
 ;蒸发1mol
;蒸发1mol 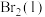 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为物质 |
|
|
|
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
(5)以NaCl等为原料制备
 的过程如下:
的过程如下:①在无隔膜、微酸性条件下电解,发生反应:
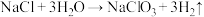 (未配平)。
(未配平)。②在电解后溶液中加入KCl发生复分解反应,降温结晶,得

③一定条件下反应:
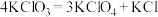 ,将产物分离得到
,将产物分离得到 。
。该过程制得的
 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: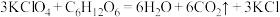 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度
您最近一年使用:0次
2024-01-21更新
|
65次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期末考试化学试题
名校
解题方法
2 . NOx储存还原技术法(NSR)利用催化剂消除汽车尾气中的 NOx,其原理: 2CO(g)+2NO(g)  N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。
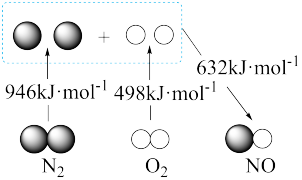
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1;②2CO(g)+O2(g)=2CO2(g) ΔH2;用含ΔH1和 ΔH2的代数式表示ΔH=_______ kJ·mol -1。汽车发动机工作时,会引发反应①,其能量变化如图所示。则 ΔH1=_______ kJ·mol -1。
(2)NSR 反应机理及相对能量如下图(TS 表示过渡态):
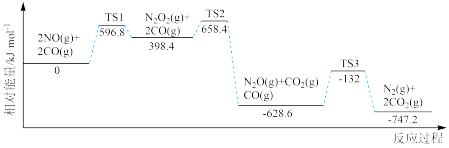
反应过程中,速率最慢步骤的热化学方程式为_______ 。
(3)在一定温度下,向 2 L 恒容密闭容器中充入等物质的量的 NO 和 CO 模拟 NSR 反应,反应过程中 c(NO)随时间变化的曲线如下图所示。
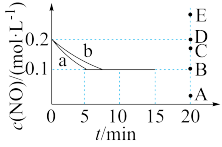
线 a 和b 中,表示在该温度下使用NSR 催化技术的是曲线_______ (选填“a”或“b”)。线 a 中前 5 min 内 CO 的平均反应速率 v(CO)=_______ ;N2的平衡浓度c(N2)=_______ ;此温度下该反应的平衡常数 Kc=_______ 。
(4)保持其他条件不变,平衡后再向容器中充入 CO 和 N2各 0.8 mol,则此时 v(正)_______ v(逆) (选填“>”“ <”或“=”)。
(5)若保持其他条件不变,15 min 时将容器的体积压缩至 1L,20min 时反应重新达到平衡, NO 的物质的量浓度对应的点可能是点_______ (选填“A”“B”“C”“D”或“E”),该点的平衡常数值为_______ 。
 N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1;②2CO(g)+O2(g)=2CO2(g) ΔH2;用含ΔH1和 ΔH2的代数式表示ΔH=

(2)NSR 反应机理及相对能量如下图(TS 表示过渡态):

反应过程中,速率最慢步骤的热化学方程式为
(3)在一定温度下,向 2 L 恒容密闭容器中充入等物质的量的 NO 和 CO 模拟 NSR 反应,反应过程中 c(NO)随时间变化的曲线如下图所示。

线 a 和b 中,表示在该温度下使用NSR 催化技术的是曲线
(4)保持其他条件不变,平衡后再向容器中充入 CO 和 N2各 0.8 mol,则此时 v(正)
(5)若保持其他条件不变,15 min 时将容器的体积压缩至 1L,20min 时反应重新达到平衡, NO 的物质的量浓度对应的点可能是点
您最近一年使用:0次
解题方法
3 . 甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
Ⅰ.利用甲醇(CH3HO)制备甲醛
脱氢法:CH3OH(g)⇌ HCHO(g)+H2 (g) ΔH1=+92.09kJ·mol -1
氧化法:CH3OH(g)+1/2O2(g)⇌HCHO(g)+H2O(g) ΔH2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有________ (写出一条)。
(2)已知:2 H2(g) + O2(g)= 2H2O(g) ΔH3=-483.64kJ·mol -1,则ΔH2=________________ 。
(3)750K 下,在恒容密闭容器中,充入一定量的甲醇,发生脱氢法反应,若起始压强为P0,达到平衡时转化率为40.0% ,则反应的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是脱氢法反应的催化剂,有研究指出,催化反应的部分机理如下:
历程i :CH3OH→·H+ ·CH2OH 历程ii :·CH2OH→·H+ HCHO
历程iii:.·CH2OH→3·H +CO 历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1mol CH3OH,在碳酸钠催化剂作用下,经过10min反应,测得甲醇的转化率(X)与甲醇的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)。回答下列问题:
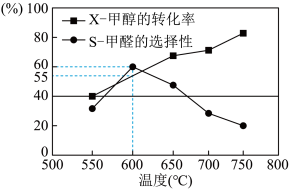
①600℃时,前10min内甲醛的平均速率为v(HCHO)=______
②从平衡角度分析550℃- 650℃甲醇生成甲醛的转化率随温度升高的原因为______ ;
③反应历程i的活化能______ (填“>”“<” 或“=”)CH3OH(g)⇌HCHO(g)+H2(g)活化能。
④650℃- 750℃反应历程ii的速率_______ (填“>”“<” 或“=”)反应历程iii的速率。
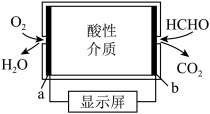
Ⅱ.甲醛超标会危害人体健康,需对甲醛含量检测及处理。
某甲醛气体探测仪利用燃料电池工作原理,b电极反应方程式为________ 。
Ⅰ.利用甲醇(CH3HO)制备甲醛
脱氢法:CH3OH(g)⇌ HCHO(g)+H2 (g) ΔH1=+92.09kJ·mol -1
氧化法:CH3OH(g)+1/2O2(g)⇌HCHO(g)+H2O(g) ΔH2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有
(2)已知:2 H2(g) + O2(g)= 2H2O(g) ΔH3=-483.64kJ·mol -1,则ΔH2=
(3)750K 下,在恒容密闭容器中,充入一定量的甲醇,发生脱氢法反应,若起始压强为P0,达到平衡时转化率为40.0% ,则反应的平衡常数Kp=
(4)Na2CO3是脱氢法反应的催化剂,有研究指出,催化反应的部分机理如下:
历程i :CH3OH→·H+ ·CH2OH 历程ii :·CH2OH→·H+ HCHO
历程iii:.·CH2OH→3·H +CO 历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1mol CH3OH,在碳酸钠催化剂作用下,经过10min反应,测得甲醇的转化率(X)与甲醇的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)。回答下列问题:

①600℃时,前10min内甲醛的平均速率为v(HCHO)=
②从平衡角度分析550℃- 650℃甲醇生成甲醛的转化率随温度升高的原因为
③反应历程i的活化能
④650℃- 750℃反应历程ii的速率
Ⅱ.甲醛超标会危害人体健康,需对甲醛含量检测及处理。
某甲醛气体探测仪利用燃料电池工作原理,b电极反应方程式为

您最近一年使用:0次
2020-05-03更新
|
169次组卷
|
2卷引用:上海大学附属中学2021-2022学年学高三下学期第一次测试化学试题
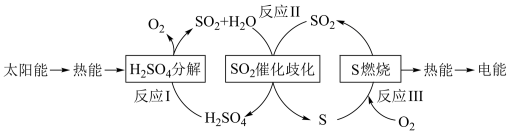
4 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
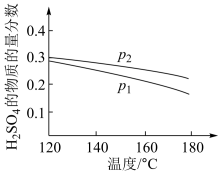
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
2018-06-09更新
|
6536次组卷
|
28卷引用:化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷
(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷四川省成都市实验中学2019-2020学年高三下学期第三次周测化学试题(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率北京东城区2019-2020学年高二下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题北京市第八中学2022-2023学年高二上学期期末考试化学试题广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷北京市第一○一中学2023-2024学年高二上学期统练一化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题10-2023新东方高二上期中考化学