名校
1 . 在推进碳达峰、碳中和的大背景下,可以通过多种手段实现 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:
(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ: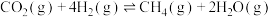

反应Ⅱ:

①已知: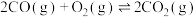
 ,则反应
,则反应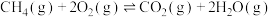 的
的
______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
②反应Ⅰ的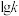 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为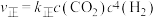 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。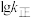 曲线的是
曲线的是______ (填“MH”或“NG”);反应Ⅰ的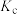 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为______ (用含 、
、 的代数式表示)。
的代数式表示)。
③向某恒压密闭容器中充入5 mol CO2、和20mol 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量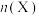 与温度T的关系如图2所示。
与温度T的关系如图2所示。______ (填含碳物质的分子式)的物质的量与温度的关系变化曲线;800K时,若平衡时容器内总压为p,图2中缺少的含碳物质平衡时为1.0 mol,则反应Ⅱ的压强平衡常数
_____ (结果保留两位有效数字, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①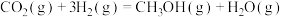
 kJ⋅mol
kJ⋅mol
②
 kJ⋅mol
kJ⋅mol
控制压强为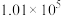 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为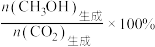 ]。
]。 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是____________ 。
(3)金红石型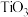 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。______ 中心(填字母)。
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为______ g·cm (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ:
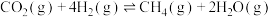

反应Ⅱ:


①已知:
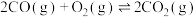
 ,则反应
,则反应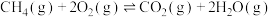 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。②反应Ⅰ的
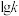 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为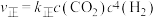 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。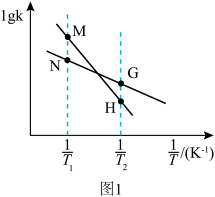
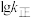 曲线的是
曲线的是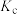 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为 、
、 的代数式表示)。
的代数式表示)。③向某恒压密闭容器中充入5 mol CO2、和20mol
 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量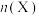 与温度T的关系如图2所示。
与温度T的关系如图2所示。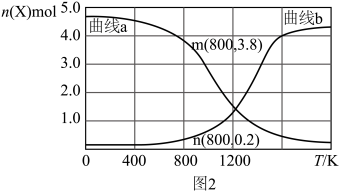

 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①
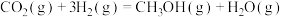
 kJ⋅mol
kJ⋅mol
②

 kJ⋅mol
kJ⋅mol
控制压强为
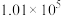 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为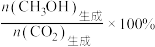 ]。
]。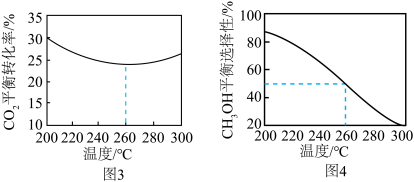
 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是(3)金红石型
 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。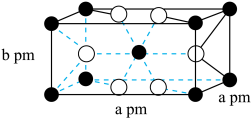
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为
 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: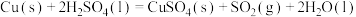
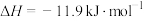 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
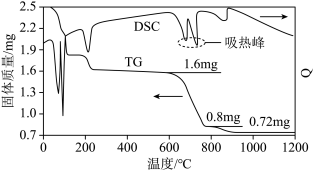
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
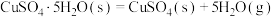
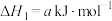

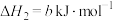
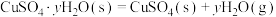

则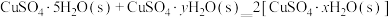 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: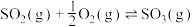

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
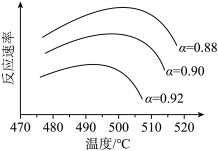
A.温度越高,反应速率越大 B.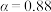 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
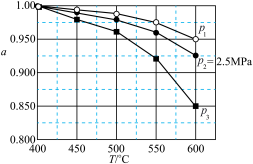
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为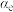 ,则上述催化氧化反应
,则上述催化氧化反应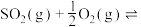
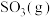 的
的
_____________ (用含p和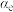 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: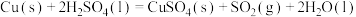
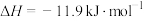 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
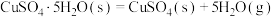
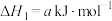

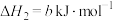
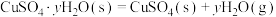

则
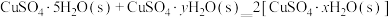 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: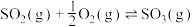
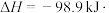

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
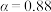 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为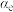 ,则上述催化氧化反应
,则上述催化氧化反应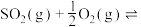
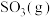 的
的
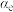 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
23-24高二上·全国·期中
名校
解题方法
3 . 尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)在尿素合成塔中发生的反应可表示为2NH3(g)+CO2(g) NH2COONH4(l) ΔH1=-119.2 kJ∙mol-1;NH2COONH4(l)
NH2COONH4(l) ΔH1=-119.2 kJ∙mol-1;NH2COONH4(l)  CO(NH2)2(s)+H2O(g) ΔH2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(g) ΔH2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g) ΔH3=
CO(NH2)2(s)+H2O(g) ΔH3=___________ kJ∙mol-1,下列图象能表示尿素合成塔中发生反应的能量变化历程的是
___________ (填标号)。
A. B.
B.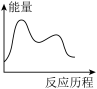 C.
C. D.
D.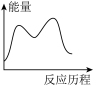
(2)T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应,2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
①NH3的平衡转化率为___________ 。
②能说明上述反应达到平衡状态的是___________ (填标号)。
A.n(CO2):n(NH3)=1:2
B.混合气体的密度不再发生变化
C.CO2的体积分数在混合气体中保持不变
D.单位时间内消耗2molNH3,同时生成1molH2O
③若10min时保持温度和容器的容积不变,再向容器中同时充入1molNH3(g)、0.5molCO2(g)和0.5molH2O(g),则此时平衡___________ (填“正向移动”、“逆向移动”或“不移动”)。
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),若原料气中
CO(NH2)2(s)+H2O(g),若原料气中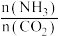 =m,测得m与CO2的平衡转化率(α)的关系如图所示:
=m,测得m与CO2的平衡转化率(α)的关系如图所示:
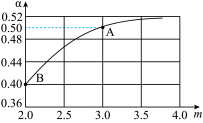
①若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数KP=___________  。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质的量之比nA(NH3):nB(NH3)=___________ 。
(1)在尿素合成塔中发生的反应可表示为2NH3(g)+CO2(g)
 NH2COONH4(l) ΔH1=-119.2 kJ∙mol-1;NH2COONH4(l)
NH2COONH4(l) ΔH1=-119.2 kJ∙mol-1;NH2COONH4(l)  CO(NH2)2(s)+H2O(g) ΔH2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(g) ΔH2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g) ΔH3=
CO(NH2)2(s)+H2O(g) ΔH3=A.
 B.
B. C.
C. D.
D.
(2)T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应,2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:①NH3的平衡转化率为
②能说明上述反应达到平衡状态的是
A.n(CO2):n(NH3)=1:2
B.混合气体的密度不再发生变化
C.CO2的体积分数在混合气体中保持不变
D.单位时间内消耗2molNH3,同时生成1molH2O
③若10min时保持温度和容器的容积不变,再向容器中同时充入1molNH3(g)、0.5molCO2(g)和0.5molH2O(g),则此时平衡
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),若原料气中
CO(NH2)2(s)+H2O(g),若原料气中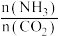 =m,测得m与CO2的平衡转化率(α)的关系如图所示:
=m,测得m与CO2的平衡转化率(α)的关系如图所示:
①若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数KP=
 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)②若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质的量之比nA(NH3):nB(NH3)=
您最近一年使用:0次
2023-10-29更新
|
501次组卷
|
3卷引用:安徽省安庆市第七中学2023-2024学年高二下学期开学考试化学试题
安徽省安庆市第七中学2023-2024学年高二下学期开学考试化学试题(已下线)期中考试模拟试题(二)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)四川省双流棠湖中学2023-2024学年高二上学期11月期中化学试题
2022高三·全国·专题练习
4 . 异丙醇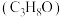 可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯
可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯 的工业化技术已引起人们的关注,其主要反应如下:
的工业化技术已引起人们的关注,其主要反应如下:
Ⅰ.
Ⅱ.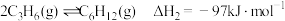
回答下列问题:
(1)已知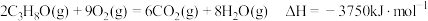 ,则
,则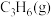 燃烧生成
燃烧生成 和
和 的热化学方程式为
的热化学方程式为_______ 。
(2)在 下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
①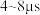 内,
内,
_______ 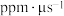 ;
;
②t_______ 16(填“>”“<”或“=”)。
(3)在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是_______ (填标号)。
a. 的分压不变 b.混合气体密度不变
的分压不变 b.混合气体密度不变
c.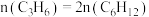 d.
d.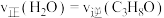
(4)在一定条件下,若反应Ⅰ、Ⅱ的转化率分别为98%和40%,则丙烯的产率为_______ 。
(5)下图为反应Ⅰ、Ⅱ达到平衡时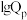 与温度的关系曲线。
与温度的关系曲线。
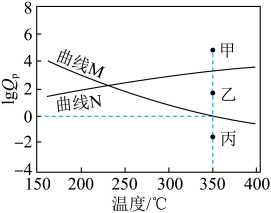
(已知:对于可逆反应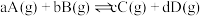 ,任意时刻
,任意时刻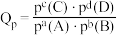 ,式中
,式中 )表示物质×的分压)
)表示物质×的分压)
①在 恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的
恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的_______ 点(填“甲”“乙”或“丙”),判断依据是_______ 。
② 时,在密闭容器中加入一定量的
时,在密闭容器中加入一定量的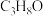 ,体系达到平衡后,测得
,体系达到平衡后,测得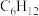 的分压为
的分压为 ,则水蒸气的分压为
,则水蒸气的分压为_______ 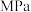 (用含x的代数式表示)。
(用含x的代数式表示)。
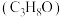 可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯
可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯 的工业化技术已引起人们的关注,其主要反应如下:
的工业化技术已引起人们的关注,其主要反应如下:Ⅰ.

Ⅱ.
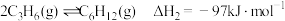
回答下列问题:
(1)已知
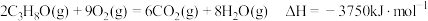 ,则
,则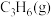 燃烧生成
燃烧生成 和
和 的热化学方程式为
的热化学方程式为(2)在
 下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:反应时间 | 0 | 4 | 8 | 12 | t | 20 |
 浓度 浓度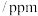 | 0 | 2440 | 3200 | 3600 | 4000 | 4100 |
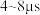 内,
内,
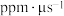 ;
;②t
(3)在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是
a.
 的分压不变 b.混合气体密度不变
的分压不变 b.混合气体密度不变c.
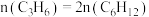 d.
d.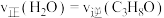
(4)在一定条件下,若反应Ⅰ、Ⅱ的转化率分别为98%和40%,则丙烯的产率为
(5)下图为反应Ⅰ、Ⅱ达到平衡时
 与温度的关系曲线。
与温度的关系曲线。
(已知:对于可逆反应
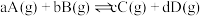 ,任意时刻
,任意时刻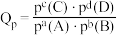 ,式中
,式中 )表示物质×的分压)
)表示物质×的分压)①在
 恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的
恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的②
 时,在密闭容器中加入一定量的
时,在密闭容器中加入一定量的 ,体系达到平衡后,测得
,体系达到平衡后,测得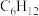 的分压为
的分压为 ,则水蒸气的分压为
,则水蒸气的分压为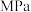 (用含x的代数式表示)。
(用含x的代数式表示)。
您最近一年使用:0次
2023-02-20更新
|
6688次组卷
|
10卷引用:安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(原理综合题)
(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(原理综合题)(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编2022年福建省高考真题化学试题(已下线)2022年福建省高考真题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题福建省福州第四中学2023-2024学年高三上学期期中考试化学试题2023届山西省太原市第五中学高三下学期5月二模理综试题
5 . 氮元素在地球上含量丰富,氮及其化合物在工农业生产和生活中有着重要作用,氮氧化物也是主要的大气污染物。回答下列问题:
(1)已知在催化剂的作用下, 与
与 反应生成无污染气体:
反应生成无污染气体:
①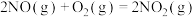

②

③

则④

_______ (用含 、
、 、
、 的代数式表示)。实验室可用氯化铵与消石灰反应制备少量
的代数式表示)。实验室可用氯化铵与消石灰反应制备少量 :
:

 ,该反应在
,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
(2)在催化剂作用下, 也能将
也能将 转化为无毒清洁物质,恒温条件下,将一定量的
转化为无毒清洁物质,恒温条件下,将一定量的 与
与 气体通入恒容密闭容器中,发生反应
气体通入恒容密闭容器中,发生反应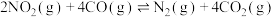 。下列可判断反应达到平衡的是_______(填标号)。
。下列可判断反应达到平衡的是_______(填标号)。
(3)汽车尾气中含有较多的 和
和 ,在催化剂作用下,发生反应
,在催化剂作用下,发生反应 。实验测得:
。实验测得: ,
, (
( 、
、 分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为
分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入
 和
和
 ,当反应达到平衡时,
,当反应达到平衡时, 的转化率为80%,则:
的转化率为80%,则:
①
_______ 。
②平衡时体系压强为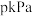 ,
, 为用分压表示的平衡常数(分压
为用分压表示的平衡常数(分压 总压
总压 物质的量分数),则平衡常数
物质的量分数),则平衡常数
_______ (用含p的式子表示) 。
。
(1)已知在催化剂的作用下,
 与
与 反应生成无污染气体:
反应生成无污染气体:①
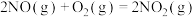

②


③


则④


 、
、 、
、 的代数式表示)。实验室可用氯化铵与消石灰反应制备少量
的代数式表示)。实验室可用氯化铵与消石灰反应制备少量 :
:

 ,该反应在
,该反应在(2)在催化剂作用下,
 也能将
也能将 转化为无毒清洁物质,恒温条件下,将一定量的
转化为无毒清洁物质,恒温条件下,将一定量的 与
与 气体通入恒容密闭容器中,发生反应
气体通入恒容密闭容器中,发生反应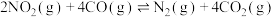 。下列可判断反应达到平衡的是_______(填标号)。
。下列可判断反应达到平衡的是_______(填标号)。| A.混合气体的密度保持不变 | B.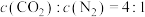 |
| C.容器内总压强不再改变 | D. |
 和
和 ,在催化剂作用下,发生反应
,在催化剂作用下,发生反应 。实验测得:
。实验测得: ,
, (
( 、
、 分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为
分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入
 和
和
 ,当反应达到平衡时,
,当反应达到平衡时, 的转化率为80%,则:
的转化率为80%,则:①

②平衡时体系压强为
 ,
, 为用分压表示的平衡常数(分压
为用分压表示的平衡常数(分压 总压
总压 物质的量分数),则平衡常数
物质的量分数),则平衡常数
 。
。
您最近一年使用:0次
解题方法
6 . 空间站 还原转化系统能把呼出的
还原转化系统能把呼出的 捕集、分离并与空间站电解水系统产生的
捕集、分离并与空间站电解水系统产生的 进行加氢处理,从而实现空间站内物料的循环利用。
进行加氢处理,从而实现空间站内物料的循环利用。
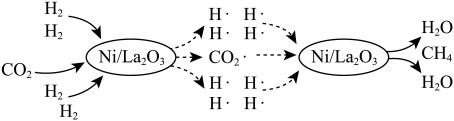
(1)一种借助光将 转化为
转化为 的催化机理如图所示。该转化过程总反应的化学方程式是
的催化机理如图所示。该转化过程总反应的化学方程式是_______ ;图中所示的各物质中,含有极性共价键的非极性分子是_______ (填化学式)。
(2)一定条件下, 和
和 还可发生如下两个平行反应:
还可发生如下两个平行反应:
i.
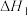
ii.
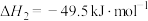
①已知相关键能数据如下表:
则反应i的
_______  。
。
②为了提高 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是_______ (填标号)。
A.低温低压 B.高温低压 C.高温高压 D.低温高压
③保持温度 ,压强
,压强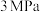 ,按投料比
,按投料比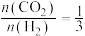 向密闭容器中充入
向密闭容器中充入 和
和 ,反应相同时间测得不同催化剂下
,反应相同时间测得不同催化剂下 转化率和
转化率和 选择性的相关实验数据如下表所示(已知
选择性的相关实验数据如下表所示(已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比)。
的百分比)。
上述条件下,使用cat.2作催化剂,下列说法能判断反应ii达到平衡状态的是_______ (填标号)。
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C. 和
和 的物质的量之比为
的物质的量之比为 D.
D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化
(3)一定条件下,向 恒容密闭容器中充入
恒容密闭容器中充入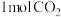 和
和 ,只发生上述反应ii,达平衡时,
,只发生上述反应ii,达平衡时, 的转化率为80%,则该温度下的平衡常数
的转化率为80%,则该温度下的平衡常数
_______ (保留两位小数)。
(4)若恒容密闭容器中只发生上述反应i,在进气比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度
_______ 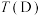 (填“<”,“>”,或“=”),其原因是
(填“<”,“>”,或“=”),其原因是_______ 。

 还原转化系统能把呼出的
还原转化系统能把呼出的 捕集、分离并与空间站电解水系统产生的
捕集、分离并与空间站电解水系统产生的 进行加氢处理,从而实现空间站内物料的循环利用。
进行加氢处理,从而实现空间站内物料的循环利用。(1)一种借助光将
 转化为
转化为 的催化机理如图所示。该转化过程总反应的化学方程式是
的催化机理如图所示。该转化过程总反应的化学方程式是
(2)一定条件下,
 和
和 还可发生如下两个平行反应:
还可发生如下两个平行反应:i.

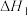
ii.

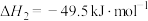
①已知相关键能数据如下表:
| 化学键 |  |  |  |  |
键能/ | 436 | 464 | 803 | 1072 |

 。
。②为了提高
 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是A.低温低压 B.高温低压 C.高温高压 D.低温高压
③保持温度
 ,压强
,压强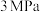 ,按投料比
,按投料比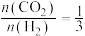 向密闭容器中充入
向密闭容器中充入 和
和 ,反应相同时间测得不同催化剂下
,反应相同时间测得不同催化剂下 转化率和
转化率和 选择性的相关实验数据如下表所示(已知
选择性的相关实验数据如下表所示(已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比)。
的百分比)。| 催化剂 |  转化率 转化率 |  选择性 选择性 |
| cat.1 | 21.9% | 67.3% |
| cat.2 | 36.1% | 100.0% |
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C.
 和
和 的物质的量之比为
的物质的量之比为 D.
D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化(3)一定条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,只发生上述反应ii,达平衡时,
,只发生上述反应ii,达平衡时, 的转化率为80%,则该温度下的平衡常数
的转化率为80%,则该温度下的平衡常数
(4)若恒容密闭容器中只发生上述反应i,在进气比
 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度
 (填“<”,“>”,或“=”),其原因是
(填“<”,“>”,或“=”),其原因是
您最近一年使用:0次
2023-02-12更新
|
888次组卷
|
5卷引用:安徽省合肥市2023届高三第一次教学质量检测 化学试题
安徽省合肥市2023届高三第一次教学质量检测 化学试题(已下线)河北省石家庄市2023届高中毕业年级教学质量检测(一模)变式题(原理综合题)(已下线)专题15 化学反应原理综合题(已下线)预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)河北省部分学校2023届高三下学期二模联考化学试题
7 . 830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H<0。试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_______
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时v(正)_______ v(逆)(填“大于”“小于”或“等于”)
(3)若降低温度,该反应的化学反应速率将_______ (均填“增大”“减小”或“不变”)。
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:_______ 。
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时v(正)
(3)若降低温度,该反应的化学反应速率将
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
您最近一年使用:0次
2022-09-18更新
|
251次组卷
|
3卷引用:安徽省六安市晓天中学2021-2022学年高二上学期期中测试化学试题
解题方法
8 . 工业烟气中含大量NOx,如何处理尾气污染是科技工作者研究的重点。回答下列问题:
(1)最新研究发现用H2可还原NO,其能量变化过程如图:

写出此反应的热化学方程式____ 。
(2)利用污泥燃烧产生的还原性气体(NH3、CO等)也可还原烟气中的NOx。
①CO还原NO的反应历程中相对能量变化如图:

该历程中最大能垒(活化能)E正=____ kJ·mol-1,该步骤的化学方程式是____ 。

②NH3还原NO反应为:6NO(g)+4NH3(g) 5N2(g)+6H2O(g) △H<0。实验测得主燃区温度、过量空气系数(KSR1)与NO还原效率的关系如图所示。“还原气氛”下,该反应的最佳条件是T=
5N2(g)+6H2O(g) △H<0。实验测得主燃区温度、过量空气系数(KSR1)与NO还原效率的关系如图所示。“还原气氛”下,该反应的最佳条件是T=____ K,KSR1=____ ;“氧化气氛”下,当KSR1=1.2时,NO的还原效率低于“基准”的原因是____ 。
(3)一定温度下,在2.0L刚性密闭容器中充人1molCH4和2molNO2发生反应:CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
达到平衡时,NO2的转化率为____ 。若起始时加入3molCH4和2molNO2,则在该温度下的压强平衡常数Kp=____ kPa(以分压表示的平衡常数为Kp,分压=总压 物质的量分数)。
物质的量分数)。
(1)最新研究发现用H2可还原NO,其能量变化过程如图:

写出此反应的热化学方程式
(2)利用污泥燃烧产生的还原性气体(NH3、CO等)也可还原烟气中的NOx。
①CO还原NO的反应历程中相对能量变化如图:

该历程中最大能垒(活化能)E正=

②NH3还原NO反应为:6NO(g)+4NH3(g)
 5N2(g)+6H2O(g) △H<0。实验测得主燃区温度、过量空气系数(KSR1)与NO还原效率的关系如图所示。“还原气氛”下,该反应的最佳条件是T=
5N2(g)+6H2O(g) △H<0。实验测得主燃区温度、过量空气系数(KSR1)与NO还原效率的关系如图所示。“还原气氛”下,该反应的最佳条件是T=(3)一定温度下,在2.0L刚性密闭容器中充人1molCH4和2molNO2发生反应:CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
| p(100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
名校
解题方法
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一。CO2耦合乙苯(C6H5-C2H5,简称EB)脱氢制备苯乙烯(C6H5-C2H3,简称ST)是综合利用CO2的热点研究领域。制备ST涉及的主要反应如下:
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
(2)在一定条件下,选择合适的催化剂只进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。
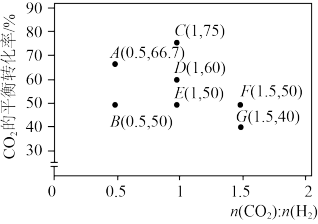
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是_______ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到20%时, =
=_______ 。
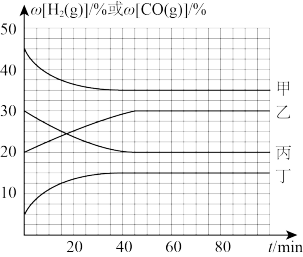
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是_______ (填“甲”“乙”“丙”或“丁”);在温度T2、反应时间20min时,反应的正反应速率v正_______ (填“>”“=”或“<”)逆反应速率v逆。
(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。
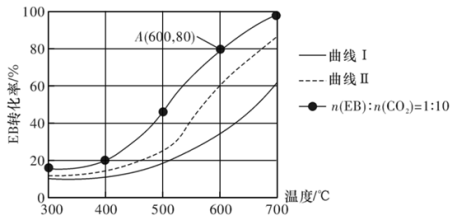
①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线_______ (填“I”或“Ⅱ”)。
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:_______ 。
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为_______ 。
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
 CO(g)+H2O(g)。
CO(g)+H2O(g)。①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。

已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是

(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。

①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为
您最近一年使用:0次
2022-05-29更新
|
535次组卷
|
6卷引用:安徽师范大学附属中学2022届高三适应性考试理综化学试题
安徽师范大学附属中学2022届高三适应性考试理综化学试题湖北省黄冈中学2022届高三第二次模拟考试化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)湖南省株洲市第四中学2022-2023学年高三上学期第三次月考化学试题(已下线)超重点4 化学反应速率与化学平衡图像的4个重点考查方向(已下线)T18-原理综合题
名校
10 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应I生产甲醇,同时伴有反应II发生。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知:CO(g)+2H2(g) CH3OH(g) ΔH=-90.6kJ·mol-1,则ΔH1=
CH3OH(g) ΔH=-90.6kJ·mol-1,则ΔH1=_______ 。
(2)向密闭容器中加入CO2(g)和H2(g),合成CH3OH(g)。已知反应I的正反应速率可表示为 正=k正·c(CO2)·c3(H2),逆反应速率可表示为
正=k正·c(CO2)·c3(H2),逆反应速率可表示为 逆=k逆c(CH3OH)·c(H2O),其中k正、k逆为速率常数。
逆=k逆c(CH3OH)·c(H2O),其中k正、k逆为速率常数。
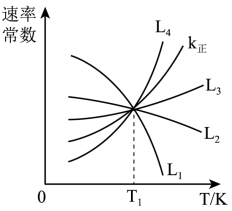
①上图中能够代表k逆的曲线为_______ (填“L1”“L2”或“L3”“L4”)。
②温度为T1时,反应I的化学平衡常数K=________
③对于上述反应体系,下列说法正确的是________
A.增大CO2的浓度,反应I、II的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。
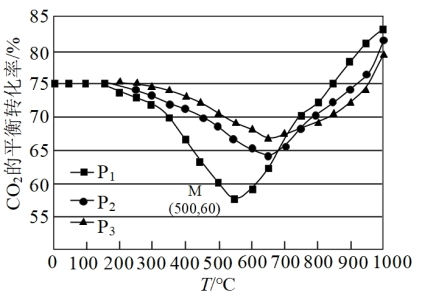
①压强P1、P2、P3由大到小的顺序是_______ 。压强为P1时,温度高于570℃之后,随着温度升高CO2平衡转化率增大的原因________
②图中点M(500,60),此时压强P1为0.1MPa,CH3OH的选择性为 (选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=
(选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=_______ MPa-2(分压=总压×物质的量分数)。
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1回答下列问题:
(1)已知:CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.6kJ·mol-1,则ΔH1=
CH3OH(g) ΔH=-90.6kJ·mol-1,则ΔH1=(2)向密闭容器中加入CO2(g)和H2(g),合成CH3OH(g)。已知反应I的正反应速率可表示为
 正=k正·c(CO2)·c3(H2),逆反应速率可表示为
正=k正·c(CO2)·c3(H2),逆反应速率可表示为 逆=k逆c(CH3OH)·c(H2O),其中k正、k逆为速率常数。
逆=k逆c(CH3OH)·c(H2O),其中k正、k逆为速率常数。
①上图中能够代表k逆的曲线为
②温度为T1时,反应I的化学平衡常数K=
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应I、II的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。

①压强P1、P2、P3由大到小的顺序是
②图中点M(500,60),此时压强P1为0.1MPa,CH3OH的选择性为
 (选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=
(选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=
您最近一年使用:0次
2022-04-25更新
|
766次组卷
|
5卷引用:安徽省“皖南八校”2022届高三下学期第三次联考理综化学试题
安徽省“皖南八校”2022届高三下学期第三次联考理综化学试题(已下线)【直抵名校】02-备战2022年高考化学名校进阶模拟卷(通用版)湖南省邵阳市第二中学2022届高三下学期全真模拟考试化学试题湖南省株洲市第二中学2023届高三上学期第一次月考化学试题江苏省苏南名校高三上学期9月抽检测试化学试题



