解题方法
1 . 过氧化氢、次氯酸都具有强氧化性,且不稳定,都可作杀菌消毒剂和漂白剂。
(1)MnO2催化过氧化氢分解反应的机理分为三步:
第一步:MnO2+H2O2=Mn2++2OH-+O2↑
第二步:Mn2++2OH-=Mn(OH)2↓
第三步:___________ 。
(2)溶液pH对过氧化氢分解反应的影响。
在60℃条件下,取6 mL 30%H2O2溶液,用氢氧化钠调节pH,60 min内,过氧化氢的分解率与溶液pH的关系如图1所示。

①该温度下,H2O2分解率最大时溶液pH为___________ 。
②若30%H2O2溶液的密度为1.11 g·cm-3,pH=8,则60 min内用O2表示的平均反应速率v(O2)=___________ mol·min-1保留两位有效数字)。
(3)次氯酸易分解,常将其转化为次氯酸盐形式保存和运输。
①次氯酸钠可以去除废水中的氨氮(氨氮以NH3计),将废水中的氨氮最终氧化为氮气,该反应的离子方程式为___________ 。
②废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。其他条件一定时,氨氮去除率与温度的关系如图2所示(已知NaClO+H2O NaOH+HClO)。
NaOH+HClO)。
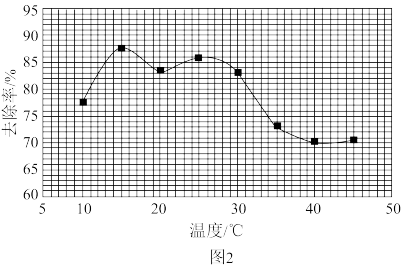
温度为___________ 时氨氮去除率最高。当温度高于30℃时,温度越高,氨氮去除率减小的原因可能是___________ 。
(1)MnO2催化过氧化氢分解反应的机理分为三步:
第一步:MnO2+H2O2=Mn2++2OH-+O2↑
第二步:Mn2++2OH-=Mn(OH)2↓
第三步:
(2)溶液pH对过氧化氢分解反应的影响。
在60℃条件下,取6 mL 30%H2O2溶液,用氢氧化钠调节pH,60 min内,过氧化氢的分解率与溶液pH的关系如图1所示。

①该温度下,H2O2分解率最大时溶液pH为
②若30%H2O2溶液的密度为1.11 g·cm-3,pH=8,则60 min内用O2表示的平均反应速率v(O2)=
(3)次氯酸易分解,常将其转化为次氯酸盐形式保存和运输。
①次氯酸钠可以去除废水中的氨氮(氨氮以NH3计),将废水中的氨氮最终氧化为氮气,该反应的离子方程式为
②废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。其他条件一定时,氨氮去除率与温度的关系如图2所示(已知NaClO+H2O
 NaOH+HClO)。
NaOH+HClO)。
温度为
您最近一年使用:0次
名校
解题方法
2 . 我国大力推广氢能汽车,水煤气法是获得氢能的有效途径之一、
已知:①
②
③
④
已知:25℃、101kPa时,1mol纯物质完全燃烧生成稳定氧化物所放出的热量,叫该物质的燃烧热。下列说法正确的是
已知:①

②

③

④

已知:25℃、101kPa时,1mol纯物质完全燃烧生成稳定氧化物所放出的热量,叫该物质的燃烧热。下列说法正确的是
A.C(s)的燃烧热 |
B. |
C. |
| D.若将反应②设计成原电池,能将化学能全部转化成电能 |
您最近一年使用:0次
2022-04-14更新
|
151次组卷
|
2卷引用:河南省豫北名校大联考2021-2022学年高二下学期期中考试化学试题
名校
3 . NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____ 。部分键能数据如下表所示,△H3=_____ kJ/mol。
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g) 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g) NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
反应I的平衡常数K1和反应II的平衡常数K2的关系是___ 。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___ mol/(L•min),该温度下K2=___ 。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____ (填“正极”或“负极”),生成气体A的电极反应是____ 。

(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____ 。(用化学用语解释)
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=
| 化学键 | N-N | N=N | N N N | H-F | F-F | N-H | N-F |
| 键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)
 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应ⅠNH4AlF4(s)+3F2(g)
 NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ反应I的平衡常数K1和反应II的平衡常数K2的关系是
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的

(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是
您最近一年使用:0次
2019-05-28更新
|
118次组卷
|
2卷引用:【校级联考】河南省八市重点高中联盟“领军考试”2019届高三下学期第五次测评理科综合化学试题
解题方法
4 . 合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。已知2I2(s)+5O2(g)=2I2O5(s)△H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________ 。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①b点CO的平衡转化率α为____________ ,c点的平衡常数K为________________ 。
②下列措施能提高该反应CO转化率的是________ (填字母)
a.升高温度b.增大压强c.加入催化剂d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________ (填“酸性”或“碱性”),向上述溶液中通入___________ (填“NH3”或“SO2”)可使溶液呈中性。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
(1)在合成氨工业中I2O5常用于定量测定CO的含量。已知2I2(s)+5O2(g)=2I2O5(s)△H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1。则该测定反应的热化学方程式为
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①b点CO的平衡转化率α为
②下列措施能提高该反应CO转化率的是
a.升高温度b.增大压强c.加入催化剂d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈
您最近一年使用:0次
解题方法
5 . I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C.
(2)CH3COONH4的水溶液呈_______ (选填 酸性”、“中性"或“碱性”)。
(3)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______ 。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当 Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5 mol·L-1]时,溶液中c(CO32-)=_____ mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得.上述反应的实验数据如下表。
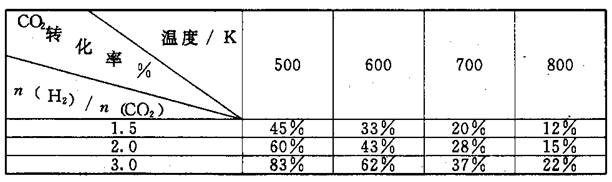
根据表中数据分析:
①上述反应的a_____ 0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即 ]比,平衡常数K值
]比,平衡常数K值_____ (填“增大”、“减小”、或"不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________ 。

请回答下面问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是
A.c(H+) B.c(H+)·c(OH-) C.

(2)CH3COONH4的水溶液呈
(3)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当 Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5 mol·L-1]时,溶液中c(CO32-)=
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
CH3CH2OH (g)+3H2O(g) △H=a kJ/mol在一定压强下,测得.上述反应的实验数据如下表。

根据表中数据分析:
①上述反应的a
②在一定温度下.提高氢碳[即
 ]比,平衡常数K值
]比,平衡常数K值(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为
您最近一年使用:0次



