1 . 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________ kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
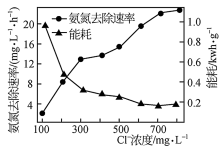
①写出电解时阳极的电极反应式:________________ 。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________ 。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________ 。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________ 。
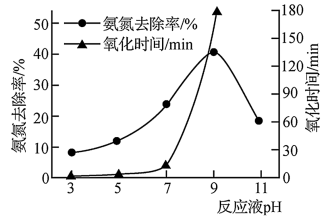
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________ 。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。

①写出电解时阳极的电极反应式:
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是

您最近一年使用:0次
2020-04-14更新
|
459次组卷
|
2卷引用:山东省名校联盟2021届高三下学期开学考试(新高考)化学试题
名校
解题方法
2 . (1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___ ;
②a、b、c三点CO的转化率从大到小的顺序为___ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____ (填化学式);A电极的电极反应式为____ ;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___ 。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___ (填“酸性”“碱性”或“中性”)。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019-10-31更新
|
229次组卷
|
2卷引用:山东省实验中学2020届高三第一次诊断性考试化学试题
解题方法
3 . 中科大某课题组通过自由基杂环反应直接合成各种 稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
 稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
| A.Cu(Ⅰ)物种是催化剂 | B.底物具有氧化性 |
| C.两种途径不同,总反应的反应热也不同 | D.合成过程中 中碳碳双键断裂 中碳碳双键断裂 |
您最近一年使用:0次
名校
4 . 研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应II:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4kJ/mol
反应III:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
(1)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
此时v正_______ v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数为_____ %。
(2)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性=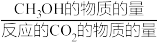 ×100%
×100%
①温度高于230℃,CH3OH产率随温度升高而下降的原因是___________ 。
②在上述条件下合成甲醇的工业条件是___________ 。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。已知:CO和C3H6、C3H8的摩尔燃烧热△H分别为-283•0kJ•mol-1、-2049.0kJ•mol-1、-2217.8kJ•mol-1。298K时,该工艺总反应的热化学方程式为___________

反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应II:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4kJ/mol
反应III:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
(1)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
| 物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
| 浓度/mol∙L-1 | 1.8 | 1.8 | 0.4 |
(2)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性=
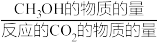 ×100%
×100%①温度高于230℃,CH3OH产率随温度升高而下降的原因是
②在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。已知:CO和C3H6、C3H8的摩尔燃烧热△H分别为-283•0kJ•mol-1、-2049.0kJ•mol-1、-2217.8kJ•mol-1。298K时,该工艺总反应的热化学方程式为

您最近一年使用:0次
5 . 研究NOx之间的转化具有重要意义。
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-202kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH=-117kJ/mol
利用氧化还原法消除NOX的转化如图:NO NO2
NO2 N2若反应I只有一种生成物,则该反应的热化学方程式为
N2若反应I只有一种生成物,则该反应的热化学方程式为______ 。
(2)已知:N2O4(g)⇌2NO2(g) ΔH>0。将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为60%,则反应N2O4(g)⇌2NO2(g)的平衡常数Kp=______ 。
②反应温度T1时,c(N2O4)随t(时间)变化曲线如图所示,画出0~t2时段,c(NO2)随t变化曲线。保持其他条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线______ 。

③在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是______ (填标号)。
a.温度是0℃、压强50kPa
b.温度是130℃、压强300kPa
c.温度是25℃、压强100kPa
d.温度是130℃、压强50kPa
(3)用食盐水作电解质溶液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。则NO被阳极产生的氧化性物质氧化为
,尾气经氢氧化钠溶液吸收后排入空气。则NO被阳极产生的氧化性物质氧化为 反应的离子方程式为
反应的离子方程式为_______ 。

(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-202kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH=-117kJ/mol
利用氧化还原法消除NOX的转化如图:NO
 NO2
NO2 N2若反应I只有一种生成物,则该反应的热化学方程式为
N2若反应I只有一种生成物,则该反应的热化学方程式为(2)已知:N2O4(g)⇌2NO2(g) ΔH>0。将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为60%,则反应N2O4(g)⇌2NO2(g)的平衡常数Kp=
②反应温度T1时,c(N2O4)随t(时间)变化曲线如图所示,画出0~t2时段,c(NO2)随t变化曲线。保持其他条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线

③在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是
a.温度是0℃、压强50kPa
b.温度是130℃、压强300kPa
c.温度是25℃、压强100kPa
d.温度是130℃、压强50kPa
(3)用食盐水作电解质溶液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经氢氧化钠溶液吸收后排入空气。则NO被阳极产生的氧化性物质氧化为
,尾气经氢氧化钠溶液吸收后排入空气。则NO被阳极产生的氧化性物质氧化为 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 化学反应基本原理不仅具有理论意义,而且具有实用价值。
(1)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:①N2(g)+O2(g)=2NO(g) △H1=+ 180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H2=-221.0kJ/mol
③C(s) +O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=______ kJ/mol
(2)工业上常用反应CO(g) +2H2(g) CH3OH(g) △H=-90.7kJ/mol 合成甲醇,恒温恒容条件下,能说明该反应一定达到平衡状态的是
CH3OH(g) △H=-90.7kJ/mol 合成甲醇,恒温恒容条件下,能说明该反应一定达到平衡状态的是_____ (填字母)。
a.混合气体的密度不再随时间改变
b.气体的总压强不再随时间改变
c.CO和CH3OH 的浓度之比不再随时间改变
d.v消耗(CO)=v生成(CH3OH)
(3)草木灰是农家肥料,它的主要成分是碳酸钾,其水溶液显____ (填“ 酸性”、“ 碱性”或“ 中性”),原因是___________ (用离子方程式表示)。
(4)向含有相同浓度Fe2+、Hg+的溶液中滴加Na2S溶液,先生成______ 沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式___________________ 。(Ksp(FeS)=6.3×10-18,Ksp(HgS)=6.4×10-53)
(1)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H已知:①N2(g)+O2(g)=2NO(g) △H1=+ 180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H2=-221.0kJ/mol
③C(s) +O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=
(2)工业上常用反应CO(g) +2H2(g)
 CH3OH(g) △H=-90.7kJ/mol 合成甲醇,恒温恒容条件下,能说明该反应一定达到平衡状态的是
CH3OH(g) △H=-90.7kJ/mol 合成甲醇,恒温恒容条件下,能说明该反应一定达到平衡状态的是a.混合气体的密度不再随时间改变
b.气体的总压强不再随时间改变
c.CO和CH3OH 的浓度之比不再随时间改变
d.v消耗(CO)=v生成(CH3OH)
(3)草木灰是农家肥料,它的主要成分是碳酸钾,其水溶液显
(4)向含有相同浓度Fe2+、Hg+的溶液中滴加Na2S溶液,先生成
您最近一年使用:0次
2018-02-21更新
|
284次组卷
|
2卷引用:山东省滨州市2017-2018学年高二年级上学期期末考试化学试题
7 . I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1

将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据c(8,2)表示:在8 min时H2的物质的量是2 mol。
(1)c点正反应速率_____ (填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=__________
(2)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是________________
(3)若体积不变再充入3molCO2和4 mol H2,则H2O(g)的体积分数__ (填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究I- 被空气中O2氧化的反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、___________________ ;反应的离子方程式为_____________________
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)

(1)电解结束后,阳极附近产生的沉淀物的主要成分为____ (填化学式)。
(2)若按上图所示连接对铅蓄电池进行充电。
总反应:Pb +PbO2+2H2SO4 =2PbSO4 +2H2O,充电一段时间后,B电极上的电极反应式为____________________________ 。充电完毕,铅蓄电池的正极是_______ 极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而18g水蒸气转化成液态水放热44 kJ,则表示CH4燃烧热的热化学方程式为______________________________ 。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据c(8,2)表示:在8 min时H2的物质的量是2 mol。
(1)c点正反应速率
(2)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是
(3)若体积不变再充入3molCO2和4 mol H2,则H2O(g)的体积分数
Ⅱ.某实验小组欲探究I- 被空气中O2氧化的反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)

(1)电解结束后,阳极附近产生的沉淀物的主要成分为
(2)若按上图所示连接对铅蓄电池进行充电。
总反应:Pb +PbO2+2H2SO4 =2PbSO4 +2H2O,充电一段时间后,B电极上的电极反应式为
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而18g水蒸气转化成液态水放热44 kJ,则表示CH4燃烧热的热化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq) H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
(1)已知:CO2(g) CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;
CO2(aq)+H2O(l) H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;
HCO (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;
CO2(g)+H2O(l) 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。
则上述电离方程式中ΔH =_____________ (用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为______________ 。(lg2=0.3)若pH升高,则c(H2CO3)/c(HCO )=
)=___________ (填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________ 。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH_______________ (填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
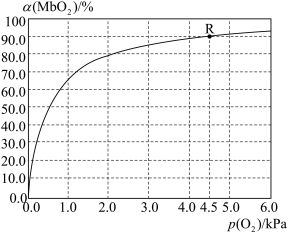
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________ (氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________ 。
Ⅰ.人体血液中存在平衡:H2CO3 (aq)
 H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。(1)已知:CO2(g)
 CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;CO2(aq)+H2O(l)
 H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;HCO
 (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;CO2(g)+H2O(l)
 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。则上述电离方程式中ΔH =
(2)若某人血液中c(HCO
 ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为 )=
)=(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:

①利用R点所示数据,计算37 ℃时该反应的平衡常数K=
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=
您最近一年使用:0次
2018-03-19更新
|
477次组卷
|
3卷引用:山东省菏泽市2018届高三第一次模拟考试理综化学试题



