名校
解题方法
1 . 2024年上海国际碳中和技术博览会以“中和科技、碳素未来”为主题,重点聚焦二氧化碳的捕捉、利用与封存(CCUS)等问题。回答下列问题:
Ⅰ. 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:
甲烷化反应(主反应):①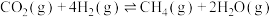

逆变换反应(副反应):②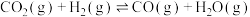

(1)反应③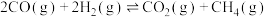

___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)下列叙述中能说明反应①达到平衡状态的是___________ (填字母)。
A.断裂4mol 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.
E.绝热恒容条件下, 不再变化
不再变化
(3)科研小组按 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。
①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是___________ (填“曲线1”“曲线2”或“曲线3”)。曲线1和曲线3交叉点处 的平衡分压为
的平衡分压为___________ MPa(该空忽略副反应逆变换反应)。
反应a:

反应b: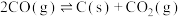

反应c: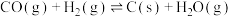

由表中数据可知,积碳反应主要由反应___________ 引起(填“a”“b”或“c”)。
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数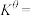
___________ 。(该反应标准平衡常数的表达式为 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,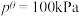 )
)
Ⅰ.
 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:甲烷化反应(主反应):①
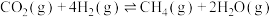

逆变换反应(副反应):②
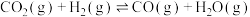

(1)反应③
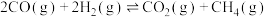

(2)下列叙述中能说明反应①达到平衡状态的是
A.断裂4mol
 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.

E.绝热恒容条件下,
 不再变化
不再变化(3)科研小组按
 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示
 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是 的平衡分压为
的平衡分压为
| 温度℃ |  |  |  |
| 800 | 21.60 | 0.136 | 0.133 |
| 850 | 33.94 | 0.058 | 0.067 |
| 900 | 51.38 | 0.027 | 0.036 |


反应b:
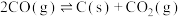

反应c:
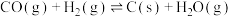

由表中数据可知,积碳反应主要由反应
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol
 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数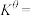
 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,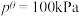 )
)
您最近一年使用:0次
2024-05-27更新
|
198次组卷
|
3卷引用:2024届湖南省岳阳市高三下学期三模化学试题
名校
解题方法
2 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为 、
、 、
、 )在催化剂作用下合成甲醇,主要发生的反应有:
)在催化剂作用下合成甲醇,主要发生的反应有:
反应Ⅰ.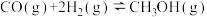


反应Ⅱ.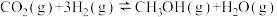
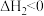

反应Ⅲ.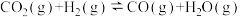
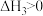

回答下列问题:
(1)_______ (填“低温”“高温”或“任意温度”)有利于反应Ⅰ自发进行,反应Ⅰ的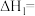
_______ (用含 和
和 的代数式表示),
的代数式表示),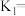
_______ (用含 和
和 的代数式表示)。
的代数式表示)。
(2)在某一密闭容器中充入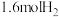 、
、 和
和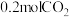 ,同时发生上述三个反应,且
,同时发生上述三个反应,且 平衡转化率与温度和压强的关系如图所示。
平衡转化率与温度和压强的关系如图所示。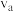
_______ (填“ ”“
”“ ”或“
”或“ ”)
”)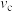 。
。
②氧元素的物质的量分数: 点
点_______ (填“ ”“
”“ ”或“
”或“ ”)
”) 点。
点。
③ 平衡转化率随温度升高而降低,其原因
平衡转化率随温度升高而降低,其原因_______ 。
④ ,
, 点时,测得体系中
点时,测得体系中 ,则此时
,则此时 的物质的量为
的物质的量为_____  ,该温度下
,该温度下 点反应Ⅲ的平衡常数
点反应Ⅲ的平衡常数
____ (分压 物质的量分数
物质的量分数 总压)。
总压)。
 、
、 、
、 )在催化剂作用下合成甲醇,主要发生的反应有:
)在催化剂作用下合成甲醇,主要发生的反应有:反应Ⅰ.
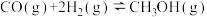


反应Ⅱ.
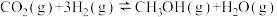
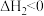

反应Ⅲ.
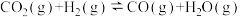
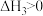

回答下列问题:
(1)
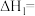
 和
和 的代数式表示),
的代数式表示),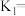
 和
和 的代数式表示)。
的代数式表示)。(2)在某一密闭容器中充入
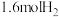 、
、 和
和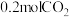 ,同时发生上述三个反应,且
,同时发生上述三个反应,且 平衡转化率与温度和压强的关系如图所示。
平衡转化率与温度和压强的关系如图所示。
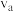
 ”“
”“ ”或“
”或“ ”)
”)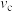 。
。②氧元素的物质的量分数:
 点
点 ”“
”“ ”或“
”或“ ”)
”) 点。
点。③
 平衡转化率随温度升高而降低,其原因
平衡转化率随温度升高而降低,其原因④
 ,
, 点时,测得体系中
点时,测得体系中 ,则此时
,则此时 的物质的量为
的物质的量为 ,该温度下
,该温度下 点反应Ⅲ的平衡常数
点反应Ⅲ的平衡常数
 物质的量分数
物质的量分数 总压)。
总压)。
您最近一年使用:0次
3 . 主要成分为 的工业废气的回收利用有重要意义。
的工业废气的回收利用有重要意义。
Ⅰ.可利用 热分解制备
热分解制备
(1)已知下列反应的热化学方程式:
①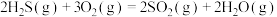

②

③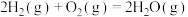

计算 热分解反应④
热分解反应④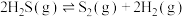
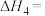
Ⅱ.可利用 与反应制备
与反应制备
(2)根据文献,将
 和
和 的混合气体导入石英管反应器热解,发生反应:
的混合气体导入石英管反应器热解,发生反应:反应Ⅰ:
反应Ⅱ: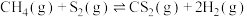
总反应: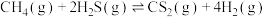
投料按体积之比 ,并用
,并用 稀释;甲烷和硫化氢的混合气体以一定流速通过石英管;常压、不同温度下反应相同时间后,测得和体积分数如下表:
稀释;甲烷和硫化氢的混合气体以一定流速通过石英管;常压、不同温度下反应相同时间后,测得和体积分数如下表:
温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
在1000℃、常压下,保持通入 体积分数
体积分数 不变,提高投料比
不变,提高投料比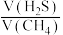 ,
, 的转化率不变,其原因是
的转化率不变,其原因是
(3)实验测定,在950~1150℃范围内(其他条件不变),
 的体积分数随温度升高先增大而后减小,其原因可能是
的体积分数随温度升高先增大而后减小,其原因可能是(4)理论计算表明,在压强为1.1MPa,原料初始组成
 ,只发生反应:
,只发生反应: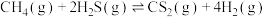 ,达到平衡时四种组分的物质的量分数随温度T的变化如下图所示。
,达到平衡时四种组分的物质的量分数随温度T的变化如下图所示。
①图中表示 、
、 变化的曲线分别是
变化的曲线分别是
②800℃时,反应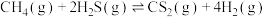 的
的
Ⅲ.可利用间接制备单质硫
(5)先用足量
 溶液吸收
溶液吸收 气体,再将吸收后的溶液用如下图所示的装置电解,碱性条件下,
气体,再将吸收后的溶液用如下图所示的装置电解,碱性条件下, 被氧化生成
被氧化生成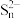 。取阳极区电解后的溶液,加入硫酸可得到单质硫。
。取阳极区电解后的溶液,加入硫酸可得到单质硫。
①图中隔膜应使用
②阳极电极反应式为
您最近一年使用:0次
名校
4 . Ⅰ.三甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂,对臭氧层无破坏作用。
(1)利用水煤气合成二甲醚的三步反应如下:
①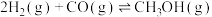
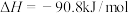
②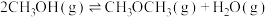
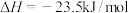
③

总反应: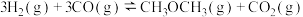 的
的 =
=______ 。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,下列选项中可以采取的措施是______ (填字母)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
(2)已知上述(1)中反应②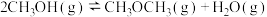 在某温度下的平衡常数为100。此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
在某温度下的平衡常数为100。此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
①比较此时正、逆反应速率的大小:
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②若在此密闭容器中开始时加入21molCH3OH,则达到平衡时c(CH3OH)=______ 。
Ⅱ.化学反应: 常用于精盐中碘含量测定。
常用于精盐中碘含量测定。
(3)某同学利用上述反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______ (填序号)。
①1mL0.01mol/L的碘水
②1mL0.001mol/L的碘水
③4mL0.01mol/L的Na2S2O3溶液
④4mL0.001mol/L的Na2S2O3溶液
(4)若某同学选取(3)中试剂①③进行实验,测得褪色时间为2s,则
______ (结果保留两位有效数字)。
Ⅲ.工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理,
,它们会对人类及生态系统产生很大的伤害,必须进行处理,
常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为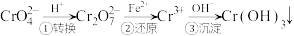
(5)流程第①步存在平衡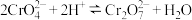 ,能说明第①步反应达平衡状态的是
,能说明第①步反应达平衡状态的是______ (填字母)。
A. 和
和 的浓度相同
的浓度相同
B.
C.溶液的颜色不变
(6)流程第③步生成的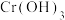 在溶液中存在沉淀溶解平衡:
在溶液中存在沉淀溶解平衡: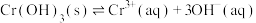 。常温下
。常温下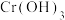 的溶度积
的溶度积 ,当
,当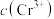 降至
降至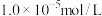 时溶液的pH为
时溶液的pH为______ 。
方法2:电解法
该法用Fe做电极电解含 的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生
的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生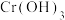 沉淀。请用电极反应方程式解释下列问题:
沉淀。请用电极反应方程式解释下列问题:
(7)用Fe作电极的原因是______ ,阴极附近溶液pH升高的原因是______ 。
(1)利用水煤气合成二甲醚的三步反应如下:
①
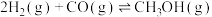
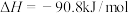
②
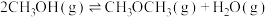
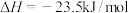
③


总反应:
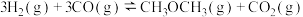 的
的 =
=a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
(2)已知上述(1)中反应②
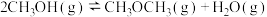 在某温度下的平衡常数为100。此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
在某温度下的平衡常数为100。此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:物质 |
|
|
|
物质的量/mol | 4.0 | 6.0 | 6.0 |

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②若在此密闭容器中开始时加入21molCH3OH,则达到平衡时c(CH3OH)=
Ⅱ.化学反应:
 常用于精盐中碘含量测定。
常用于精盐中碘含量测定。(3)某同学利用上述反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择
①1mL0.01mol/L的碘水
②1mL0.001mol/L的碘水
③4mL0.01mol/L的Na2S2O3溶液
④4mL0.001mol/L的Na2S2O3溶液
(4)若某同学选取(3)中试剂①③进行实验,测得褪色时间为2s,则

Ⅲ.工业废水中常含有一定量的
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理,
,它们会对人类及生态系统产生很大的伤害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
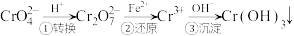
(5)流程第①步存在平衡
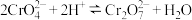 ,能说明第①步反应达平衡状态的是
,能说明第①步反应达平衡状态的是A.
 和
和 的浓度相同
的浓度相同B.

C.溶液的颜色不变
(6)流程第③步生成的
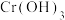 在溶液中存在沉淀溶解平衡:
在溶液中存在沉淀溶解平衡: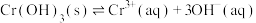 。常温下
。常温下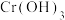 的溶度积
的溶度积 ,当
,当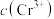 降至
降至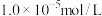 时溶液的pH为
时溶液的pH为方法2:电解法
该法用Fe做电极电解含
 的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生
的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生 沉淀。请用电极反应方程式解释下列问题:
沉淀。请用电极反应方程式解释下列问题:(7)用Fe作电极的原因是
您最近一年使用:0次
名校
5 . NOx储存还原技术法(NSR)利用催化剂消除汽车尾气中的NOx,其原理: △H。
△H。
(1)已知:① △H1;②
△H1;②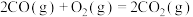 △H2;用含△H1和△H2的代数式表示△H=
△H2;用含△H1和△H2的代数式表示△H=___________ kJ⋅mol-1.汽车发动机工作时,会引发反应①,其能量变化如图所示。则△H1=___________ kJ⋅mol-1。

(2)NSR反应机理及相对能量如下图(TS表示过渡态):

反应过程中,决速步骤的热化学方程式为___________ 。
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

线a和b中,表示在该温度下使用NSR催化技术的是曲线_________ (选填“a”或“b”)。线a中前5min内CO的平均反应速率v(CO)=________ ;此温度下该反应的平衡常数K=_________ 。
(4)保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)________ v(逆)(选填“>”“<”或“=”)。
(5)若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点___________ (选填“A”“B”“C”“D”或“E”)。
 △H。
△H。(1)已知:①
 △H1;②
△H1;②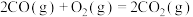 △H2;用含△H1和△H2的代数式表示△H=
△H2;用含△H1和△H2的代数式表示△H=
(2)NSR反应机理及相对能量如下图(TS表示过渡态):

反应过程中,决速步骤的热化学方程式为
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

线a和b中,表示在该温度下使用NSR催化技术的是曲线
(4)保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)
(5)若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点
您最近一年使用:0次
名校
6 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:
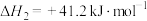
反应Ⅲ:
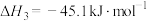
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。(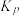 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:

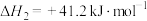
反应Ⅲ:

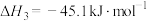
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。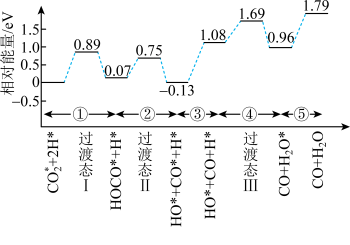

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。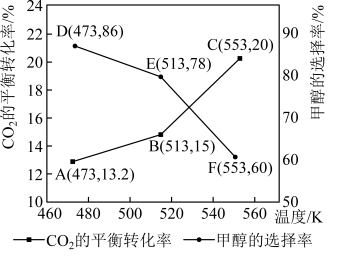
②553K时,若反应后体系的总压为p,反应Ⅰ的

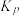 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
259次组卷
|
5卷引用:湖南省平江县颐华高级中学2023-2024学年高三下学期入学考试化学试题
7 . 甲烷—二氧化碳重整和甲烷水蒸气—二氧化碳双重整技术(CSCRM)均能将 和
和 温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。
温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。
回答下列问题:
Ⅰ.甲烷—二氧化碳重整: 重整
重整 的催化转化原理如图1所示。
的催化转化原理如图1所示。

(1)已知相关反应的能量变化如图2所示。

则过程i的热化学方程式为_______ 。
(2)过程ii的总反应可表示为_______ 。
(3)向一刚性密闭容器中,充入物质的量比为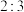 的
的 和
和 ,总压为
,总压为 ,加热到一定温度使其发生过程i的反应。
,加热到一定温度使其发生过程i的反应。
①达到平衡后测得体系压强是起始时的1.76倍,则该反应的平衡常数的计算式为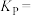
_______ 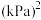 (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。
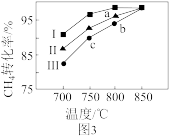
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应进行相同时间后, 的转化率随反应温度的变化如图3所示。a点所代表的状态
的转化率随反应温度的变化如图3所示。a点所代表的状态_______ (填“是”或“不是”)平衡状态;b点 的转化率高于c点,原因是
的转化率高于c点,原因是_______ 。
Ⅱ.甲烷水蒸气—二氧化碳双重整技术(CSCRM):在原料气中通入水蒸气来缓解积碳,发生的主要反应的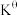 与温度关系如图4,已知各反应原理如下,其中
与温度关系如图4,已知各反应原理如下,其中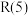 与
与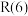 为积碳反应。
为积碳反应。

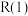
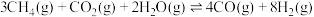

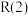
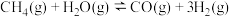

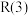
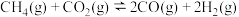

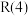
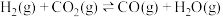

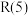
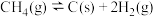

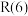

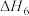
(4)
_______ 0(填“>”或“<”)。
(5)已知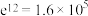 ,综合分析进料气
,综合分析进料气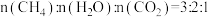 时制备合成气的最佳温度为
时制备合成气的最佳温度为_______ ;通入水蒸气能缓解积碳的原因为_______ 。
 和
和 温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。
温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。回答下列问题:
Ⅰ.甲烷—二氧化碳重整:
 重整
重整 的催化转化原理如图1所示。
的催化转化原理如图1所示。
(1)已知相关反应的能量变化如图2所示。

则过程i的热化学方程式为
(2)过程ii的总反应可表示为
(3)向一刚性密闭容器中,充入物质的量比为
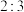 的
的 和
和 ,总压为
,总压为 ,加热到一定温度使其发生过程i的反应。
,加热到一定温度使其发生过程i的反应。①达到平衡后测得体系压强是起始时的1.76倍,则该反应的平衡常数的计算式为
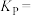
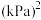 (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应进行相同时间后,
 的转化率随反应温度的变化如图3所示。a点所代表的状态
的转化率随反应温度的变化如图3所示。a点所代表的状态 的转化率高于c点,原因是
的转化率高于c点,原因是
Ⅱ.甲烷水蒸气—二氧化碳双重整技术(CSCRM):在原料气中通入水蒸气来缓解积碳,发生的主要反应的
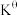 与温度关系如图4,已知各反应原理如下,其中
与温度关系如图4,已知各反应原理如下,其中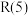 与
与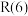 为积碳反应。
为积碳反应。
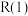
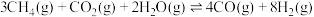

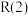
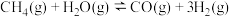

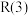
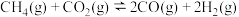

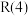
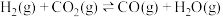

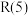
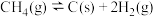

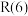

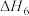
(4)

(5)已知
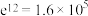 ,综合分析进料气
,综合分析进料气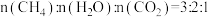 时制备合成气的最佳温度为
时制备合成气的最佳温度为
您最近一年使用:0次
2022-11-15更新
|
118次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期3月月考化学试题
8 . 某科研组对 气体深入研究,发现
气体深入研究,发现 很不稳定,经过实践提出如下反应机理:
很不稳定,经过实践提出如下反应机理:

回答下列问题
(1)
___________ 。
(2)①已知 ,起始时
,起始时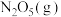 为35.8
为35.8 ,分解的反应速率
,分解的反应速率 。恒温恒容时,
。恒温恒容时, 测得体系中
测得体系中 ,则此时的分解的反应速率
,则此时的分解的反应速率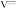
___________ 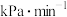 。
。
②T温度时,向2L密闭容器中加入 ,
,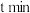 时
时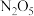 完全分解,体系达平衡状态,气体压强是反应前的2倍,则该温度下
完全分解,体系达平衡状态,气体压强是反应前的2倍,则该温度下 的平衡常数K=
的平衡常数K=___________ 。
③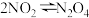 ,在体积均为
,在体积均为 的容器中,不同温度下二氧化氮浓度变化与反应时间的关系如图所示,下列说法错误的是
的容器中,不同温度下二氧化氮浓度变化与反应时间的关系如图所示,下列说法错误的是___________ (填标号)。

A.
B.a点逆反应速率小于c点正反应速率
c。 ℃ 10
℃ 10 时二氧化氮速率为0.05
时二氧化氮速率为0.05
D. ℃ 20
℃ 20 时改变的条件可能是充入一定量的
时改变的条件可能是充入一定量的
(3)①氯气和硝酸银在无水环境中可制得 ,同时得到一种气态单质A,该反应的化学方程式是
,同时得到一种气态单质A,该反应的化学方程式是___________ 。
②Peter提出了一种用惰性电极作阳极硝酸电解脱水法制备 ,其原理如下图所示。阳极制得
,其原理如下图所示。阳极制得 和A,其电极反应式为
和A,其电极反应式为___________ 。每生成1 ,两极共产生气体
,两极共产生气体___________ L(标准状况下)。

 气体深入研究,发现
气体深入研究,发现 很不稳定,经过实践提出如下反应机理:
很不稳定,经过实践提出如下反应机理:

回答下列问题
(1)

(2)①已知
 ,起始时
,起始时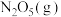 为35.8
为35.8 ,分解的反应速率
,分解的反应速率 。恒温恒容时,
。恒温恒容时, 测得体系中
测得体系中 ,则此时的分解的反应速率
,则此时的分解的反应速率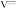
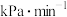 。
。②T温度时,向2L密闭容器中加入
 ,
,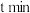 时
时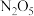 完全分解,体系达平衡状态,气体压强是反应前的2倍,则该温度下
完全分解,体系达平衡状态,气体压强是反应前的2倍,则该温度下 的平衡常数K=
的平衡常数K=③
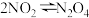 ,在体积均为
,在体积均为 的容器中,不同温度下二氧化氮浓度变化与反应时间的关系如图所示,下列说法错误的是
的容器中,不同温度下二氧化氮浓度变化与反应时间的关系如图所示,下列说法错误的是
A.

B.a点逆反应速率小于c点正反应速率
c。
 ℃ 10
℃ 10 时二氧化氮速率为0.05
时二氧化氮速率为0.05
D.
 ℃ 20
℃ 20 时改变的条件可能是充入一定量的
时改变的条件可能是充入一定量的
(3)①氯气和硝酸银在无水环境中可制得
 ,同时得到一种气态单质A,该反应的化学方程式是
,同时得到一种气态单质A,该反应的化学方程式是②Peter提出了一种用惰性电极作阳极硝酸电解脱水法制备
 ,其原理如下图所示。阳极制得
,其原理如下图所示。阳极制得 和A,其电极反应式为
和A,其电极反应式为 ,两极共产生气体
,两极共产生气体
您最近一年使用:0次
2021-05-15更新
|
238次组卷
|
2卷引用:湖南省常德市临澧县第一中学2023-2024学年高二下学期入学考试化学试题




