1 . 相同条件下,在固定容积的密闭容器中选用不同的催化剂(a、b、c)发生反应:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
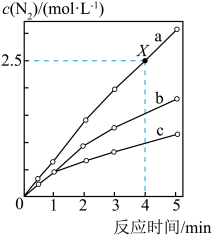
 5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
| A.催化剂的催化效率:a>b>c |
| B.X点时,NH3的化学反应速率为0.5 mol·L-1·min-1 |
| C.使用催化剂a、b、c达到平衡时NO的转化率相等 |
| D.若在恒容绝热的密闭容器中发生该反应,当K值不变时,说明反应已经达到平衡 |
您最近一年使用:0次
名校
解题方法
2 . 乙烯作为现代有机合成的重要原料,研究其制备方法具有重要的意义。
回答下列问题:
I.乙烷制备乙烯
(1)某温度、 下,向反应器中充入
下,向反应器中充入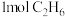 只发生反应
只发生反应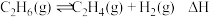 ,
, 的平衡转化率为
的平衡转化率为 ;保持温度和压强不变,向反应器中再充入水蒸气,
;保持温度和压强不变,向反应器中再充入水蒸气, 后达到平衡,此时
后达到平衡,此时 的平衡转化率为
的平衡转化率为 ,需要向反应器中充入
,需要向反应器中充入___________  水蒸气;用压强变化表示的
水蒸气;用压强变化表示的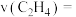
___________  ;此时该反应的
;此时该反应的
___________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压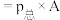 的物质的量分数)。
的物质的量分数)。
(2) 为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是
为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是___________ (填元素符号),结构中1处 的键角
的键角___________ (填“大于”“小于”或“等于”)2处 的键角。
的键角。
在催化剂作用下,二氧化碳可制取乙烯,发生以下反应:
①
②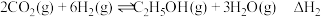
③
(3)
___________  。
。
(4)若将 和
和 按物质的量之比
按物质的量之比 混合,在
混合,在 恒压反应器中连续反应,测得
恒压反应器中连续反应,测得 的转化率与
的转化率与 、
、 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。 的转化率曲线是
的转化率曲线是___________ (填“X”“Y”或“Z”,下同), 的选择性曲线是
的选择性曲线是___________ ,说明判断依据:___________ 。
回答下列问题:
I.乙烷制备乙烯
(1)某温度、
 下,向反应器中充入
下,向反应器中充入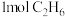 只发生反应
只发生反应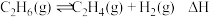 ,
, 的平衡转化率为
的平衡转化率为 ;保持温度和压强不变,向反应器中再充入水蒸气,
;保持温度和压强不变,向反应器中再充入水蒸气, 后达到平衡,此时
后达到平衡,此时 的平衡转化率为
的平衡转化率为 ,需要向反应器中充入
,需要向反应器中充入 水蒸气;用压强变化表示的
水蒸气;用压强变化表示的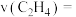
 ;此时该反应的
;此时该反应的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压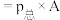 的物质的量分数)。
的物质的量分数)。(2)
 为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是
为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是 的键角
的键角 的键角。
的键角。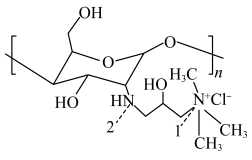
在催化剂作用下,二氧化碳可制取乙烯,发生以下反应:
①

②
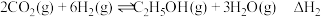
③

(3)

 。
。(4)若将
 和
和 按物质的量之比
按物质的量之比 混合,在
混合,在 恒压反应器中连续反应,测得
恒压反应器中连续反应,测得 的转化率与
的转化率与 、
、 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。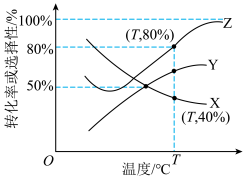
 的转化率曲线是
的转化率曲线是 的选择性曲线是
的选择性曲线是
您最近一年使用:0次
名校
3 . 工业上,常用离子交换法软化自来水,其原理是 ,
, 。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中
。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是
 ,
, 。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中
。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是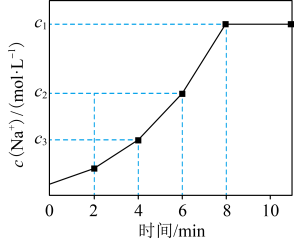
| A.反应达到平衡后,加入少量NaCl,离子交换反应的平衡常数减小 |
| B.6 min时的逆反应速率大于4 min时的逆反应速率 |
| C.其他条件不变时,10 min时离子交换反应已停止 |
D.4~8 min内平均反应速率: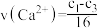 mol⋅L mol⋅L ⋅min ⋅min |
您最近一年使用:0次
2024-04-10更新
|
406次组卷
|
3卷引用:甘肃省靖远县2024届高三下学期第三次联考化学试题
解题方法
4 . 二氧化碳加氢制甲烷过程中的主要反应如下:
反应Ⅰ: ΔH1
ΔH1
反应Ⅱ: ΔH2
ΔH2
(1)已知CH4(g)、H2(g)的燃烧热ΔH依次为-893 kJ·mol-1、-285.8 kJ·mol-1;H2O(g)=H2O(1) ΔH3=-44 kJ·mol-1,则ΔH1=___________ kJ·mol-1。
(2)已知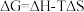 ,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
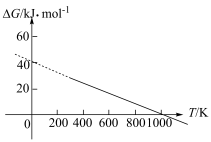
①反应Ⅱ自发进行的温度范围为___________ ;ΔH2=___________ 。
②1000 K时,将等物质的量的CO2和H2投入恒压密闭容器中,假设只发生反应Ⅱ,t min时达平衡状态,用CO2的分压变化表示t min内的平均反应速率v(CO2)=___________ kPa/min(用含t的表达式作答)(已知:分压=总压×物质的量的分数)。
(3)在恒压(p0 kPa)密闭容器中,通入5 mol CO2和20 mol H2反应,平衡时含碳物质的物质的量随温度的变化如图所示:
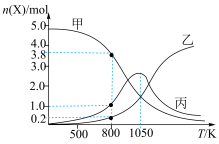
①曲线丙代表的物质的物质的量随温度升高先增大后减小的原因是___________ 。
②CH4的选择性可表示为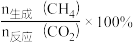 。800 K下,反应达平衡时,CH4的选择性为
。800 K下,反应达平衡时,CH4的选择性为___________ ,反应Ⅰ的分压平衡常数Kp=___________ (列出计算式即可)。
反应Ⅰ:
 ΔH1
ΔH1反应Ⅱ:
 ΔH2
ΔH2(1)已知CH4(g)、H2(g)的燃烧热ΔH依次为-893 kJ·mol-1、-285.8 kJ·mol-1;H2O(g)=H2O(1) ΔH3=-44 kJ·mol-1,则ΔH1=
(2)已知
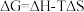 ,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
①反应Ⅱ自发进行的温度范围为
②1000 K时,将等物质的量的CO2和H2投入恒压密闭容器中,假设只发生反应Ⅱ,t min时达平衡状态,用CO2的分压变化表示t min内的平均反应速率v(CO2)=
(3)在恒压(p0 kPa)密闭容器中,通入5 mol CO2和20 mol H2反应,平衡时含碳物质的物质的量随温度的变化如图所示:

①曲线丙代表的物质的物质的量随温度升高先增大后减小的原因是
②CH4的选择性可表示为
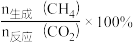 。800 K下,反应达平衡时,CH4的选择性为
。800 K下,反应达平衡时,CH4的选择性为
您最近一年使用:0次
2024·江西宜春·模拟预测
名校
5 . CO、SO2等烟道气对环境有污染,需经处理后才能排放,处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为单质 :
:
 。回答下列问题:
。回答下列问题:
(1)已知CO的燃烧热1为任意常数283.0 kJ⋅mol-1,
 kJ⋅mol-1。则上述反应的
kJ⋅mol-1。则上述反应的
___________ kJ⋅mol-1。
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是___________ 。某种铁镍合金的立方晶胞如图2所示,铁原子的配位数为___________ ,晶体中,铁与镍数目之比为___________ 。
___________ mol⋅L-1⋅min-1。
②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是___________ (填字母)。
a.选用更高效的催化剂 b.升高温度
c.及时分离出CO2 d.增加CO的浓度的平衡转化率
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图4所示。 、
、 、
、 由大到小的关系是
由大到小的关系是___________ 。
②B点对应条件下
___________ [对于反应 ,
, ,x为物质的量分数]。
,x为物质的量分数]。
③A点和C点压强平衡常数之比为___________ (用分压代替浓度,分压=总压×物质的量分数)。
 :
:
 。回答下列问题:
。回答下列问题:(1)已知CO的燃烧热1为任意常数283.0 kJ⋅mol-1,

 kJ⋅mol-1。则上述反应的
kJ⋅mol-1。则上述反应的
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是



②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度
c.及时分离出CO2 d.增加CO的浓度的平衡转化率
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图4所示。

 、
、 、
、 由大到小的关系是
由大到小的关系是②B点对应条件下

 ,
, ,x为物质的量分数]。
,x为物质的量分数]。③A点和C点压强平衡常数之比为
您最近一年使用:0次
2024-02-01更新
|
289次组卷
|
3卷引用:专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省宜春市第一中学2023-2024学年高三上学期1月质量检测化学试题山西省忻州市2023-2024学年高三上学期1月期末理综试题-高中化学
2024·山西晋城·一模
6 . 氨是一种重要的化工产品。回答下列问题:
(1)已知:①N2(g)+3H2(g) 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol
②H2(g)+ O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol
③2Fe(s)+ O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol
则反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=___________ kJ/mol,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=___________ MPa·min-1。
②反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=___________ (MPa)2 (列出计算式即可);若升高温度,该反应的平衡常数将___________ (填“增大”“减小”或“不变”)。
(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:
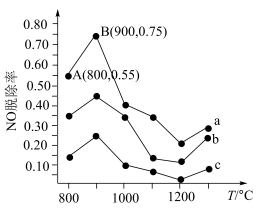
①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是___________ 。
②曲线b对应的NH3与NO的物质的量之比是___________ 。
(1)已知:①N2(g)+3H2(g)
 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol②H2(g)+
 O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol③2Fe(s)+
 O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol则反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
| A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.合成氨反应在不同温度下的ΔH和ΔS都小于零 |
| C.NH3易液化,不断将液氨移去,利于反应正向进行 |
| D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生 |
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=
②反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:

①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是
②曲线b对应的NH3与NO的物质的量之比是
您最近一年使用:0次
23-24高三上·安徽亳州·期末
名校
7 . 研究表明,用可控 界面材料也可催化
界面材料也可催化 还原合成甲醇:
还原合成甲醇: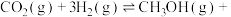

 。将6.0
。将6.0
 和8.0
和8.0
 充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35
充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35 ,
, 的物质的量随时间的变化如图中实线所示。下列说法正确的是
的物质的量随时间的变化如图中实线所示。下列说法正确的是

 界面材料也可催化
界面材料也可催化 还原合成甲醇:
还原合成甲醇: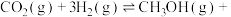

 。将6.0
。将6.0
 和8.0
和8.0
 充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35
充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35 ,
, 的物质的量随时间的变化如图中实线所示。下列说法正确的是
的物质的量随时间的变化如图中实线所示。下列说法正确的是
A.1~4min(实线)内, 约为 约为 |
B.该条件下的实线对应的 为0.02 为0.02 |
| C.要变成虚线,可能的条件是升高温度或加入催化剂 |
| D.当气体的平均摩尔质量或密度一定时,化学反应达平衡状态 |
您最近一年使用:0次
2024-02-01更新
|
156次组卷
|
4卷引用:专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)安徽省亳州市2023-2024学年高三上学期期末考试化学试题河南省郑州市宇华实验学校2023-2024学年高三下学期开学化学试题(已下线)选择题11-16
2024·安徽·模拟预测
解题方法
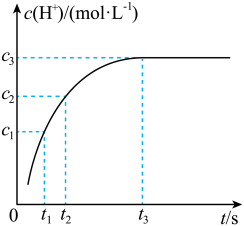
8 . 稀土被称为新材料的宝库。稀土中的镧系离于可用离子交换法分离,其反应可表示为: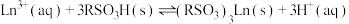 。某温度时,
。某温度时, 随时间变化关系如图所示。下列说法正确的是
随时间变化关系如图所示。下列说法正确的是
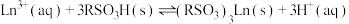 。某温度时,
。某温度时, 随时间变化关系如图所示。下列说法正确的是
随时间变化关系如图所示。下列说法正确的是
A. 时的正反应速率大于 时的正反应速率大于 时的逆反应速率 时的逆反应速率 |
B. 时间段的平均反应速率为: 时间段的平均反应速率为: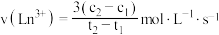 |
C. 时增大 时增大 ,该平衡左移,平衡常数减小 ,该平衡左移,平衡常数减小 |
D. 时离子交换反应停止 时离子交换反应停止 |
您最近一年使用:0次
2024-01-22更新
|
810次组卷
|
6卷引用:专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)选择题6-10(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点13 化学反应速率与化学平衡江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
9 . 在恒温下,向容积为2L的恒容容器中加入一定量的碳单质和2molH2O(g),初始压强为105Pa。发生反应: ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。
(1)该反应自发进行的条件是__________ 。(填“高温”或“低温”或“任意条件”)
(2)2min内H2O的平均反应速率为__________ mol/(L·min)。
(3)2min平衡时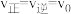 ,采取下列措施后,使
,采取下列措施后,使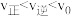 的是__________。
的是__________。
(4)平衡常数Kp=__________ Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)下列说法正确的是__________。
 ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。(1)该反应自发进行的条件是
(2)2min内H2O的平均反应速率为
(3)2min平衡时
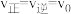 ,采取下列措施后,使
,采取下列措施后,使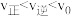 的是__________。
的是__________。| A.恒温恒容下,除去部分H2O | B.降低温度 |
| C.恒温恒容下,充入Ar | D.恒温恒压下,充入Ar |
(5)下列说法正确的是__________。
| A.增加碳单质,可以加快该反应速率 |
| B.2min时,H2O的转化率为20% |
| C.当混合气体的平均摩尔质量不再变化时,可以判断该反应达到了平衡 |
| D.平衡后向体系内补加0.4molH2O(g)和0.4molCO(g),反应向逆反应方向进行 |
您最近一年使用:0次
2023-12-11更新
|
176次组卷
|
2卷引用:甘肃省武威第七中学2023-2024学年高二上学期期末考试化学试题
名校
10 . 向100mL 的HCl溶液中投入一片质量为1.625g的Zn片,测得溶液中
的HCl溶液中投入一片质量为1.625g的Zn片,测得溶液中 与反应时间的关系如表。下列说法正确的是
与反应时间的关系如表。下列说法正确的是
 的HCl溶液中投入一片质量为1.625g的Zn片,测得溶液中
的HCl溶液中投入一片质量为1.625g的Zn片,测得溶液中 与反应时间的关系如表。下列说法正确的是
与反应时间的关系如表。下列说法正确的是| 反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
 | 0.5 | 0.3 | 0.2 | a | 0.08 | 0.05 | 0.03 |
A. |
B.2min~4min内, |
C.0min~4min内, |
D.若向HCl溶液中滴加少量 溶液,得到的氢气的量不变 溶液,得到的氢气的量不变 |
您最近一年使用:0次
2023-10-05更新
|
39次组卷
|
3卷引用:甘肃省白银市靖远县2023-2024学年高二上学期11月期中联考化学试题



