真题
1 . Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表_______ (表中不要留空格)。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:____________________________ 。
(4)实验③得出的结论是:pH等于10时,___________________________________ 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:_____________________________________ 。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表
| 实验 编号 | 实验目的 | T/K | PH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。

(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率: (p-CP)=
(p-CP)=
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
(4)实验③得出的结论是:pH等于10时,
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
您最近一年使用:0次
2019-01-30更新
|
1288次组卷
|
11卷引用:09高考真题汇编—实验设计与评价 综合性实验
09高考真题汇编—实验设计与评价 综合性实验2009年普通高等学校招生统一考试理综试题化学部分(安徽卷)鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 方法帮(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度(已下线)第6章 化学反应速率和化学平衡复习-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)上海市徐汇区2021-2022学年高一下学期6月自评化学试题(已下线)2010年湖南省浏阳一中高二上学期期中考试化学试题(已下线)2010—2011学年安徽省师大附中高二下学期期中考查化学试卷(已下线)2010~2011学年广东省佛山一中高二下学期期末考试化学(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷
真题
2 . 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=_____________________________ 。
②该温度下,在2L盛有 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___________________________ 。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①________________________________ ②__________________________________ ;
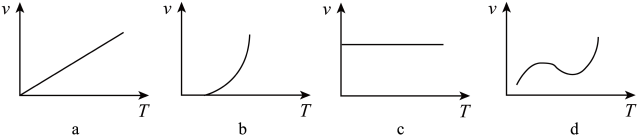
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___________ 。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:_________________________ 。
欲使上述体系中 浓度增加,可加入的物质是
浓度增加,可加入的物质是____________________ 。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有
 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是

(4)写出氢氧化铝在水中发生酸式电离的电离方程式:
欲使上述体系中
 浓度增加,可加入的物质是
浓度增加,可加入的物质是
您最近一年使用:0次
2019-01-30更新
|
1117次组卷
|
6卷引用:2009高考真题汇编-无机综合题
2009高考真题汇编-无机综合题2009高考真题汇编-几种重要的金属2009年普通高等学校招生统一考试化学试题(上海卷)(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)2011-2012学年吉林省扶余一中高二上学期期中考试化学试卷(已下线)2012届浙江省苍南县灵溪二高高三第二次月考化学试卷
真题
3 . 在溶液中,反映 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为 、
、 及
及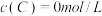 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________ ;
③______________ ;
(2)实验②平衡时B的转化率为_________ ;实验③平衡时C的浓度为__________ ;
(3)该反应的 >0,判断其理由是
>0,判断其理由是________________ ;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: =
=___________ ;
实验③: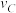 =
=_______________ 。
 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为 、
、 及
及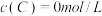 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②
③
(2)实验②平衡时B的转化率为
(3)该反应的
 >0,判断其理由是
>0,判断其理由是(4)该反应进行到4.0min时的平均反应速度率:
实验②:
 =
=实验③:
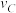 =
=
您最近一年使用:0次
2019-01-30更新
|
56次组卷
|
4卷引用:2010年高考化学试题分项专题八 化学反应速率和化学平衡
2010年高考化学试题分项专题八 化学反应速率和化学平衡2010年高考化学试题分项专题十四 化学计算2010年高考(全国IB卷)理综化学部分卷(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷
真题
名校
4 . 对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
| A.v(W)=3v(Z) | B.2v(X)=3v(Z) | C.2v(X)=v(Y) | D.3v(W)=2v(X) |
您最近一年使用:0次
2019-01-30更新
|
5584次组卷
|
126卷引用:2010年高考化学试题分项专题八 化学反应速率和化学平衡
2010年高考化学试题分项专题八 化学反应速率和化学平衡2010年普通高等学校招生全国统一考试化学试题(海南卷)(已下线)2010年辽宁省本溪市高一下学期期末考试化学A卷(已下线)2013-2014浙江省宁波市高一下学期期末考试化学试卷2015-2016学年山西省怀仁一中高一下期中化学试卷2015-2016学年北大附中河南分校高一下期末化学试卷2015-2016学年湖南省娄底市重点中学高一下学期期末化学试卷甘肃省兰州第一中学2016-2017学年高一下学期期中考试化学试题湖南省宁远县第一中学2016-2017学年高一下学期期中考试化学试题贵州市兴义市第八中学2016-2017学年高一下学期期中考试化学试题湖南省邵阳市第二中学2016-2017学年高一下学期期末考试(理)化学试题湖南省邵阳市第二中学2016-2017学年高一下学期期末考试(文)化学试题【全国百强校】新疆生产建设兵团第二中学2017-2018学年高一下学期期中考试化学试题【全国百强校】北京101中学2017-2018学年高一下学期期中考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高一下学期期末考试化学试题步步为赢 高一化学暑假作业:作业十九 综合评估新疆阿克苏市高级中学2018-2019学年高一下学期期末考试化学试题黑龙江省哈尔滨市第六中学2018-2019学年高一下学期期末考试化学试题课时1 化学反应速率——A学习区 夯实基础(苏教版必修2)新疆昌吉市教育共同体2019-2020学年高一下学期期中考试化学试题江苏省徐州市2018~2019学年高一下学期期末抽测化学试题江西省宜春市高安中学2019-2020学年高一下学期期中考试化学(B)试题黑龙江省哈尔滨市双城区兆麟中学2019-2020学年度高一下学期期中考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高一下学期期末考试化学试题甘肃省武威市第十八中学2019-2020学年高一下学期期末模拟考试化学试题黑龙江省大庆市肇州县第二中学2019-2020学年高一下学期期末考试化学试题吉林省松原市前郭尔罗斯蒙古族自治县蒙古族中学2019-2020学年高一下学期网课检测化学试题云南省弥勒市第一中学2019-2020学年高一下学期化学期末复习题吉林省长春实验中学2019-2020学年高一6月月考化学试题(已下线)6.1.1 化学反应速率 练习-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)陕西省宝鸡市千阳中学2019-2020学年高一下学期月考化学试题吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题内蒙古自治区乌拉特前旗第一中学2020-2021学年高一下学期4月月考化学试题(已下线)6.1.1 化学反应速率(第1课时 化学反应速率的概念和简单计算)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)湖南省常德市鼎城区第一中学2021-2022学年高一下学期4月月考化学试题陕西省西安市周至县第四中学2021-2022学年高一下学期期中考试化学试题黑龙江省饶河县高级中学2021-2022学年高一下学期期中考试化学试题吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题湖北省宜昌市协作体2022-2023学年高一下学期期中考试化学试题河北省河北南宫中学2022-2023学年高一下学期5月月考化学试题内蒙古乌兰浩特市第四中学2022-2023学年高一下学期第三次月考化学试题河北省沧州市东光县等三县联考2022-2023学年高一下学期4月月考化学试题(已下线)合格考汇编13化学反应速率和限度(已下线)2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷(已下线)2010年河北省黄骅中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省宁阳四中高二上学期期中学分认定化学试卷(已下线)2011-2012学年云南蒙自高中高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2013-2014学年山东省临沂市重点中学高二上学期期中考试化学试卷(已下线)2014秋季甘肃省白银市一中高二第一学期期中理科化学试卷2015-2016学年河北省定兴第三中学高二上学期第一次月考化学试卷2015-2016学年甘肃省张掖二中高二上学期10月月考化学试卷2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷2016-2017学年河南郑州外国语学校高二上开学考试化学2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2016-2017学年江西省玉山一中高二上第一次月考化学卷2016-2017学年河南省新乡市延津县中学高二上第一次月考化学卷2016-2017学年广西宾阳中学高二上9月月考化学试卷2016-2017学年江西省赣州市十四校高二上学期期中化学试卷河南省平顶山市郏县第一高级中学2017-2018学年高二上学期第一次月考化学试题河北省涞水波峰中学2017-2018学年高二(实验班)上学期9月月考化学试题2018届高三一轮复习化学:微考点53-化学反应速率的计算河北省武邑中学2017-2018学年高二上学期第一次月考化学试题江西省南昌市第二中学2017-2018学年高二上学期第一次月考化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三中学2017-2018学年高二上学期期中考试化学试题云南省曲靖市宣威市第三中学2017-2018学年高二下学期3月月考化学试题(已下线)2018年9月4日 《每日一题》人教必修4-化学反应速率的计算河北省蠡县中学2018-2019学年高二上学期第一次(8月)月考化学试题河北省保定市蠡县中学2018-2019学年高二上学期9月月考化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二上学期10月月考化学试题甘肃省岷县第二中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年9月3日《每日一题》 选修4 化学反应速率的计算辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题甘肃省武威市第六中学2019-2020学年高二上学期第二次段考化学试题海南省文昌中学2019-2020学年高二上学期第二次月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题云南省楚雄市实验中学2018—2019学年高二上学期11月月考化学试题云南省绥江县第三中学2019-2020学年高二上学期期末考试化学试题新疆昌吉回族自治州玛纳斯县第一中学2018-2019学年高二上学期第一次月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第一次月考化学试题黑龙江省哈尔滨市宾县第二中学2019-2020学年高二下学期期中考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下期第二次月考化学试题陕西省商洛市洛南中学2020-2021学年高二上学期第一次月考化学试题(已下线)2.1 化学反应速率(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第二章 化学反应速率和化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题宁夏回族自治区青铜峡市高级中学2020-2021学年高二上学期第一次月考化学试题安徽省安庆市宜秀区白泽湖中学2020-2021学年高二上学期第一次月考化学试题四川省自贡市江姐中学2020-2021学年高二上学期第一次月考化学试题湖北省黄石市育英高中2020-2021学年高二上学期第一次月考化学试题海南省海口市灵山中学2020-2021学年高二上学期期中考试化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市金台区2020-2021学年高二上学期期中考试化学(理)试题甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题吉林省吉林市江城中学2021届高三上学期12月月考化学试题甘肃省武威市民勤县第四中学2020-2021学年高二下学期第一次月考化学(普通班)试题(已下线)2.1.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题新疆阜康市第一中学2021-2022学年高二上学期第一次月考化学试题新疆阿克苏地区拜城县第一中学2021-2022学年高二上学期第一次月考化学试题河南省濮阳县实验高中2021-2022学年高二上学期第二次月考化学试题山西省天镇县实验中学2021-2022学年高二上学期期中考试化学试题广东省湛江市第二十一中学2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期期末考试化学试题(已下线)2.1.1 化学反应速率的表示方法(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江西省芦溪中学2021-2022学年高二上学期第二次段考化学(理)试题福建省福州黎明中学2021-2022学年高二上学期期中考试化学试题(已下线)第26练 化学反应速率-2023年高考化学一轮复习小题多维练(全国通用)新疆叶城县第八中学2021-2022学年高二上学期期末考试化学(理)试题 福建省莆田华侨中学2022-2023学年高二上学期期中考试化学试题上海市闵行(文绮)中学2022-2023学年高二上学期期中考试化学试题广东省兴宁市沐彬中学2022-2023学年高二上学期期中考试化学试题广东省中山大学附属中学2022-2023学年高二上学期期中考试化学试题广东省开平市忠源纪念中学2021-2022学年高二上学期第二次月考化学试题新疆疏附县第一中学2022-2023学年高二上学期期中考试化学试题广西防城港市防城中学2021-2022学年高二上学期期中考试化学试题广西贺州市平桂管理区公会中学2021-2022学年上学期高二第二次月考化学(理)试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题福建省福州第十五中学2022-2023学年高二上学期11月线上限时训练化学试题作业(四) 化学反应速率作业(十三) 化学反应的历程和化学反应速率第二章 第一节 化学反应速率 第1课时 化学反应速率海南省省直辖县级行政单位澄迈县澄迈中学2023-2024学年高二上学期11月期中化学试题
真题
解题方法
5 . 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下, 与空气反映t min后,
与空气反映t min后, 和
和 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则 起始物质的量浓度为
起始物质的量浓度为_______ mol/L ;生成 的化学反应速率为
的化学反应速率为_______ mol/(L·min) 。
②工业制硫酸,尾气 用
用_______ 吸收。
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为_______ 。
②充电过程中,右槽溶液颜色逐渐由_______ 色变为_______ 色。
③放电过程中氢离子的作用是_______ 和_______ ;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为
1023个,左槽溶液中n(H+)的变化量为_______ 。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,
 与空气反映t min后,
与空气反映t min后, 和
和 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则 起始物质的量浓度为
起始物质的量浓度为 的化学反应速率为
的化学反应速率为②工业制硫酸,尾气
 用
用(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由
③放电过程中氢离子的作用是
 1023个,左槽溶液中n(H+)的变化量为
1023个,左槽溶液中n(H+)的变化量为
您最近一年使用:0次
真题
6 . 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为_______ mol/L ;生成SO3的化学反应速率为_______ mol/(L·min) 。
②工业制硫酸,尾气SO2用_______ 吸收。
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为_______ 。
②充电过程中,右槽溶液颜色逐渐由_______ 色变为_______ 色。
③放电过程中氢离子的作用是_______ 和_______ ;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为
1023个,左槽溶液中n(H+)的变化量为_______ 。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为
②工业制硫酸,尾气SO2用
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由
③放电过程中氢离子的作用是
 1023个,左槽溶液中n(H+)的变化量为
1023个,左槽溶液中n(H+)的变化量为
您最近一年使用:0次
真题
名校
7 . 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度

随反应时间变化如右图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是

随反应时间变化如右图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
| A.2.5μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0μmol·L-1·min-1和3.0 μmol·L-1 |
您最近一年使用:0次
2016-12-09更新
|
782次组卷
|
36卷引用:2010年高考化学试题分项专题八 化学反应速率和化学平衡
2010年高考化学试题分项专题八 化学反应速率和化学平衡2010年高考化学试题分项专题十四 化学计算【全国百强校】湖南省师范大学附属中学2017-2018学年高一下学期期中考试化学试题【全国百强校】湖南省师范大学附属中学2017-2018学年高一下学期期中测试化学试题【全国百强校】新疆维吾尔自治区乌鲁木齐八一中学2018-2019学年高一下学期期中考试化学试题湖南省双峰县第一中学2018-2019学年高一6月月考化学试题河北省保定市唐县第一中学2018-2019学年高一下学期期中考试化学试题人教版(2019)高中化学必修第二册第六章《化学反应与能量》检测题福建省福州市福州三中 2018-2019 学年高一下学期期中考试化学试题人教版2019必修第二册 第六章 本章达标检测湖北省襄阳市第五中学2019-2020学年高一下学期6月月考化学试题(已下线)2010-2011学年广东省白云中学高二下学期期中考试化学试卷组卷网合作校特供182015-2016学年山东省武城县第二中学高二上学期第一次月考化学试卷2016届湖北省老河口市第一中学高三上学期期中测试化学试卷2016届湖北省松滋市第一中学高三上学期期中测试化学试卷河南省商丘市第一高级中学2017-2018学年高二10月月考化学试题河南省商丘市第一高级中学2017-2018学年高二上学期10月份月考化学试题【全国百强校】贵州省铜仁市第一中学2019-2020学年高二上学期入学考试化学试题江西省南城县第二中学2018-2019学年高二上学期第二次月考化学试题吉林省白山市抚松县第六中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业二 化学反应速率及其影响因素云南省曲靖市师宗县第二中学2019-2020学年高二上学期期末考试化学试题辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题四川省自贡市江姐中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时1 化学反应速率人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时1 化学反应速率辽宁省六校协作体2020-2021学年高二上学期期中联考化学试题(已下线)练习5 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)选择性必修1(SJ)专题2第一单元课时1 化学反应速率(已下线)2.1.1 化学反应速率的表示方法(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题广西柳州市第三中学2022-2023学年高二上学期10月月考化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题2.1.1化学反应速率的表示方法 课后作业(四) 化学反应速率
真题
解题方法
8 . 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: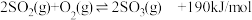
(1)该反应所用的催化剂是_______ (填写化合物名称),该反应450℃时的平衡常数_______ 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是_______ 。
(3)下列可用来判断该可逆反应达到平衡状态的是____________ 。
a.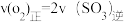 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则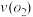 =
=_______ mol·L-1·min,若继续通入0.20mol 和0.10mol
和0.10mol ,则平衡
,则平衡_______ 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______ mol<n( )<
)<_______ mol。
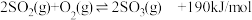
(1)该反应所用的催化剂是
(2)该热化学反应方程式的意义是
(3)下列可用来判断该可逆反应达到平衡状态的是
a.
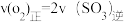 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化 c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol
 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则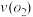 =
= 和0.10mol
和0.10mol ,则平衡
,则平衡 )<
)<
您最近一年使用:0次
真题
9 . 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
________________

(2) 体系中发生反应的化学方程式是___________________________ ;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________ ;
(4) 该反应达到平衡时反应物X的转化率 等于
等于___________________________ ;
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示)则曲线①、②、③所对应的实验条件改变分别是:
①_________________ ②________________ ③__________________
(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2) 体系中发生反应的化学方程式是
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:
(4) 该反应达到平衡时反应物X的转化率
 等于
等于(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示)则曲线①、②、③所对应的实验条件改变分别是:
①
您最近一年使用:0次
2016-12-09更新
|
48次组卷
|
7卷引用:2009高考真题汇编-化学计算
真题
名校
10 . 下列有关化学研究的正确说法是
| A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
| C.依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
| D.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
您最近一年使用:0次
2016-06-13更新
|
84次组卷
|
6卷引用:2010年高考化学试题分项专题六 物质结构和元素周期律



