解题方法
1 . 在2A+B=3C+4D反应中,表示该反应速率最快的是
| A.v(A)=1.5mol·(L·min)−1 | B.v(D)=0.8mol·(L·min)−1 |
| C.v(C)=3.0mol·(L·min)−1 | D.v(B)=1.2mol·(L·min)−1 |
您最近一年使用:0次
解题方法
2 . 工业合成氨的反应如下: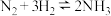 。某温度下,在容积恒定为2.0L的密闭容器中充入
。某温度下,在容积恒定为2.0L的密闭容器中充入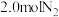 和
和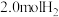 ,一段时间后反应达平衡状态,实验数据如下表所示:
,一段时间后反应达平衡状态,实验数据如下表所示:
(1)0~50s内的平均反应速率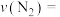
___________ 。
(2)150s时, 的转化率为
的转化率为___________ 。
(3)反应达最大限度时 的体积分数为
的体积分数为___________ %(保留三位有效数字)。
(4)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成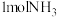 过程中的热量变化
过程中的热量变化___________ 。
(5)为加快反应速率,可以采取的措施___________ 。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离 f.使用适合催化剂
f.使用适合催化剂
(6)下列说法错误的是___________。
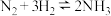 。某温度下,在容积恒定为2.0L的密闭容器中充入
。某温度下,在容积恒定为2.0L的密闭容器中充入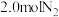 和
和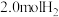 ,一段时间后反应达平衡状态,实验数据如下表所示:
,一段时间后反应达平衡状态,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
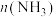 | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率
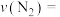
(2)150s时,
 的转化率为
的转化率为(3)反应达最大限度时
 的体积分数为
的体积分数为(4)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成
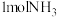 过程中的热量变化
过程中的热量变化(5)为加快反应速率,可以采取的措施
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离
 f.使用适合催化剂
f.使用适合催化剂(6)下列说法错误的是___________。
| A.使用催化剂是为了加快反应速率,提高生产效率 |
B.上述条件下, 不可能100%转化为 不可能100%转化为 |
C.为了提高 的转化率,应适当提高 的转化率,应适当提高 的浓度 的浓度 |
| D.250~350s生成物浓度保持不变,反应停止 |
您最近一年使用:0次
解题方法
3 . 在一密闭容器中进行反应: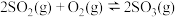 ,已知反应过程中某一时刻
,已知反应过程中某一时刻 、
、 、
、 的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是
的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是
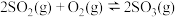 ,已知反应过程中某一时刻
,已知反应过程中某一时刻 、
、 、
、 的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是
的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是A. 为0.2mol/L, 为0.2mol/L, 为0.15mol/L 为0.15mol/L | B. 、 、 均为0.35mol/L 均为0.35mol/L |
C. 为0.4mol/L 为0.4mol/L | D. 为0.35mol/L 为0.35mol/L |
您最近一年使用:0次
名校
4 . 过硫酸钠(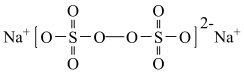 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
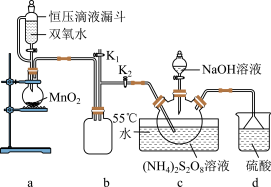
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。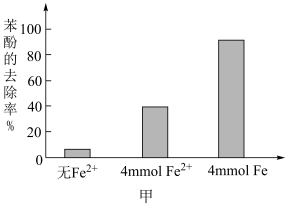
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
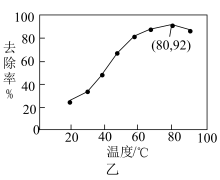
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为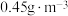 ,
,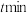 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: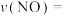
 。
。
您最近一年使用:0次
5 . 常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 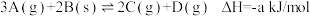 。5min后达平衡,测得容器中n(C)=0.8mol。则下列说法正确的是
。5min后达平衡,测得容器中n(C)=0.8mol。则下列说法正确的是
| A.3v(A)=2v(C)=0.16 mol/(L•min) |
| B.该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) |
| C.升高温度,该平衡正向速率减小,故平衡逆向移动 |
| D.使用催化剂或缩小容器体积,该平衡均不会移动 |
您最近一年使用:0次
解题方法
6 . 以CO、 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

回答下列问题:
(1)已知某反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为__________ 。
(2)向一容积为2L的恒容密闭容器中通入1mol 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为________ Pa。
②0~20min内,用 表示的平均反应速率
表示的平均反应速率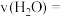
________  ,
, 的平衡浓度
的平衡浓度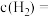
________ 
(3)在一定条件下发生反应Ⅰ、Ⅲ( 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为________ .
(4)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是__________ 。 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数(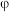 )如图2所示。
)如图2所示。 、
、 和
和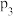 由大到小的顺序是
由大到小的顺序是________ 。
②若在250℃、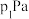 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
________ 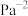 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:Ⅰ.


Ⅱ.


Ⅲ.


Ⅳ.


回答下列问题:
(1)已知某反应的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)向一容积为2L的恒容密闭容器中通入1mol
 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
②0~20min内,用
 表示的平均反应速率
表示的平均反应速率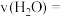
 ,
, 的平衡浓度
的平衡浓度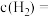

(3)在一定条件下发生反应Ⅰ、Ⅲ(
 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为(4)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是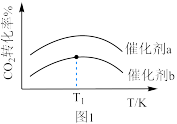
 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数(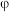 )如图2所示。
)如图2所示。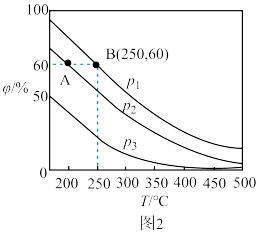
 、
、 和
和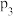 由大到小的顺序是
由大到小的顺序是②若在250℃、
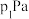 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
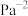 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2024-05-21更新
|
63次组卷
|
2卷引用:河南省九师联盟2023-2024学年高三下学期5月月考理综试题-高中化学
名校
7 . 向体积为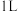 的两密闭容器中各通入
的两密闭容器中各通入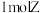 ,分别在恒温、绝热条件下发生:
,分别在恒温、绝热条件下发生: ,测得反应过程中体系压强随时间变化如图。下列说法不正确的是
,测得反应过程中体系压强随时间变化如图。下列说法不正确的是
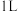 的两密闭容器中各通入
的两密闭容器中各通入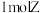 ,分别在恒温、绝热条件下发生:
,分别在恒温、绝热条件下发生: ,测得反应过程中体系压强随时间变化如图。下列说法不正确的是
,测得反应过程中体系压强随时间变化如图。下列说法不正确的是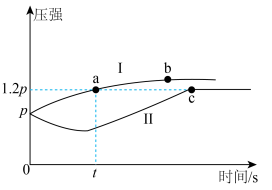
| A.曲线Ⅱ对应绝热条件 | B.曲线I、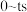 内: 内: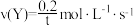 |
C.转化率: | D.平衡常数: |
您最近一年使用:0次
名校
解题方法
8 . 湖北省十堰地区发现大量铌、钽等稀土矿产。萃取剂P204用于萃取稀土金属铌的反应为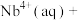
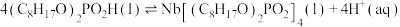 。某温度下,萃取铌离子的溶液中
。某温度下,萃取铌离子的溶液中 与时间变化关系如图所示。
与时间变化关系如图所示。
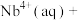
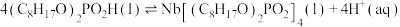 。某温度下,萃取铌离子的溶液中
。某温度下,萃取铌离子的溶液中 与时间变化关系如图所示。
与时间变化关系如图所示。
A.其他条件不变, 时萃取反应已停止 时萃取反应已停止 |
B. 增大,萃取平衡向左移动,平衡常数减小 增大,萃取平衡向左移动,平衡常数减小 |
C.萃取反应的正反应速率: |
D. 段 段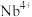 平均反应速率 平均反应速率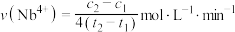 |
您最近一年使用:0次
2024-05-19更新
|
188次组卷
|
3卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
解题方法
9 . 室温下,某溶液初始时仅 A,同时发生两个反应:①A B+C;②A
B+C;②A B+D,反应①的速率可表示为v1=k1c(A),反应②的速率可表示为v2=k2c(A), (k1、k2为速率常数),图1为T2时,该体系中A、B、C、D的浓度随时间变化的曲线,图2为反应①和②的lnk—
B+D,反应①的速率可表示为v1=k1c(A),反应②的速率可表示为v2=k2c(A), (k1、k2为速率常数),图1为T2时,该体系中A、B、C、D的浓度随时间变化的曲线,图2为反应①和②的lnk— 曲线,下列说法正确的是
曲线,下列说法正确的是
 B+C;②A
B+C;②A B+D,反应①的速率可表示为v1=k1c(A),反应②的速率可表示为v2=k2c(A), (k1、k2为速率常数),图1为T2时,该体系中A、B、C、D的浓度随时间变化的曲线,图2为反应①和②的lnk—
B+D,反应①的速率可表示为v1=k1c(A),反应②的速率可表示为v2=k2c(A), (k1、k2为速率常数),图1为T2时,该体系中A、B、C、D的浓度随时间变化的曲线,图2为反应①和②的lnk— 曲线,下列说法正确的是
曲线,下列说法正确的是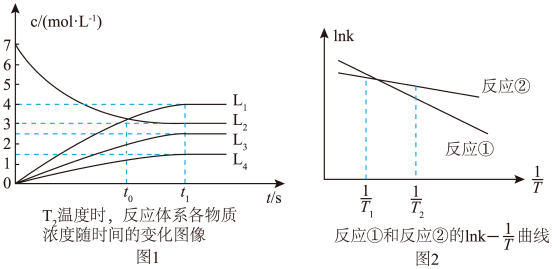
| A.L4表示B浓度随时间变化曲线 |
| B.t1≈2s时曲线L1表示的物质的化学反应速率为2 mol/(L·s) |
| C.T2温度时,反应①的活化能比反应②的活化能大 |
D.若图Ⅰ的温度降低,t0时刻体系中 值变小 值变小 |
您最近一年使用:0次
解题方法
10 . 某反应 的速率方程为
的速率方程为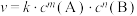 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
 的速率方程为
的速率方程为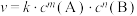 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是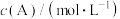 | 0.25 | 0.50 | 1.00 | 0.50 | 1.00 | 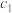 |
 | 0.050 | 0.050 | 0.100 | 0.100 | 0.200 |  |
 | 1.6 | 3.2 | 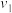 | 3.2 |  | 4.8 |
A.上述表格中的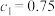 、 、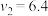 |
B.该反应的速率常数 |
| C.升温可使k增大,反应瞬时速率加快 |
| D.在过量的B存在时,当剩余6.25%的A时,所需的时间是375min |
您最近一年使用:0次



