1 . 甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:
反应I:

反应II:

已知:①平衡状态下,甲醛选择性 ;甲醛的收率
;甲醛的收率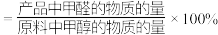 。
。
②几种物质的燃烧热 如下表:
如下表:
回答下列问题:
(1)
_______ ,HCHO的空间结构为_______ 形。
(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii: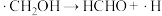
历程iii:
历程iv: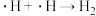
写出历程i的反应方程式:_______ 。
(3)将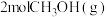 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下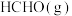 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示:_______ (填“I”或“II”),判断的依据是_______ 。
② ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为_______ ,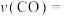
_______ ,反应I的平衡常数
_______  。
。
反应I:


反应II:


已知:①平衡状态下,甲醛选择性
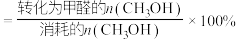 ;甲醛的收率
;甲醛的收率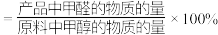 。
。②几种物质的燃烧热
 如下表:
如下表:| 物质 |  | 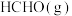 |  |  |
燃烧热 | -725.8 | -563.6 | -283.0 | -285.8 |
(1)

(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii:
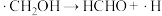
历程iii:

历程iv:
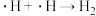
写出历程i的反应方程式:
(3)将
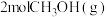 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下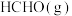 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示: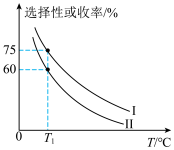
②
 ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为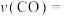

 。
。
您最近一年使用:0次
昨日更新
|
173次组卷
|
3卷引用:河北省保定市名校协作体2024届高三下学期三模化学试题
解题方法
2 . 某研究学习小组把一定量的固体X放入容积为2L的真空密闭容器中,在 下分解:
下分解: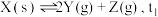 时达到化学平衡,
时达到化学平衡,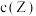 随时间t变化曲线(
随时间t变化曲线( 时间段)如图所示.下列说法错误的是
时间段)如图所示.下列说法错误的是
 下分解:
下分解: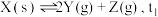 时达到化学平衡,
时达到化学平衡,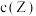 随时间t变化曲线(
随时间t变化曲线( 时间段)如图所示.下列说法错误的是
时间段)如图所示.下列说法错误的是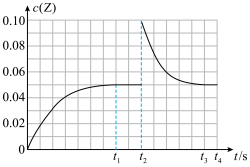
A.在 时间内该化学反应速率 时间内该化学反应速率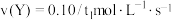 |
| B.T℃时,该反应的化学平衡常数K的值为0.0005 |
| C.Z的体积分数不变证明该分解反应已经达到平衡 |
D.若其他条件不变, 时将容器体积压缩到1L, 时将容器体积压缩到1L,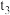 时达到新的平衡,c(Z)在 时达到新的平衡,c(Z)在 时间内的变化曲线如上图所示 时间内的变化曲线如上图所示 |
您最近一年使用:0次
7日内更新
|
108次组卷
|
2卷引用:河北省衡水市2024届高三下学期高考预测卷化学试题
名校
解题方法
3 . 研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
 .回答下列问题。
.回答下列问题。
(1)汽车在行驶过程中有如下反应发生:
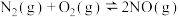
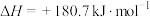
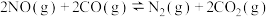
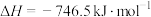
写出表示CO燃烧热的热化学方程式为___________ 。
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(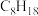 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为___________ (保留三位有效数字)。若实际空燃比大于此值,则该汽车尾气的主要污染物为___________ 。
(3)在汽车上安装三元催化转化器可实现反应: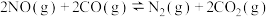
 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
该反应在1~4s内的平均反应速率为
___________ 。反应达平衡时压强为100kPa,求压强平衡常数
___________  。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出): 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
(4)研究表明,合成氨的速率与相关物质的浓度关系为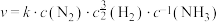 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。
(5)实际工业生产中,原料气中 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)___________ 。
(6)在氨气催化氧化制硝酸过程中,发现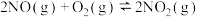 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
① (快)
(快) 
②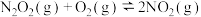 (慢)
(慢) 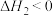
根据化学反应原理解释升高温度该反应速率减小的原因可能是___________ 。
 .回答下列问题。
.回答下列问题。(1)汽车在行驶过程中有如下反应发生:
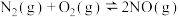
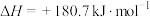
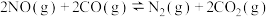
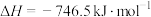
写出表示CO燃烧热的热化学方程式为
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(
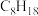 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为(3)在汽车上安装三元催化转化器可实现反应:
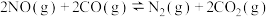
 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
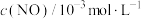 | 1.50 | 1.15 | 0.75 | 0.62 | 0.55 | 0.50 | 0.50 |
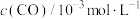 | 3.00 | 2.65 | 2.25 | 2.12 | 2.05 | 2.00 | 2.00 |


 。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)  .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):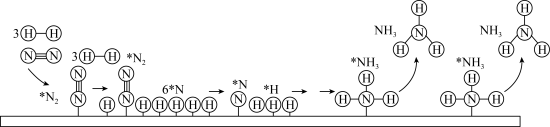
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。(4)研究表明,合成氨的速率与相关物质的浓度关系为
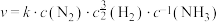 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。| A.合成氨的反应在任意温度下都能自发进行 |
B.增大 、 、 或 或 的浓度都能提高合成氨速率 的浓度都能提高合成氨速率 |
| C.若反应气中混有水蒸气,Fe催化剂可能中毒 |
| D.使用催化剂可提高单位时间内原料气的转化率 |
 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)(6)在氨气催化氧化制硝酸过程中,发现
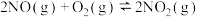 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:①
 (快)
(快) 
②
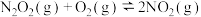 (慢)
(慢) 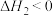
根据化学反应原理解释升高温度该反应速率减小的原因可能是
您最近一年使用:0次
4 . 将CO或CO2转化为高附加值化学品是颇具前景的合成路线。
(1)工业上用CO2和H2反应合成二甲醚。
已知:
 ;
;

 。
。
写出 和
和 转化为
转化为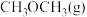 和
和 的热化学方程式:
的热化学方程式:_______________ ,该反应在________ (填“高温”或“低温”)条件下能自发进行。
(2)CO2催化加氢合成乙醇的反应原理为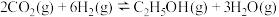
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。________________ 。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为________ (填化学式)。
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为 、
、 。
。
在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。________________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:________________ (任答两点)。
(4)一定条件下,利用CO2和H2还可制得甲烷: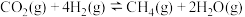 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
①用单位时间内气体分压的变化表示反应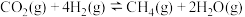 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
________ 。
②该温度下,平衡时CO的体积分数为8%,反应 的平衡常数
的平衡常数
________ ( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为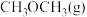 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为
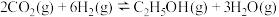
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。

②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
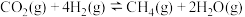 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
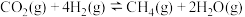 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
解题方法
5 . 金属氧化物催化氧化制备苯甲醛是近年来的研究热点。以 为催化剂,苯乙烯、
为催化剂,苯乙烯、 为原料制备苯甲醛涉及的主要反应有:
为原料制备苯甲醛涉及的主要反应有:
(1)反应iii的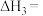
_______  。
。
(2)根据阿累尼乌斯方程 (A为指前因子,
(A为指前因子, 为活化能),
为活化能), 与
与 呈线性关系。据图1可知反应i的活化能
呈线性关系。据图1可知反应i的活化能_______ 反应ⅱ的活化能。(填“>”“=”或“<”) ,苯乙烯的转化率下降,可能的原因是
,苯乙烯的转化率下降,可能的原因是_______ 。

(4) 的催化反应机理如下图所示:
的催化反应机理如下图所示:_______ 。(填序号)
(5)在 催化下,甲苯可以实现气相氧化制备苯甲醛。
催化下,甲苯可以实现气相氧化制备苯甲醛。
(8)
 时,向
时,向 密闭容器中充入
密闭容器中充入 甲苯蒸气和
甲苯蒸气和 ,起始压强为
,起始压强为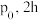 后反应达平衡时容器内气体总物质的量为
后反应达平衡时容器内气体总物质的量为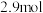 ,甲苯的转化率为
,甲苯的转化率为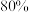 。则甲苯的平均反应速率为
。则甲苯的平均反应速率为_______  ,主反应的
,主反应的
_______ ( 为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
 为催化剂,苯乙烯、
为催化剂,苯乙烯、 为原料制备苯甲醛涉及的主要反应有:
为原料制备苯甲醛涉及的主要反应有:反应i: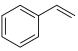 (l)+2H2O2(l)→
(l)+2H2O2(l)→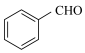 (l)+HCHO(l)+2H2O(l)
(l)+HCHO(l)+2H2O(l)
反应ii: (l)+H2O2(l)→
(l)+H2O2(l)→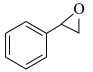 (l)+H2O(l)
(l)+H2O(l)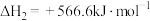
反应iii: (l)+H2O2(l)→
(l)+H2O2(l)→ (l)+HCHO(l)+H2O(l)
(l)+HCHO(l)+H2O(l)
(1)反应iii的
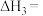
 。
。(2)根据阿累尼乌斯方程
 (A为指前因子,
(A为指前因子, 为活化能),
为活化能),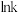 与
与 呈线性关系。据图1可知反应i的活化能
呈线性关系。据图1可知反应i的活化能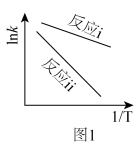
 ,苯乙烯的转化率下降,可能的原因是
,苯乙烯的转化率下降,可能的原因是
(4)
 的催化反应机理如下图所示:
的催化反应机理如下图所示: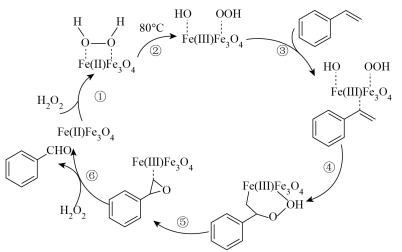
(5)在
 催化下,甲苯可以实现气相氧化制备苯甲醛。
催化下,甲苯可以实现气相氧化制备苯甲醛。(6)主反应: +O2→
+O2→ +H2O
+H2O
副反应:2 +O2→2
+O2→2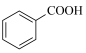
(8)
 时,向
时,向 密闭容器中充入
密闭容器中充入 甲苯蒸气和
甲苯蒸气和 ,起始压强为
,起始压强为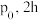 后反应达平衡时容器内气体总物质的量为
后反应达平衡时容器内气体总物质的量为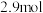 ,甲苯的转化率为
,甲苯的转化率为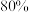 。则甲苯的平均反应速率为
。则甲苯的平均反应速率为 ,主反应的
,主反应的
 为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
您最近一年使用:0次
名校
解题方法
6 . 某温度下,向恒容密闭容器中充入等物质的量浓度的X(g)和Y(g),同时发生两个反应:① ,②
,② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 (
( 、
、 为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
 ,②
,② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 (
( 、
、 为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是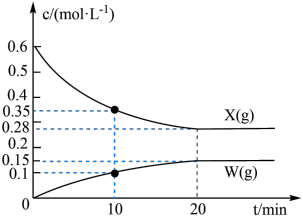
A.10min时,Y(g)的反应速率为0.025 |
| B.体系中W和M的浓度之比保持不变,说明反应已平衡 |
C.平衡时,反应②的平衡常数 |
| D.反应②的活化能比反应①的活化能更大 |
您最近一年使用:0次
解题方法
7 . 将 和
和 充入
充入 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:
Ⅰ.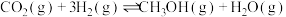
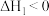 (慢反应)
(慢反应)
Ⅱ.
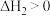 (快反应)
(快反应)
测得相同时间内 、
、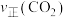 与温度的关系如图所示,下列说法错误的是
与温度的关系如图所示,下列说法错误的是
 和
和 充入
充入 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:Ⅰ.
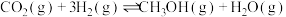
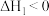 (慢反应)
(慢反应)Ⅱ.

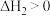 (快反应)
(快反应)测得相同时间内
 、
、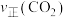 与温度的关系如图所示,下列说法错误的是
与温度的关系如图所示,下列说法错误的是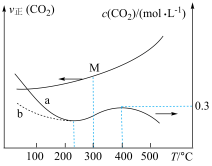
A.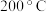 前,加入催化剂可使a线转化为b线 前,加入催化剂可使a线转化为b线 |
B.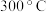 时,M点对应的反应体系中, 时,M点对应的反应体系中, |
C.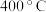 时,若 时,若 时达到平衡,则 时达到平衡,则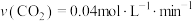 |
D.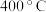 后,温度对正反应速率的影响比浓度大 后,温度对正反应速率的影响比浓度大 |
您最近一年使用:0次
解题方法
8 . 已知某条件下反应 的速率方程为
的速率方程为 ,
,
 在钨
在钨 表面分解的实验数据如表所示。
表面分解的实验数据如表所示。
已知:①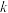 为速率常数,只与温度、催化剂有关,与浓度无关。
为速率常数,只与温度、催化剂有关,与浓度无关。
② 时,反应为0级反应,
时,反应为0级反应, 时,反应为1级反应,以此类推。
时,反应为1级反应,以此类推。 可以为整数,也可以为分数。
可以为整数,也可以为分数。
③浓度消耗一半所用的时间叫半衰期 。
。
下列说法错误的是
 的速率方程为
的速率方程为 ,
, 在钨
在钨 表面分解的实验数据如表所示。
表面分解的实验数据如表所示。已知:①
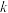 为速率常数,只与温度、催化剂有关,与浓度无关。
为速率常数,只与温度、催化剂有关,与浓度无关。②
 时,反应为0级反应,
时,反应为0级反应, 时,反应为1级反应,以此类推。
时,反应为1级反应,以此类推。 可以为整数,也可以为分数。
可以为整数,也可以为分数。③浓度消耗一半所用的时间叫半衰期
 。
。 | 0 | 20 | 40 | 60 | 80 | 100 |
 | 0.100 | 0.080 | 0.060 |  | 0.020 | 0 |
A.表格中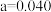 |
| B.该反应为2级反应 |
C.该反应速率与 的浓度无关,可能因为催化剂表面吸附的 的浓度无关,可能因为催化剂表面吸附的 已达到饱和 已达到饱和 |
D.保持其他条件不变,若起始浓度为 ,则半衰期为 ,则半衰期为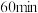 |
您最近一年使用:0次
名校
解题方法
9 . 以下实验目的、方法和相关解释都正确的是
| 选项 | 实验目的 | 实验方法 | 相关解释 |
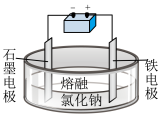
| A | 电解熔融氯化钠 |
| 该装置阳极反应为2Cl--2e-=Cl2 |
| B | 金属防腐 |
| 该图采用的是外加电流法对铁管道进行保护 |
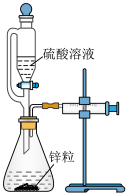
| C | 测量锌粒和不同浓度的硫酸溶液反应速率的快慢 |
| 该实验用到的实验仪器有恒压滴液漏斗、锥形瓶、双孔塞、注射器 |
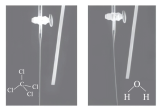
| D | 验证分子极性 |
| 该实验是用毛皮摩擦过的橡胶棒靠近 和 和 ,由图中现象可知 ,由图中现象可知 为非极性分子, 为非极性分子, 为极性分子 为极性分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-05更新
|
266次组卷
|
4卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
10 . 一氯甲烷广泛用作溶剂、提取剂、推进剂、制冷剂、甲基化试剂,用于生产农药、医药等。600K时,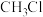 和
和 作用生成
作用生成 ,
, 可继续反应生成
可继续反应生成 。反应原理如下:
。反应原理如下:
①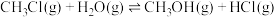

②
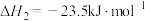
(1)已知反应①中相关化学键的键能数据如表:
则
___________  。
。
上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ (填标号)。
A.升高温度反应①正向移动,反应②逆向移动
B.加入反应①的催化剂,可以降低反应的活化能及反应热
C.增大水蒸气浓度有利于提高 的产量
的产量
D.及时分离出 可以使反应①的正反应速率增大
可以使反应①的正反应速率增大
(2)对于反应②,反应速率与浓度之间存在如下关系: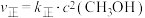 ,
,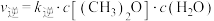 ,
, 、
、 为速率常数,只受温度影响,k和温度的关系为
为速率常数,只受温度影响,k和温度的关系为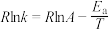 (
( 为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示
为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示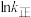 和
和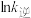 与
与 的关系,表示
的关系,表示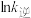 的是
的是___________ (填“a”或“b”),温度为 时,反应②的平衡常数K=
时,反应②的平衡常数K=___________ 。

(3)在恒温条件下,向2L恒容密闭容器中,充入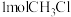 和
和 发生反应,甲醇的物质的量随时间变化如图所示:
发生反应,甲醇的物质的量随时间变化如图所示:
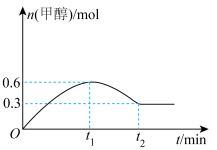
 时,水的体积分数为65%,则
时,水的体积分数为65%,则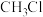 的转化率为
的转化率为___________ ,反应①的平衡常数
___________ [对于反应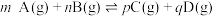 ,
,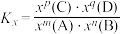 ,x为物质的量分数]。
,x为物质的量分数]。
(4)甲醇也可通过电化学方法由甲烷直接制得,装置如图所示:
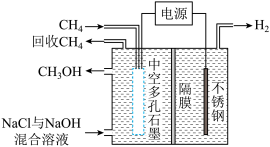
已知,电解生成甲醇的过程分3步:
①通电时,氯离子先转化成高活性的原子氯(Cl·);②Cl·与吸附在电极上的 反应生成HCl和
反应生成HCl和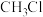 ;③在碱性电解液中,
;③在碱性电解液中,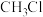 转化为目标产物
转化为目标产物 。当步骤①有2molCl·生成时,外电路中转移的电子数为
。当步骤①有2molCl·生成时,外电路中转移的电子数为___________ (用含 的代数式表示)。阴极的电极反应为
的代数式表示)。阴极的电极反应为___________ 。
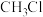 和
和 作用生成
作用生成 ,
, 可继续反应生成
可继续反应生成 。反应原理如下:
。反应原理如下:①
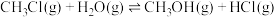

②

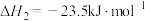
(1)已知反应①中相关化学键的键能数据如表:
| 化学键 | C-Cl | C-H | C-O | H-Cl | H-O |
键能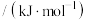 | 331 | 414 | 343 | 429 | 460 |

 。
。上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.升高温度反应①正向移动,反应②逆向移动
B.加入反应①的催化剂,可以降低反应的活化能及反应热
C.增大水蒸气浓度有利于提高
 的产量
的产量D.及时分离出
 可以使反应①的正反应速率增大
可以使反应①的正反应速率增大(2)对于反应②,反应速率与浓度之间存在如下关系:
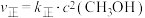 ,
,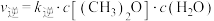 ,
, 、
、 为速率常数,只受温度影响,k和温度的关系为
为速率常数,只受温度影响,k和温度的关系为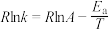 (
( 为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示
为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示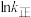 和
和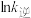 与
与 的关系,表示
的关系,表示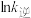 的是
的是 时,反应②的平衡常数K=
时,反应②的平衡常数K=
(3)在恒温条件下,向2L恒容密闭容器中,充入
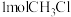 和
和 发生反应,甲醇的物质的量随时间变化如图所示:
发生反应,甲醇的物质的量随时间变化如图所示:
 时,水的体积分数为65%,则
时,水的体积分数为65%,则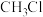 的转化率为
的转化率为
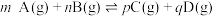 ,
,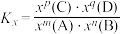 ,x为物质的量分数]。
,x为物质的量分数]。(4)甲醇也可通过电化学方法由甲烷直接制得,装置如图所示:

已知,电解生成甲醇的过程分3步:
①通电时,氯离子先转化成高活性的原子氯(Cl·);②Cl·与吸附在电极上的
 反应生成HCl和
反应生成HCl和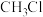 ;③在碱性电解液中,
;③在碱性电解液中,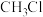 转化为目标产物
转化为目标产物 。当步骤①有2molCl·生成时,外电路中转移的电子数为
。当步骤①有2molCl·生成时,外电路中转移的电子数为 的代数式表示)。阴极的电极反应为
的代数式表示)。阴极的电极反应为
您最近一年使用:0次