解题方法
1 . 室温下,在P和Q浓度相等的混合溶液中,同时发生反应①P+Q=X+Z和反应②P+Q=Y+Z,反应①和②的速率方程分别是v1=k1c2(P)、v2=k2c2(P)(k1、k2为速率常数)。反应过程中,Q、X的浓度随时间变化情况如图所示。下列说法错误的是
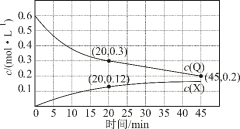
| A.反应开始后,体系中X和Y的浓度之比保持不变 |
| B.45min时Z的浓度为0.4mol·L-1 |
| C.反应①的活化能比反应②的活化能大 |
| D.如果反应能进行到底,反应结束时,有40%的P转化为Y |
您最近半年使用:0次
名校
解题方法
2 . 2023年杭州亚运会主火炬创新使用了绿色“零碳甲醇”作为燃料,这不仅在亚运史上是第一次,在全球大型体育赛事上也是首次实现了废碳的再生利用。“零碳甲醇”是符合“碳中和”属性的绿色能源。
Ⅰ.直接法制甲醇
我国科研团队研究发现使用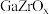 双金属氧化物可形成氧空位,具有催化氧化性能,实现
双金属氧化物可形成氧空位,具有催化氧化性能,实现 加氢制甲醇。该反应机理如图所示。
加氢制甲醇。该反应机理如图所示。
(2)向恒温恒压密闭容器中充入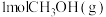 和
和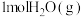 发生上述反应(反应Ⅰ)的逆过程,达到平衡时,
发生上述反应(反应Ⅰ)的逆过程,达到平衡时, 的转化率为
的转化率为 ,用摩尔分数表示反应Ⅰ的平衡常数
,用摩尔分数表示反应Ⅰ的平衡常数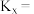
___________ 。(用分数表示,物质i的摩尔分数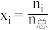 )
)
Ⅱ.间接法制甲醇
 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成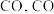 和
和 再合成甲醇。
再合成甲醇。
反应Ⅱ:
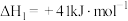
反应Ⅲ:

(3)反应Ⅱ的速率 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
___________ (填“增大”“减小”或“不变”)。
(4)在某催化剂下,反应Ⅲ的反应历程如图所示(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,*表示吸附在催化剂上)。已知V中有一种吸附在催化剂表面的物质,V可表示为___________ 。 ,向密闭容器中加入
,向密闭容器中加入 和
和 ,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为
的物质的量为 为
为 。则
。则 分压的变化量为
分压的变化量为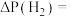
___________  (保留三位有效数字)。
(保留三位有效数字)。
(6)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是___________ ,理由是___________ 。
Ⅰ.直接法制甲醇
我国科研团队研究发现使用
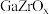 双金属氧化物可形成氧空位,具有催化氧化性能,实现
双金属氧化物可形成氧空位,具有催化氧化性能,实现 加氢制甲醇。该反应机理如图所示。
加氢制甲醇。该反应机理如图所示。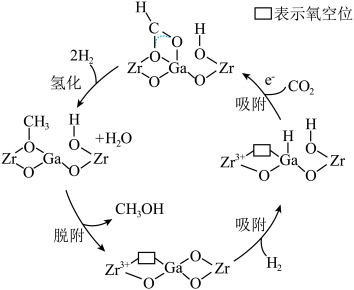
| A.增大催化剂的比表面积有利于提高平衡转化率 |
| B.催化剂表面甲醇及时脱附有利于提高反应速率 |
| C.在恒温恒容密闭容器中,通入惰性气体以增加体系压强,有利于提高甲醇的产率 |
D.若断开 键同时断开 键同时断开 键,则说明反应达到平衡状态 键,则说明反应达到平衡状态 |
(2)向恒温恒压密闭容器中充入
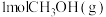 和
和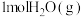 发生上述反应(反应Ⅰ)的逆过程,达到平衡时,
发生上述反应(反应Ⅰ)的逆过程,达到平衡时, 的转化率为
的转化率为 ,用摩尔分数表示反应Ⅰ的平衡常数
,用摩尔分数表示反应Ⅰ的平衡常数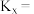
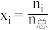 )
)Ⅱ.间接法制甲醇
 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成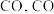 和
和 再合成甲醇。
再合成甲醇。反应Ⅱ:

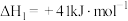
反应Ⅲ:


(3)反应Ⅱ的速率
 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
(4)在某催化剂下,反应Ⅲ的反应历程如图所示(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,*表示吸附在催化剂上)。已知V中有一种吸附在催化剂表面的物质,V可表示为
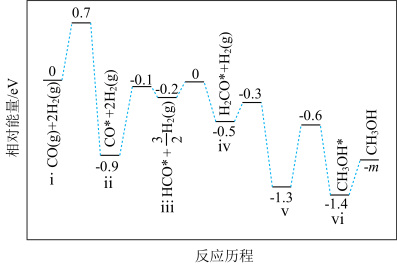
 ,向密闭容器中加入
,向密闭容器中加入 和
和 ,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为
的物质的量为 为
为 。则
。则 分压的变化量为
分压的变化量为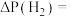
 (保留三位有效数字)。
(保留三位有效数字)。(6)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是
您最近半年使用:0次
解题方法
3 . 利用 脱除烟气中的
脱除烟气中的 具有重要意义。已知在
具有重要意义。已知在 还原
还原 过程中,会发生如下反应:
过程中,会发生如下反应:
反应i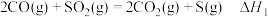
反应ii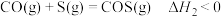
反应iii
回答下列问题:
(1)已知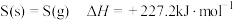 ,
, 和
和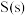 的燃烧热分别为
的燃烧热分别为 、
、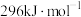 ,则反应i的
,则反应i的 为
为___________  。
。
(2)下列有利于提高反应i中 的平衡转化率的是___________。
的平衡转化率的是___________。
(3)一定条件下,该体系达平衡时各气体物质的量随 进料比的变化如图1所示。
进料比的变化如图1所示。___________ 。
②通入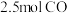 和
和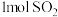 ,达到平衡时
,达到平衡时 ,则反应ii的
,则反应ii的
___________ ( 为物质的量分数,计算结果保留两位小数)。
为物质的量分数,计算结果保留两位小数)。
(4)在刚性容器中,控制反成温度为823K。固定 浓度为
浓度为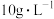 ,
, 进料比分别为
进料比分别为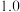 、
、 、
、 时
时 的转化率随时间变化如图2所示。
的转化率随时间变化如图2所示。 进料比为
进料比为 对应图中曲线
对应图中曲线___________ 。
②反应从开始到A点时间内 的生成速率为
的生成速率为___________ 。
(5)在催化剂作用下, 还原
还原 的部分机理如图3所示(
的部分机理如图3所示( 表示S吸附在催化剂表面)。该反应的催化剂为
表示S吸附在催化剂表面)。该反应的催化剂为___________ ,历程②的方程式为___________ 。
 脱除烟气中的
脱除烟气中的 具有重要意义。已知在
具有重要意义。已知在 还原
还原 过程中,会发生如下反应:
过程中,会发生如下反应:反应i
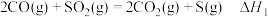
反应ii
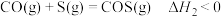
反应iii

回答下列问题:
(1)已知
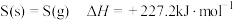 ,
, 和
和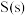 的燃烧热分别为
的燃烧热分别为 、
、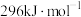 ,则反应i的
,则反应i的 为
为 。
。(2)下列有利于提高反应i中
 的平衡转化率的是___________。
的平衡转化率的是___________。A.恒容时增大 浓度 浓度 | B.降低温度 |
| C.选择合适的催化剂 | D.减小容器的容积 |
(3)一定条件下,该体系达平衡时各气体物质的量随
 进料比的变化如图1所示。
进料比的变化如图1所示。
②通入
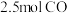 和
和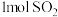 ,达到平衡时
,达到平衡时 ,则反应ii的
,则反应ii的
 为物质的量分数,计算结果保留两位小数)。
为物质的量分数,计算结果保留两位小数)。(4)在刚性容器中,控制反成温度为823K。固定
 浓度为
浓度为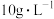 ,
, 进料比分别为
进料比分别为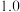 、
、 、
、 时
时 的转化率随时间变化如图2所示。
的转化率随时间变化如图2所示。
 进料比为
进料比为 对应图中曲线
对应图中曲线②反应从开始到A点时间内
 的生成速率为
的生成速率为(5)在催化剂作用下,
 还原
还原 的部分机理如图3所示(
的部分机理如图3所示( 表示S吸附在催化剂表面)。该反应的催化剂为
表示S吸附在催化剂表面)。该反应的催化剂为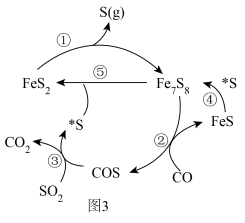
您最近半年使用:0次
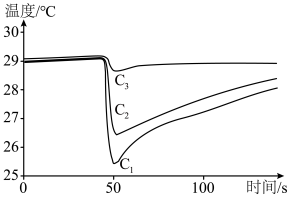
4 . 一定温度下,向2.0 L恒容密闭容器中充入一定量的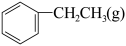 ,在催化剂作用下发生脱氢反应:
,在催化剂作用下发生脱氢反应: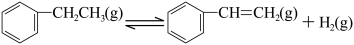
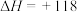 kJ·mol
kJ·mol ,测得乙苯脱氢反应时间与容器中气体总压强的关系如图所示:
,测得乙苯脱氢反应时间与容器中气体总压强的关系如图所示:

| A.乙苯脱氢反应在相对较高温度下能自发进行 |
B.0~4h内平均反应速率可用压强变化表示为v( ) )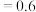 kPa⋅h kPa⋅h |
| C.若向平衡体系中再通入适量的乙苯气体,平衡正向移动 |
| D.若在平衡时扩大容器的容积使体系压强恢复至起始压强,再次达到平衡时乙苯的体积分数减小 |
您最近半年使用:0次
解题方法
5 . 将 和
和 充入
充入 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:
Ⅰ.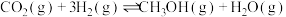
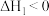 (慢反应)
(慢反应)
Ⅱ.
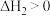 (快反应)
(快反应)
测得相同时间内 、
、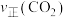 与温度的关系如图所示,下列说法错误的是
与温度的关系如图所示,下列说法错误的是
 和
和 充入
充入 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:Ⅰ.
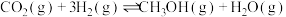
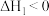 (慢反应)
(慢反应)Ⅱ.

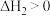 (快反应)
(快反应)测得相同时间内
 、
、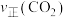 与温度的关系如图所示,下列说法错误的是
与温度的关系如图所示,下列说法错误的是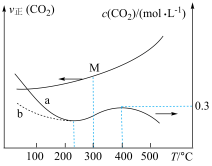
A.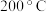 前,加入催化剂可使a线转化为b线 前,加入催化剂可使a线转化为b线 |
B.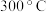 时,M点对应的反应体系中, 时,M点对应的反应体系中, |
C.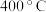 时,若 时,若 时达到平衡,则 时达到平衡,则 |
D.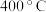 后,温度对正反应速率的影响比浓度大 后,温度对正反应速率的影响比浓度大 |
您最近半年使用:0次
解题方法
6 . I.含碳化合物甲烷、 等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
(1)一种甲烷催化氧化的反应历程如图所示,“*”表示微粒吸附在催化剂表面。下列叙述错误的是___________(填标号)。
Ⅱ.以氧化铟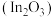 作催化剂,可实现
作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。
已知:ⅰ.催化剂活化: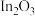 (无活性)
(无活性)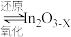 (有活性);
(有活性);
ⅱ. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
反应①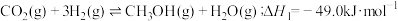
反应②
反应③: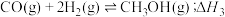
(2)反应③中
___________ 。
(3)工业上以原料气通过催化剂表面的方法生产甲醇, 是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:
是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:___________ 。为了减少催化剂的失活,可以采用的方法是___________ 。
(4)按 时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为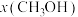 ,在t=250℃条件下的
,在t=250℃条件下的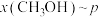 、在
、在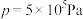 条件下的
条件下的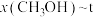 (温度)如图所示。
(温度)如图所示。___________ (填“a”或“b”),判断理由是___________ 。
ii.A、B、C、D、E、F中可能表示220℃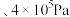 时的平衡状态的点是
时的平衡状态的点是___________ 。
(5)将 和
和 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
反应①的速率可表示为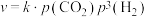 (
(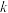 为常数),平衡时
为常数),平衡时 ,已知在
,已知在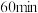 时
时 的转化率为
的转化率为 ,则反应①的正向反应在
,则反应①的正向反应在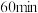 时的
时的
___________ (用含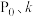 的式子表示)。
的式子表示)。
 等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:(1)一种甲烷催化氧化的反应历程如图所示,“*”表示微粒吸附在催化剂表面。下列叙述错误的是___________(填标号)。
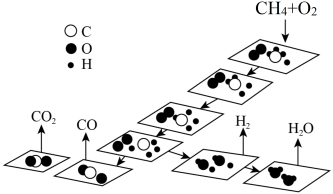
A.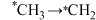 的过程中,放出能量 的过程中,放出能量 |
| B.产物从催化剂表面脱附的速率慢会降低总反应速率 |
C.适当提高 分压会降低 分压会降低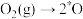 的反应速率 的反应速率 |
D. 与 与 反应生成 反应生成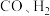 均涉及极性键、非极性键的断裂和生成 均涉及极性键、非极性键的断裂和生成 |
Ⅱ.以氧化铟
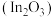 作催化剂,可实现
作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。已知:ⅰ.催化剂活化:
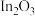 (无活性)
(无活性)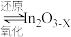 (有活性);
(有活性);ⅱ.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:反应①
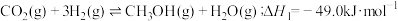
反应②

反应③:
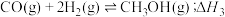
(2)反应③中

(3)工业上以原料气通过催化剂表面的方法生产甲醇,
 是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:
是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:(4)按
 时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为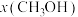 ,在t=250℃条件下的
,在t=250℃条件下的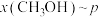 、在
、在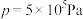 条件下的
条件下的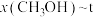 (温度)如图所示。
(温度)如图所示。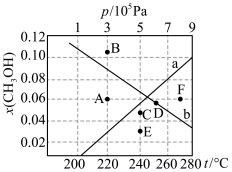
ii.A、B、C、D、E、F中可能表示220℃
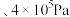 时的平衡状态的点是
时的平衡状态的点是(5)将
 和
和 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:| 时间/min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa |  | 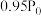 | 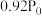 |  |  |
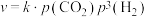 (
(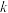 为常数),平衡时
为常数),平衡时 ,已知在
,已知在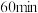 时
时 的转化率为
的转化率为 ,则反应①的正向反应在
,则反应①的正向反应在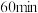 时的
时的
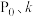 的式子表示)。
的式子表示)。
您最近半年使用:0次
解题方法
7 . 一氧化碳和氮的氧化物都是大气污染物,如何有效处理它们是科学家长期研究的课题.
(1)CO还原 的反应为:
的反应为:
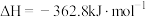 .
.
①研究者发现在气相中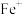 催化CO与
催化CO与 反应的历程有两步:
反应的历程有两步:
第一步:
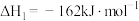
则第二步的热化学方程式为________________ ;
②在恒温恒容密闭容器中,反应一段时间后,以下能说明反应达到平衡状态的是________ (填字母);
A. B.混合气体的密度保持不变
B.混合气体的密度保持不变
C. 的体积分数保持不变 D.容器的压强保持不变
的体积分数保持不变 D.容器的压强保持不变
(2)在密闭容器中发生反应: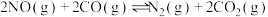
 .一段时间后达到平衡;
.一段时间后达到平衡;
①恒温恒压下,再向该容器中注入氩气,NO的平衡转化率煘小,其原因是________ ;
②一定温度下,在 恒容密闭容器中,加入
恒容密闭容器中,加入 和
和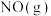 各
各 ,反应过程中部分物质的体积分数(
,反应过程中部分物质的体积分数(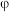 )随时间(t)的变化如图1所示.曲线b代表的是
)随时间(t)的变化如图1所示.曲线b代表的是________ (填化学式)体积分数随时间的变化: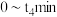 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为________  ;该温度下的平衡常数为
;该温度下的平衡常数为________  ;
;
①a电极的电极反应式为________________ ;
②电池工作一段时间,反应消耗了标准状况下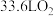 ,理论上负极区溶液增加的质量为
,理论上负极区溶液增加的质量为________ g。
(1)CO还原
 的反应为:
的反应为:
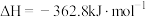 .
.①研究者发现在气相中
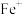 催化CO与
催化CO与 反应的历程有两步:
反应的历程有两步:第一步:

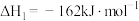
则第二步的热化学方程式为
②在恒温恒容密闭容器中,反应一段时间后,以下能说明反应达到平衡状态的是
A.
 B.混合气体的密度保持不变
B.混合气体的密度保持不变C.
 的体积分数保持不变 D.容器的压强保持不变
的体积分数保持不变 D.容器的压强保持不变(2)在密闭容器中发生反应:
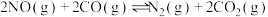
 .一段时间后达到平衡;
.一段时间后达到平衡;①恒温恒压下,再向该容器中注入氩气,NO的平衡转化率煘小,其原因是
②一定温度下,在
 恒容密闭容器中,加入
恒容密闭容器中,加入 和
和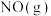 各
各 ,反应过程中部分物质的体积分数(
,反应过程中部分物质的体积分数(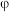 )随时间(t)的变化如图1所示.曲线b代表的是
)随时间(t)的变化如图1所示.曲线b代表的是 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为 ;该温度下的平衡常数为
;该温度下的平衡常数为 ;
; 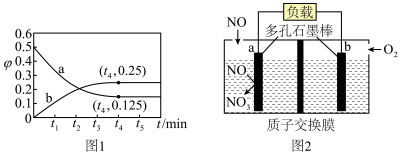
①a电极的电极反应式为
②电池工作一段时间,反应消耗了标准状况下
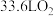 ,理论上负极区溶液增加的质量为
,理论上负极区溶液增加的质量为
您最近半年使用:0次
解题方法
8 . 体积均为2L的多个恒容密闭容器,分别充入1mol CO(g)和1mol  (g)发生反应
(g)发生反应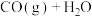

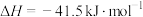 ,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数
,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数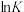 (
( 或
或 )、
)、 体积分数与热力学温度的倒数关系如图所示,下列说法错误的是
体积分数与热力学温度的倒数关系如图所示,下列说法错误的是
 (g)发生反应
(g)发生反应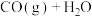

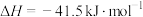 ,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数
,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数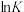 (
( 或
或 )、
)、 体积分数与热力学温度的倒数关系如图所示,下列说法错误的是
体积分数与热力学温度的倒数关系如图所示,下列说法错误的是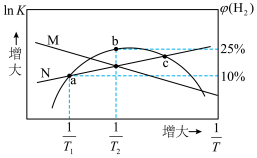
A.曲线N表示 的变化情况 的变化情况 |
B.0~50s,a点对应容器中的反应的平均速率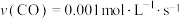 |
| C.b点时一定处于平衡状态 |
D.c点时,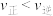 |
您最近半年使用:0次
解题方法
9 . 近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。
 .在
.在 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
反应a:

反应b:
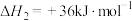
反应c: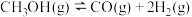

(1)已知反应b中相关化学键键能数据如下表:
计算:x=___________  ,
,
___________  。
。
(2)恒温恒容时,下列能说明反应a一定达到平衡状态的是___________(填标号)。
(3)在催化剂作用下,将物质的量之比为1:2的 和
和 的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率
的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 ,
, ,
, 、
、 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。
①平衡时, 转化率为60%,
转化率为60%, 和
和 的物质的量之比为1:1,若反应b的
的物质的量之比为1:1,若反应b的 ,则平衡
,则平衡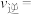
___________  。
。
②Arrhenius经验公式为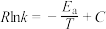 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
___________  (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。
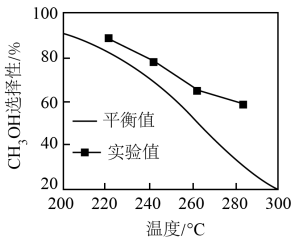
(4)其他条件相同时,反应温度对 选择性的影响如下图所示。由图可知,温度相同时
选择性的影响如下图所示。由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是___________ 。(已知 的选择性
的选择性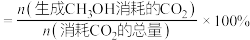 )
) .利用甲醇分解制取烯烃,涉及如下反应:
.利用甲醇分解制取烯烃,涉及如下反应:
a.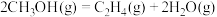
b.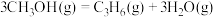
c.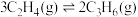
(5)恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时, ,平衡体系总压强为p,则650K反应c的平衡常数
,平衡体系总压强为p,则650K反应c的平衡常数
___________ 。
 .在
.在 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:反应a:


反应b:

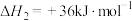
反应c:
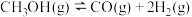

(1)已知反应b中相关化学键键能数据如下表:
| 化学键 | H-H | C=O | C≡O | H-O |
 | x | 803 | 1076 | 465 |
 ,
,
 。
。(2)恒温恒容时,下列能说明反应a一定达到平衡状态的是___________(填标号)。
A. | B.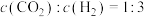 |
| C.混合气体的密度不再发生变化 | D.混合气体中 的百分含量保持不变 的百分含量保持不变 |
(3)在催化剂作用下,将物质的量之比为1:2的
 和
和 的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率
的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 ,
, ,
, 、
、 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。①平衡时,
 转化率为60%,
转化率为60%, 和
和 的物质的量之比为1:1,若反应b的
的物质的量之比为1:1,若反应b的 ,则平衡
,则平衡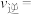
 。
。②Arrhenius经验公式为
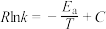 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
 (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。(4)其他条件相同时,反应温度对
 选择性的影响如下图所示。由图可知,温度相同时
选择性的影响如下图所示。由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是 的选择性
的选择性 )
)
 .利用甲醇分解制取烯烃,涉及如下反应:
.利用甲醇分解制取烯烃,涉及如下反应:a.
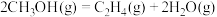
b.
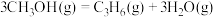
c.
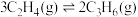
(5)恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时,
 ,平衡体系总压强为p,则650K反应c的平衡常数
,平衡体系总压强为p,则650K反应c的平衡常数

您最近半年使用:0次
10 . 回收利用 合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚
合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚 (DMC)的主要反应有:
(DMC)的主要反应有:
Ⅰ.
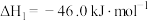
Ⅱ.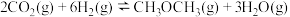
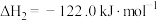
(1)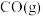 和
和 为原料制备气态
为原料制备气态 和水蒸气的热化学方程式是
和水蒸气的热化学方程式是_______ 。
(2)对于基元反应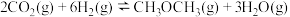 ,若升高反应温度,平衡常数K
,若升高反应温度,平衡常数K_______ (填“增大”、“减小”或“不变”);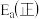
_______ 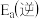 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
已知:阿伦尼乌斯经验公式为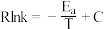 ,其中:
,其中: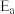 为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如图曲线。曲线中表示正反应速率的是
为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如图曲线。曲线中表示正反应速率的是_______ (填“m”或“n”)。
 、
、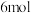
 ,同时发生上述两个反应,装置中压强p随着时间t变化如下表:
,同时发生上述两个反应,装置中压强p随着时间t变化如下表:
①0~2min,反应Ⅱ的化学反应速率
_______  ,若其他条件不变,向该体系中充入
,若其他条件不变,向该体系中充入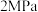
 ,则
,则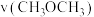
_______ (填“增大”、“减小”或“不变”)。
②平衡时测得水蒸气分压 ,反应Ⅱ生成
,反应Ⅱ生成 的选择性为
的选择性为_______ ( 选择性
选择性 ,保留1位小数)。
,保留1位小数)。
③计算反应Ⅰ的压强平衡常数
_______ (写计算表达式)。
(4)“直接二甲醚( )燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式
)燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式_______ 。
 合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚
合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚 (DMC)的主要反应有:
(DMC)的主要反应有:Ⅰ.

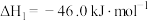
Ⅱ.
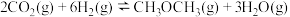
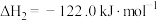
(1)
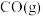 和
和 为原料制备气态
为原料制备气态 和水蒸气的热化学方程式是
和水蒸气的热化学方程式是(2)对于基元反应
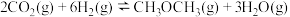 ,若升高反应温度,平衡常数K
,若升高反应温度,平衡常数K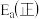
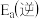 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。已知:阿伦尼乌斯经验公式为
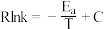 ,其中:
,其中: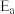 为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如图曲线。曲线中表示正反应速率的是
为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如图曲线。曲线中表示正反应速率的是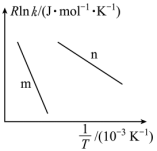

 、
、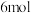
 ,同时发生上述两个反应,装置中压强p随着时间t变化如下表:
,同时发生上述两个反应,装置中压强p随着时间t变化如下表:
| 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 16 | 13.4 | 12.8 | 12.4 | 12.2 | 12 | 12 |

 ,若其他条件不变,向该体系中充入
,若其他条件不变,向该体系中充入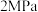
 ,则
,则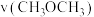
②平衡时测得水蒸气分压
 ,反应Ⅱ生成
,反应Ⅱ生成 的选择性为
的选择性为 选择性
选择性 ,保留1位小数)。
,保留1位小数)。③计算反应Ⅰ的压强平衡常数

(4)“直接二甲醚(
 )燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式
)燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式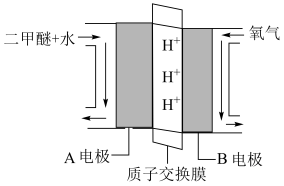
您最近半年使用:0次