名校
1 . 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度(mol。L-1)随时间(分)变化情况如图,下列说法正确的是
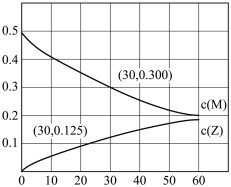
| A.0~30min时间段内,Y的平均反应速率为6.67×10-3mol·L-1·min-1 |
B.反应过程中体系Y和Z的浓度之比保持不变,30min时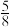 的M转化为Z 的M转化为Z |
| C.反应②的活化能比反应①的活化能大 |
| D.若该平行反应为可逆反应,正反应都为放热,升高温度,可提高Y的产率 |
您最近半年使用:0次
2 . 完成下列问题。
(1)画出下面反应过渡态的前线轨道示意图___________ 。
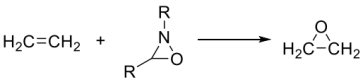
(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i) :
:___________ 。
(ii) :
:___________ 。
(iii) :
:___________ 。
(iv) :
:___________ 。
(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)___________ 。
(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为___________ 。
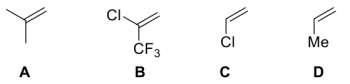
(5)下列二醇被高碘酸氧化的速率从快到慢的排序为___________ 。

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强___________ ?
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么___________ ?
(1)画出下面反应过渡态的前线轨道示意图

(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i)
 :
:(ii)
 :
:(iii)
 :
:(iv)
 :
:(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)

(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为

(5)下列二醇被高碘酸氧化的速率从快到慢的排序为

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么
您最近半年使用:0次
名校
3 . 丙烯是重要的化工原料,可以用于生产丙醇、卤代烃和塑料。回答下列问题:
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①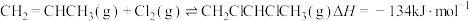
②
已知: 的活化能
的活化能 (逆)为
(逆)为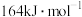 ,则该反应的活化能
,则该反应的活化能 (正)为
(正)为___________  。
。
(2)一定温度下,向恒容密闭容器中充入等物质的量的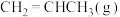 和
和 ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
用单位时间内气体分压的变化来表示反应速率,即 ,则反应①前
,则反应①前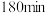 内平均反应速率
内平均反应速率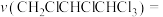
___________ kPa/min(保留小数点后2位)。
(3) 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图1所示。图中a、b、c、d代表丙烷或丙烯,则a、d代表
时,测得丙烷及丙烯的物质的量分数如图1所示。图中a、b、c、d代表丙烷或丙烯,则a、d代表___________ ,
___________  (填“大于”“小于”或“等于”);若
(填“大于”“小于”或“等于”);若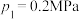 ,起始时充入一定量的丙烷在恒压条件下发生反应,计算
,起始时充入一定量的丙烷在恒压条件下发生反应,计算 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为___________ (保留一位小数),该反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。

(4)丙烷氧化脱氢法制备丙烯还生成 等副产物,制备丙烯的反应:
等副产物,制备丙烯的反应: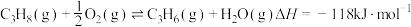 ,在催化剂的作用下
,在催化剂的作用下 的转化率和
的转化率和 的产率随温度变化关系如图2所示。图中
的产率随温度变化关系如图2所示。图中 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是___________ ;观察图2,写出能提高 选择性的措施是
选择性的措施是___________ ( 的选择性
的选择性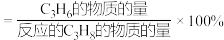 )。
)。

(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①
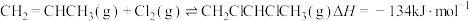
②

已知:
 的活化能
的活化能 (逆)为
(逆)为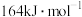 ,则该反应的活化能
,则该反应的活化能 (正)为
(正)为 。
。(2)一定温度下,向恒容密闭容器中充入等物质的量的
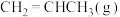 和
和 ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。时间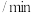 | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强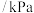 | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
 ,则反应①前
,则反应①前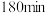 内平均反应速率
内平均反应速率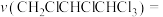
(3)
 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图1所示。图中a、b、c、d代表丙烷或丙烯,则a、d代表
时,测得丙烷及丙烯的物质的量分数如图1所示。图中a、b、c、d代表丙烷或丙烯,则a、d代表
 (填“大于”“小于”或“等于”);若
(填“大于”“小于”或“等于”);若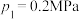 ,起始时充入一定量的丙烷在恒压条件下发生反应,计算
,起始时充入一定量的丙烷在恒压条件下发生反应,计算 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为
 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(4)丙烷氧化脱氢法制备丙烯还生成
 等副产物,制备丙烯的反应:
等副产物,制备丙烯的反应: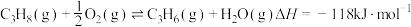 ,在催化剂的作用下
,在催化剂的作用下 的转化率和
的转化率和 的产率随温度变化关系如图2所示。图中
的产率随温度变化关系如图2所示。图中 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是 选择性的措施是
选择性的措施是 的选择性
的选择性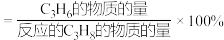 )。
)。
您最近半年使用:0次
2023-06-10更新
|
205次组卷
|
3卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
4 . 当某反应物的初始浓度为0.04 mol·dm-3时,反应的半衰期为400s,初始浓度为0.024 mol·dm-3时,半衰期为240s,则此反应为
| A.零级反应 | B.1.5级反应 | C.二级反应 | D.一级反应 |
您最近半年使用:0次
2023-05-25更新
|
332次组卷
|
2卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
5 . 2022 年北京大学课题组发现[4+2)]反应并对反应机理进行研究,该[4+2]反应是通过在环丁酮2-位引入乙烯基取代作为导向基诱导铑对环丁酮的碳-碳键活化,同时酮碳基可以与路易斯酸配位,进一步活化环丁酮的碳-碳键。这一协同催化模式选择性切断羰基与季碳中心之间的碳-碳键,不仅成功地构建六元环系,还成功拓展到烷基及多种电子效应的芳基上,大部分底物都具有中等到良好的收率,对氰基,酮羰基,酯基及酰胺等官能团具有良好的兼容性,机理如下图,下列表述错误的是
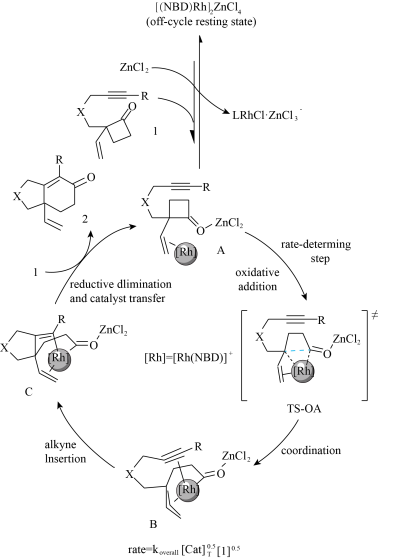

| A.生成TS-OA发生了氧化加成,这一步被认为是反应的决速步 |
| B.其中ZnCl2被认为具有促进C-C的活化和原位生成活性阳离子铑的作用 |
| C.由TS-OA生成B有配位键的形成 |
| D.该反应为合成4元环物质提供一种新的 C-C耦合方式 |
您最近半年使用:0次
2023-05-25更新
|
499次组卷
|
3卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
名校
6 . I.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如下图所示,由图中数据分析可得:
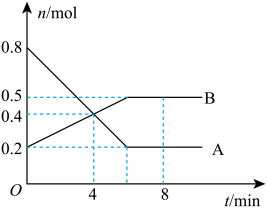
(1)该反应的化学方程式为___________ 。
(2)第4min时,正、逆反应速率的大小关系为v正___________ (填“>” “<”或“=”)v逆
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为___________ mol ·L-1·min-1。
(4)平衡时混合气体中B的体积分数为___________ 。
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(5)写出上述反应的离子方程式___________ 。
(6)若实验探究温度对该反应速率的影响,则a=___________ 采用比较实验的序号是___________ (填实验序号)

(1)该反应的化学方程式为
(2)第4min时,正、逆反应速率的大小关系为v正
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为
(4)平衡时混合气体中B的体积分数为
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
| 实验序号 | 反应温度(°C) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | a |
| C | 25 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
(6)若实验探究温度对该反应速率的影响,则a=
您最近半年使用:0次
2023-05-16更新
|
324次组卷
|
2卷引用:广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题
名校
解题方法
7 . 一定条件下,反应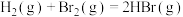 的速率方程为
的速率方程为 ,某温度下,该反应在不同浓度下的反应速率如下:
,某温度下,该反应在不同浓度下的反应速率如下:
根据表中的测定结果,下列结论错误的是
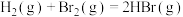 的速率方程为
的速率方程为 ,某温度下,该反应在不同浓度下的反应速率如下:
,某温度下,该反应在不同浓度下的反应速率如下: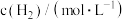 |  | 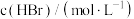 | 反应速率 |
| 0.1 | 0.1 | 2 |  |
| 0.1 | 0.4 | 2 | 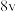 |
| 0.2 | 0.4 | 2 |  |
| 0.4 | 0.1 | 4 | 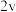 |
| 0.2 | 0.1 |  |  |
| A.α、β、γ的值分别为1、1.5、-1 |
| B.表中m的值为1 |
C.反应体系中的物质,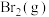 的浓度对反应速率影响最大 的浓度对反应速率影响最大 |
D.若其它条件不变,增大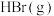 的浓度,则反应速率增大 的浓度,则反应速率增大 |
您最近半年使用:0次
2023-05-10更新
|
592次组卷
|
3卷引用:重庆市2022-2023学年高一下学期化学竞赛试题
名校
解题方法
8 . 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法不正确的是
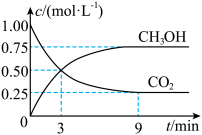

| A.从3min到9min,v(H2)为0.125mol·L-1·min-1 |
| B.若混合气体密度不变时,该反应达平衡状态 |
| C.平衡时向容器中充入Ne,反应速率不变 |
| D.9min时,反应处于平衡状态 |
您最近半年使用:0次
2023-04-27更新
|
259次组卷
|
3卷引用:广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题
名校
解题方法
9 . 利用反应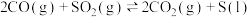
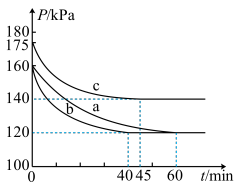
 可实现从燃煤烟气中回收硫。向三个体积相同的恒容密闭容器中通入
可实现从燃煤烟气中回收硫。向三个体积相同的恒容密闭容器中通入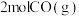 和
和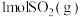 发生反应,反应体系的总压强随时间的变化如图所示。下列说法错误的是
发生反应,反应体系的总压强随时间的变化如图所示。下列说法错误的是
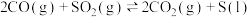
 可实现从燃煤烟气中回收硫。向三个体积相同的恒容密闭容器中通入
可实现从燃煤烟气中回收硫。向三个体积相同的恒容密闭容器中通入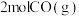 和
和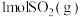 发生反应,反应体系的总压强随时间的变化如图所示。下列说法错误的是
发生反应,反应体系的总压强随时间的变化如图所示。下列说法错误的是
A.实验b中,40min内CO的平均反应速率 |
| B.与实验a相比,实验b改变的条件是加入催化剂 |
C.实验b中 的平衡转化率是75% 的平衡转化率是75% |
D.实验abc相应条件下的平衡常数: |
您最近半年使用:0次
2023-04-11更新
|
1803次组卷
|
14卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题湖南省长沙市第一中学2022-2023学年高三下学期月考(八)化学试题湖南省平江县第一中学2023届高三下学期适应性考试(二)化学试题考点巩固卷08 化学反应速率与化学平衡(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)湖南省名校大联考2024届高三上学期第一次质量检测化学试题湖南四大名校2024届高三上学期第一次联考化学试题湖南省长沙市长郡中学、衡阳市第八中学2024届高三8月大联考化学试题湖南省炎德英才联考2024届高三上学期第一次质量检测化学试题福建省福州延安中学2023-2024学年高三上学期10月月考化学试题福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题湖南省邵东市第一中学2023-2024学年高三上学期第四次月考化学试题湖南省长沙市湖南师范大学附属中学2023-2024学年高三上学期第一次质量检测化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期12月月考化学试卷湖南省邵阳市第二中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
10 . 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,两位同学分别设计了如图甲、乙所示的实验。下列叙述不正确的是
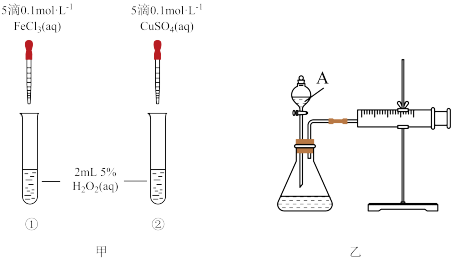

| A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图甲中所示实验反应速率为①>②,则说明Fe3+一定比Cu2+对H2O2分解的催化效果好 |
| C.用图乙所示装置测定反应速率,可测定产生的一定体积气体所需要的时间 |
| D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近半年使用:0次
2022-11-02更新
|
126次组卷
|
85卷引用:2018年广东和广西高中学生化学竞赛试题
2018年广东和广西高中学生化学竞赛试题(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)2016届黑龙江省大庆实验中学高三上学期12月月考化学试卷2015-2016学年辽宁鞍山一中高一下期中化学试卷2015-2016学年浙江宁波效实中学高二下期中化学试卷2015-2016学年河北武邑中学高一下5.15周考化学试卷2015-2016学年湖南省娄底市双峰县高一下期中化学试卷2016-2017学年山东省烟台第二中学高二下学期开学考试化学试卷四川省南充高级中学2016-2017学年高一下学期期末考试化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题四川省三台中学实验学校2017-2018学年高一下学期期末仿真模拟(二)化学试题安徽省定远重点中学2018-2019学年高二上学期第三次月考化学试题(已下线)2019年3月31日 《每日一题》 必修2 每周一测黑龙江省大庆中学2018-2019学年高一下学期期末考试化学试题四川省棠湖中学2018-2019学年高一下学期期末考试化学试题安徽省滁州市定远县育才学校2019-2020学年高二上学期入学考试化学试题贵州省贵阳市第二中学高一下学期期末考试化学试题辽宁省六校协作体2019-2020学年高二上学期10月月考化学试题广东省广州市第16中学2019-2020学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——气体制取流程的规范操作(提升练)2020届高三化学实验复习——气密性的检查【选择突破】四川省棠湖中学2019-2020学年高一下学期第二次月考化学试题第二章 化学反应与能量 第三节 化学反应的速率和限度安徽省阜阳市2019-2020学年高一下学期开学考化学试题吉林省辽源市田家炳高级中学2019-2020学年高一下学期期中考试化学试题安徽省定远县育才学校2019-2020学年高一6月月考化学试题(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)2.1.2 影响化学反应速率的因素(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)安徽省定远县育才学校2020-2021学年高二上学期开学考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 影响化学反应速率的因素鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素山东省潍坊市临朐县实验中学2020-2021学年高二9月月考化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题湖北省随州市曾都一中2020-2021学年高二上学期9月月考化学试题必修第二册RJ高效学习手册-第六章山西省长治市第二中学校2020-2021学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题黑龙江省大庆中学2020-2021学年高二上学期期中考试化学试题安徽省桐城中学2020-2021学年高一上学期12月月考化学试题山西省吕梁市2020-2021学年高二上学期期末考试化学试题河北省张家口市宣化一中2020-2021学年高一下学期期初考试化学试题浙江省丽水市高中发展共同体2020-2021学年高二下学期期中联合测试化学试题福建省三明市三地三校2020-2021学年高一下学期期中联考化学试题选择性必修1 专题2 第一单元 课时2 影响化学反应速率的因素河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题(已下线)专题21 化学反应速率(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题(已下线)专题13 装置气密性的检查方法-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖北省武汉市部分普通高中联合体2021-2022学年高一下学期期中联考化学试题河南省南阳市第一中学校2021-2022学年高一下学期第三次月考化学试题四川省泸州市泸县第四中学2021-2022学年高一下学期期中考试化学试题湖南省长沙市实验中学2021-2022学年高一下学期期中考试化学试题甘肃省天水市秦安县第一中学2021-2022学年高一下学期期中考试化学试题 吉林省长春市东北师范大学附属中学2021-2022学年高一下学期期中考试化学试题宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题广东省珠海市三校2021-2022学年高一下学期期中联考化学试题河南省实验中学2021-2022学年高一下学期期期中考试化学试题辽宁省营口市第二高级中学2021-2022学年高一6月月考化学试题宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题新疆乌鲁木齐市林肯外国语培训学校、第十二中学2021-2022学年高一下学期期中考试化学试题(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)湖北省襄阳市第五中学2022-2023学年高二上学期9月化学试题福建省福州市第三中学2022-2023学年高一上学期10月月考化学试题黑龙江省佳木斯市第十二中学(佳木斯市建三江第一中学)2021-2022学年高一下学期期中考试化学试题广东省化州市第一中学2020-2021学年高二上学期10月月考化学试题甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题福建省南平市浦城第一中学2022-2023学年高一下学期期中考试化学试题福建省南平市浦城县2022-2023学年高一下学期期中考试化学试题浙江省温州市环大罗山联盟2022-2023学年高二上学期11月期中考试化学试题作业(十四) 外界条件对化学反应速率的影响四川省南充高级中学2021-2022学年高一下学期第二次月考化学试题浙江省温州十校联合体2023-2024学年高二上学期期中考试化学试题江苏省苏州市吴江市高级中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市新洲区第一中学2024届高二上学期期末联考化学试题湖北省武汉市新洲区第一中学2024届高二上学期11月阶段测试化学试题新疆实验中学2023-2024学年高二上学期期中考试化学试题



