1 . 完成下列问题。
(1)画出下面反应过渡态的前线轨道示意图___________ 。
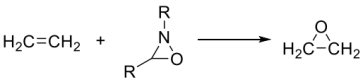
(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i) :
:___________ 。
(ii) :
:___________ 。
(iii) :
:___________ 。
(iv) :
:___________ 。
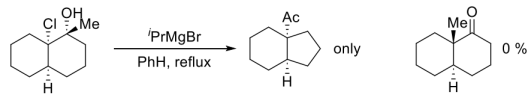
(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)___________ 。
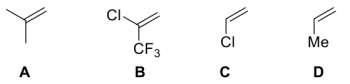
(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为___________ 。
(5)下列二醇被高碘酸氧化的速率从快到慢的排序为___________ 。

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强___________ ?
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么___________ ?
(1)画出下面反应过渡态的前线轨道示意图

(2)试比较下列各组中两个化合物的第一电离势(IP1)大小,并简述理由。
(i)
 :
:(ii)
 :
:(iii)
 :
:(iv)
 :
:(3)为以下反应结果给出一个合适的解释(最好画出反应的过渡态)

(4)下列烯烃与BH3发生硼氢化反应的速率从快到慢的排序为

(5)下列二醇被高碘酸氧化的速率从快到慢的排序为

(6)为什么负离子亲核试剂,例如碳负离子,在DMSO中的亲核性会显著增强
(7)相比于四氢呋喃中,碘负离子的亲核性在甲醇中是更强还是更弱,为什么
您最近一年使用:0次
2 . 当某反应物的初始浓度为0.04 mol·dm-3时,反应的半衰期为400s,初始浓度为0.024 mol·dm-3时,半衰期为240s,则此反应为
| A.零级反应 | B.1.5级反应 | C.二级反应 | D.一级反应 |
您最近一年使用:0次
2023-05-25更新
|
360次组卷
|
2卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
3 . 2022 年北京大学课题组发现[4+2)]反应并对反应机理进行研究,该[4+2]反应是通过在环丁酮2-位引入乙烯基取代作为导向基诱导铑对环丁酮的碳-碳键活化,同时酮碳基可以与路易斯酸配位,进一步活化环丁酮的碳-碳键。这一协同催化模式选择性切断羰基与季碳中心之间的碳-碳键,不仅成功地构建六元环系,还成功拓展到烷基及多种电子效应的芳基上,大部分底物都具有中等到良好的收率,对氰基,酮羰基,酯基及酰胺等官能团具有良好的兼容性,机理如下图,下列表述错误的是
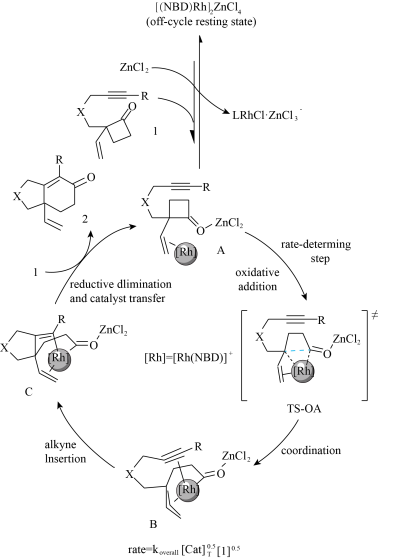

| A.生成TS-OA发生了氧化加成,这一步被认为是反应的决速步 |
| B.其中ZnCl2被认为具有促进C-C的活化和原位生成活性阳离子铑的作用 |
| C.由TS-OA生成B有配位键的形成 |
| D.该反应为合成4元环物质提供一种新的 C-C耦合方式 |
您最近一年使用:0次
2023-05-25更新
|
533次组卷
|
3卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
名校
4 . I.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如下图所示,由图中数据分析可得:
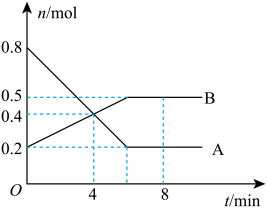
(1)该反应的化学方程式为___________ 。
(2)第4min时,正、逆反应速率的大小关系为v正___________ (填“>” “<”或“=”)v逆
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为___________ mol ·L-1·min-1。
(4)平衡时混合气体中B的体积分数为___________ 。
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(5)写出上述反应的离子方程式___________ 。
(6)若实验探究温度对该反应速率的影响,则a=___________ 采用比较实验的序号是___________ (填实验序号)

(1)该反应的化学方程式为
(2)第4min时,正、逆反应速率的大小关系为v正
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为
(4)平衡时混合气体中B的体积分数为
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
| 实验序号 | 反应温度(°C) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | a |
| C | 25 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
(6)若实验探究温度对该反应速率的影响,则a=
您最近一年使用:0次
2023-05-16更新
|
330次组卷
|
2卷引用:广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题
名校
解题方法
5 . 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法不正确的是
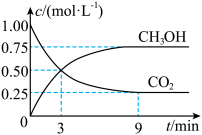

| A.从3min到9min,v(H2)为0.125mol·L-1·min-1 |
| B.若混合气体密度不变时,该反应达平衡状态 |
| C.平衡时向容器中充入Ne,反应速率不变 |
| D.9min时,反应处于平衡状态 |
您最近一年使用:0次
2023-04-27更新
|
264次组卷
|
3卷引用:广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题
6 . 硫酸及其化合物在生产生活中有重要的应用,而硫氧化物是常见的大气污染物。
(1)已知: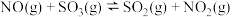
 ,一种可同时脱除
,一种可同时脱除 和
和 的工艺涉及的反应原理及能量变化如下:
的工艺涉及的反应原理及能量变化如下:
Ⅰ: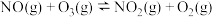
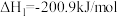
Ⅱ: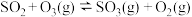
 ,
,
_______ 。
(2)接触法制H2SO4生产中的关键工序是SO2的催化氧化,回答下列问题:
①在V2O5作催化剂条件下SO2(g)与O2(g)反应历程如下:
Ⅰ:_______;
Ⅱ: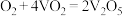
写出第Ⅰ步反应的化学方程式_______ 。
②一定温度下,在2 L的恒容密闭容器中通入4 molSO2(g)和2 mol O2(g)发生反应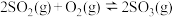 ,5 min后达平衡状态,压强为原来的
,5 min后达平衡状态,压强为原来的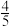 ,从开始到平衡,用SO3(g)表示化学反应速率为
,从开始到平衡,用SO3(g)表示化学反应速率为_______ ,O2的平衡转化率为_______ 。
③若保持反应温度和容器容积不变,对于2SO2(g)+O2(g) 2SO3(g)
2SO3(g)  ,下列可以作为该反应达到平衡判据的有
,下列可以作为该反应达到平衡判据的有_______ (填标号)。
A.气体的压强保持不变
B.2v正(SO2)=v逆(O2)
C. 保持不变
保持不变
D.容器内气体的密度保持不变
E.容器内气体的平均相对分子质量保持不变
④在 时,起始压强为
时,起始压强为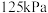 的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料
的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料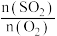 的变化如下图所示,则
的变化如下图所示,则
_______ ,用平衡压强(该物质的体积分数×总压强)代替平衡浓度,则500℃时,该反应的Kp=_______ 。

(1)已知:
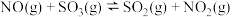
 ,一种可同时脱除
,一种可同时脱除 和
和 的工艺涉及的反应原理及能量变化如下:
的工艺涉及的反应原理及能量变化如下:Ⅰ:
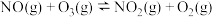
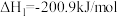
Ⅱ:
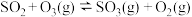
 ,
,
(2)接触法制H2SO4生产中的关键工序是SO2的催化氧化,回答下列问题:
①在V2O5作催化剂条件下SO2(g)与O2(g)反应历程如下:
Ⅰ:_______;
Ⅱ:
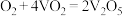
写出第Ⅰ步反应的化学方程式
②一定温度下,在2 L的恒容密闭容器中通入4 molSO2(g)和2 mol O2(g)发生反应
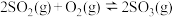 ,5 min后达平衡状态,压强为原来的
,5 min后达平衡状态,压强为原来的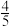 ,从开始到平衡,用SO3(g)表示化学反应速率为
,从开始到平衡,用SO3(g)表示化学反应速率为③若保持反应温度和容器容积不变,对于2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)  ,下列可以作为该反应达到平衡判据的有
,下列可以作为该反应达到平衡判据的有A.气体的压强保持不变
B.2v正(SO2)=v逆(O2)
C.
 保持不变
保持不变D.容器内气体的密度保持不变
E.容器内气体的平均相对分子质量保持不变
④在
 时,起始压强为
时,起始压强为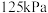 的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料
的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料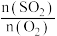 的变化如下图所示,则
的变化如下图所示,则

您最近一年使用:0次
2021-10-10更新
|
396次组卷
|
7卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题湖北省荆州市2021届高三上学期第一次质量检查化学试题(已下线)重点8 化学反应原理的综合应用-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)广西名校大联考2022届高三上学期第一次大联考(入学摸底考试)化学试题江西省景德镇市景德镇一中2022届高三10月月考化学试题河南省驻马店市第一高级中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
7 . 在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生反应:CO(g)+ 2H2(g)  CH3OH(g)。测得CO的转化率随温度及不同压强(p)下的变化如图所示,在p2及195°C时n(H2)随时间的变化结果如表所示。下列说法正确的是
CH3OH(g)。测得CO的转化率随温度及不同压强(p)下的变化如图所示,在p2及195°C时n(H2)随时间的变化结果如表所示。下列说法正确的是
p2及195°C时n(H2)随时间的变化

 CH3OH(g)。测得CO的转化率随温度及不同压强(p)下的变化如图所示,在p2及195°C时n(H2)随时间的变化结果如表所示。下列说法正确的是
CH3OH(g)。测得CO的转化率随温度及不同压强(p)下的变化如图所示,在p2及195°C时n(H2)随时间的变化结果如表所示。下列说法正确的是p2及195°C时n(H2)随时间的变化
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |

| A.压强p2>p1,该反应的正反应为放热反应 |
| B.在p2及195°C时,0~3min内生成CH3OH的平均速率为0.8mol·L-1·min-1 |
| C.在p2及195°C时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
您最近一年使用:0次
2021-08-13更新
|
115次组卷
|
2卷引用:第29届(2015年)全国中学生化学竞赛(湖南省)初赛试题(A卷)
8 . 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速卒和推测反应16 min时反应物的浓度及反应级数,下列说法正确的是
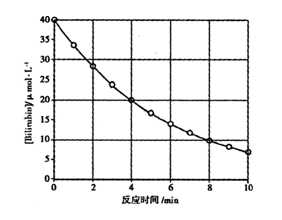

| A.2.5μ mol·L-1·min-1和2.0μ mol·L-1 |
| B.2.5μ mol·L-1·min-1和2.5μ mol·L-1 |
| C.该反应为零级反应 |
| D.该反应为一级反应 |
您最近一年使用:0次
解题方法
9 . 已知某一化学反应的速率常数单位为mol-2·L2·s-1,则该反应为反应
| A.0级 | B.2级 | C.3级 | D.不确定 |
您最近一年使用:0次
10 . 向容积为1.0L的密闭容器中加入X、Y两种物质各0.10 mol,一定温度下下述反应xX+yY  Z中X、Y、Z的物质的量随反应时间的变化曲线如图所示。下列说法中,正确的是
Z中X、Y、Z的物质的量随反应时间的变化曲线如图所示。下列说法中,正确的是

 Z中X、Y、Z的物质的量随反应时间的变化曲线如图所示。下列说法中,正确的是
Z中X、Y、Z的物质的量随反应时间的变化曲线如图所示。下列说法中,正确的是
| A.反应方程式中系数x、y的值分别为3、1 |
| B.该反应达平衡后,增大体系压强或加入催化剂,都可以提高Z的产率 |
| C.若Z为气体,反应开始至2.0 min内,反应平均速率v (Z)为0.01 mol·L-1·min-1 |
| D.反应2.0min后,正、逆反应速率都等于零,故X、Y、Z的物质的量不再随反应时间的变化而改变 |
您最近一年使用:0次



