1 . 利用下列实验装置(夹持装置略)能完成相应实验的是
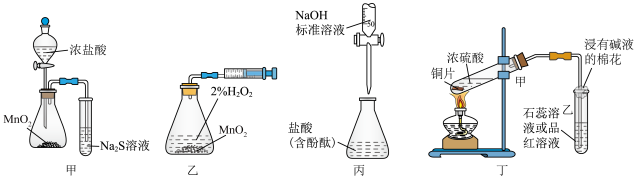
A.装置甲可比较 、 、 、S的氧化性 、S的氧化性 |
| B.装置乙(秒表未画出)可测定化学反应速率 |
| C.装置丙可测定盐酸的浓度 |
D.装置丁中,反应后向试管甲中加水可以检验是否有 生成 生成 |
您最近一年使用:0次
解题方法
2 . 氟(F)、氯(Cl)、溴(Br)、碘(I)属于同主族元素,都是典型的非金属元素。回答下列问题:
(1)二氟卡宾(CF2)是有机氟化学领域中一个非常重要的活性中间体。如图甲为硫单质与二氟卡宾形成S=CF2的反应历程图:
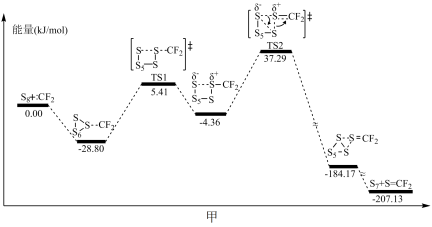
决定反应速率的基元反应的活化能为________________________ 。
(2)CuBr2可用作有机合成溴化剂,在一定温度下CuBr2(s)可发生反应:2CuBr2(s) 2CuBr(s)+Br2(g),在密闭容器中投入足量的CuBr2(s),15分钟后反应到达平衡状态,此时Br2的浓度为9.5mol/L。则这段时间内的平均反应速率V(Br2)=
2CuBr(s)+Br2(g),在密闭容器中投入足量的CuBr2(s),15分钟后反应到达平衡状态,此时Br2的浓度为9.5mol/L。则这段时间内的平均反应速率V(Br2)=____________ (保留两位小数),如果温度保持不变,将容器体积缩小到原来的一半。则再次平衡时Br2为____________ mol/L。
(3)ICl用于有机合成,并可用作强氧化剂,如图乙为H2与ICl的反应能量变化图:
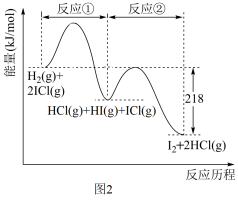
该反应的总反应热化学方程式为________________________________ 。
(4)常温下Fe3+和I-在水中的反应为2Fe3+(aq)+2I-(aq) 2Fe2+(aq)+I2(aq)(不考虑离子水解)。
2Fe2+(aq)+I2(aq)(不考虑离子水解)。
①下列情况能说明该反应达到平衡状态的是_______________________ (填字母)。
A.单位时间内消耗1 mol/L Fe3+同时有1 mol/L Fe2+生成
B.溶液中的c(Fe2+)=2c(I2)
C.溶液中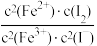 不再变化
不再变化
D.v逆(I-)=2v正(I2)
②保持温度不变,溶液体积为500 mL,将物质的量之和为3 mol的Fe3+和I-以不同的比值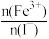 进行反应,平衡时某反应物的转化率与比值及不同温度的关系如图丙所示:
进行反应,平衡时某反应物的转化率与比值及不同温度的关系如图丙所示:

图中纵坐标为____________ 离子的转化率,若T1<T2,则该反应为____________ (填“吸热”或“放热”)反应,图中A对应的平衡常数K=____________ ((保留两位小数)。
(1)二氟卡宾(CF2)是有机氟化学领域中一个非常重要的活性中间体。如图甲为硫单质与二氟卡宾形成S=CF2的反应历程图:

决定反应速率的基元反应的活化能为
(2)CuBr2可用作有机合成溴化剂,在一定温度下CuBr2(s)可发生反应:2CuBr2(s)
 2CuBr(s)+Br2(g),在密闭容器中投入足量的CuBr2(s),15分钟后反应到达平衡状态,此时Br2的浓度为9.5mol/L。则这段时间内的平均反应速率V(Br2)=
2CuBr(s)+Br2(g),在密闭容器中投入足量的CuBr2(s),15分钟后反应到达平衡状态,此时Br2的浓度为9.5mol/L。则这段时间内的平均反应速率V(Br2)=(3)ICl用于有机合成,并可用作强氧化剂,如图乙为H2与ICl的反应能量变化图:

该反应的总反应热化学方程式为
(4)常温下Fe3+和I-在水中的反应为2Fe3+(aq)+2I-(aq)
 2Fe2+(aq)+I2(aq)(不考虑离子水解)。
2Fe2+(aq)+I2(aq)(不考虑离子水解)。①下列情况能说明该反应达到平衡状态的是
A.单位时间内消耗1 mol/L Fe3+同时有1 mol/L Fe2+生成
B.溶液中的c(Fe2+)=2c(I2)
C.溶液中
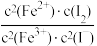 不再变化
不再变化 D.v逆(I-)=2v正(I2)
②保持温度不变,溶液体积为500 mL,将物质的量之和为3 mol的Fe3+和I-以不同的比值
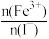 进行反应,平衡时某反应物的转化率与比值及不同温度的关系如图丙所示:
进行反应,平衡时某反应物的转化率与比值及不同温度的关系如图丙所示:
图中纵坐标为
您最近一年使用:0次
3 . 十三届全国人民代表大会第四次会议上作政府工作报告时指出:优化产业结构和能源结构,扎实做好碳达峰、碳中和各项工作。
(1)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
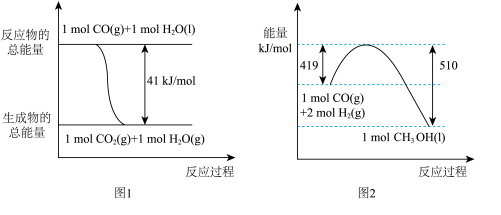
①常温常压下,已知反应的能量变化如图1、图2所示, 由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH= a kJ·mol-1,则a=
CH3OH(l)+H2O(l) ΔH= a kJ·mol-1,则a=___________ 。
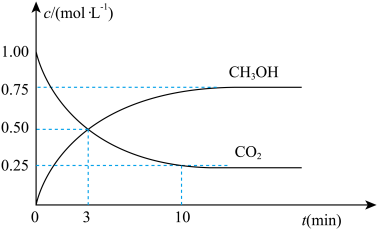
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入lmolCO2和3molH2,进行上述反应。 测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=___________ ;能使平衡体系中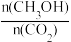 增大的措施有
增大的措施有___________ (任写一条)。
(2)CO2加氢还可制备甲酸(HCOOH)。其反应原理为CO2(g)+H2(g) HCOOH(g) △H= -31.4 kJ·mol-1。
HCOOH(g) △H= -31.4 kJ·mol-1。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2。实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) K=2。实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___________ k正。
②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强___________ (填“>”“<”或“=”)T1℃时平衡压强,理由是___________ 。
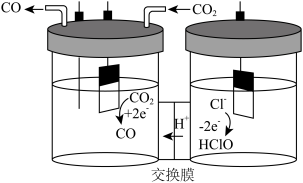
(3)我国科学家设计了一种将电解饱和食盐水与电催化还原CO2相耦合的电解装置(如图)。阴极上的电极反应式为:___________
(1)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。①常温常压下,已知反应的能量变化如图1、图2所示, 由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ΔH= a kJ·mol-1,则a=
CH3OH(l)+H2O(l) ΔH= a kJ·mol-1,则a=
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入lmolCO2和3molH2,进行上述反应。 测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=
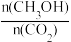 增大的措施有
增大的措施有
(2)CO2加氢还可制备甲酸(HCOOH)。其反应原理为CO2(g)+H2(g)
 HCOOH(g) △H= -31.4 kJ·mol-1。
HCOOH(g) △H= -31.4 kJ·mol-1。①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) K=2。实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) K=2。实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强
(3)我国科学家设计了一种将电解饱和食盐水与电催化还原CO2相耦合的电解装置(如图)。阴极上的电极反应式为:

您最近一年使用:0次
名校
解题方法
4 . 用下图实验装置进行有关实验,能达到实验目的的是
| A | B | C | D |
 |  |  |  |
除去溶在 中的 中的 | 干燥氨气 | 将 从溶液中结晶析出 从溶液中结晶析出 | 测定化学反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-13更新
|
817次组卷
|
5卷引用:宁夏石嘴山市2023届高三适应性测试理科综合化学试题
宁夏石嘴山市2023届高三适应性测试理科综合化学试题湖南省岳阳市2023届高三教学质量监测(一)化学试题湖南省株洲市南方中学2023届高三第六次月考化学试题(已下线)专题卷19 仪器的使用与实验装置分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题13 化学实验基础
名校
解题方法
5 . CO2作为未来的重要碳源,其选择性加氢合成CH3OH 一直是研究热点。在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应i:CO2(g) +3H2(g) CH3OH(g)+H2O(g)△H1<0
CH3OH(g)+H2O(g)△H1<0
反应ii:CO2(g) +H2(g) CO(g) +H2O(g) △H2
CO(g) +H2O(g) △H2
(1)反应i在_______ (填“高温”“低温”或“任意温度”)下可以自发进行。
(2)在特定温度下,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓( )。下表为几种物质在298K的标准生成焓,则反应ii的△H2=
)。下表为几种物质在298K的标准生成焓,则反应ii的△H2=_______ kJ·mol-1.
(3)在CO2加氢合成CH3OH的体系中,下列说法错误的是_______(填标号)。
(4)某温度下,向容积为1L的密闭容器中通入1molCO2 (g)和5molH2(g), 10min后体系达到平衡,此时H2的转化率为8%,CH3OH 的选择性为50%。已知:CH3OH的选择性x=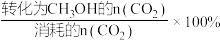
①用CO2表示0~10min内平均反应速率v(CO2)=_______ 。
②反应i的平衡常数K_______ (写出计算式即可)。
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率α(CO2) 和甲醇的选择性x(CH3OH)随温度变化的关系如图所示:
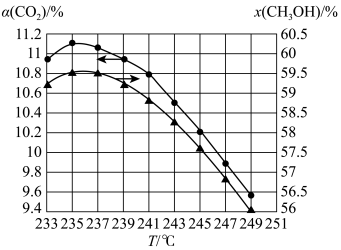
已知催化剂活性受温度影响变化不大。结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是_______ ;
②二氧化碳的转化率随温度升高也在下降的可能原因是_______ 。
反应i:CO2(g) +3H2(g)
 CH3OH(g)+H2O(g)△H1<0
CH3OH(g)+H2O(g)△H1<0反应ii:CO2(g) +H2(g)
 CO(g) +H2O(g) △H2
CO(g) +H2O(g) △H2(1)反应i在
(2)在特定温度下,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓(
 )。下表为几种物质在298K的标准生成焓,则反应ii的△H2=
)。下表为几种物质在298K的标准生成焓,则反应ii的△H2=| 物质 | H2(g) | CO2(g) | CO(g) | H2O(g) |
 (kJ·mol-1) (kJ·mol-1) | 0 | -394 | -111 | -242 |
| A.增大H2浓度有利于提高CO2的转化率 |
| B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| C.体系达平衡后,若压缩体积,则反应i平衡正向移动,反应ii平衡不移动。 |
| D.选用合适的催化剂可以提高平衡之前CH3OH在单位时间内的产量 |
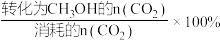
①用CO2表示0~10min内平均反应速率v(CO2)=
②反应i的平衡常数K
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率α(CO2) 和甲醇的选择性x(CH3OH)随温度变化的关系如图所示:

已知催化剂活性受温度影响变化不大。结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是
②二氧化碳的转化率随温度升高也在下降的可能原因是
您最近一年使用:0次
2022-06-06更新
|
280次组卷
|
2卷引用:2023届宁夏石嘴山市第三中学高三一模考试理科综合试题
名校
解题方法
6 . 当今中国积极推进绿色低碳发展,力争在2030年前实现碳达峰,2060年前实现碳中和。因此,研发CO2利用技术,降低空气中CO2含量成为研究热点。工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I: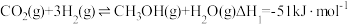
反应II: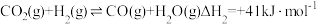
(1)①一定条件下,一氧化碳加氢生成甲醇的热化学方程式为: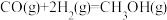 △H =
△H =___________ kJ·mol-1。
②若反应II逆反应活化能Ea(逆)为120 kJ·mol-1,则该反应的Ea(正)活化能为___________ kJ·mol-1。
(2)有研究表明,用可控Cu/Cu2O界面材料作催化剂可以提高CO2还原合成甲醇的选择性。将6.0 mol CO2和8.0 mol H2充入一体积为2L的恒温密闭容器中,发生反应3H2(g) + CO2(g) CH3OH(g) + H2O(g) △H< 0。测得起始压强为70MPa,H2的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。
CH3OH(g) + H2O(g) △H< 0。测得起始压强为70MPa,H2的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。
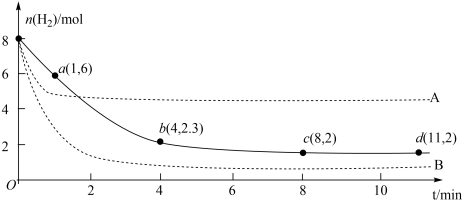
①图中虚线A、B为改变某一条件时的变化,与实线相比,虚线A改变的条件可能是___________ ,虚线B改变的条件可能是___________ 。
②该反应在0—4min内H2O的平均反应速率为___________ (保留2位有效数字)。
③计算该条件下(实线)的Kp为___________ MPa-2 (以分压表示,分压=总压×物质的量分数);
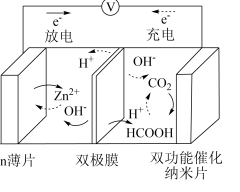
(3)中科院福建物质结构研究所基于CO2和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示。该装置充电时,阳极的电极反应式为______ 。
反应I:
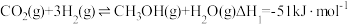
反应II:
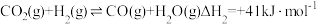
(1)①一定条件下,一氧化碳加氢生成甲醇的热化学方程式为:
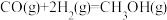 △H =
△H =②若反应II逆反应活化能Ea(逆)为120 kJ·mol-1,则该反应的Ea(正)活化能为
(2)有研究表明,用可控Cu/Cu2O界面材料作催化剂可以提高CO2还原合成甲醇的选择性。将6.0 mol CO2和8.0 mol H2充入一体积为2L的恒温密闭容器中,发生反应3H2(g) + CO2(g)
 CH3OH(g) + H2O(g) △H< 0。测得起始压强为70MPa,H2的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。
CH3OH(g) + H2O(g) △H< 0。测得起始压强为70MPa,H2的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。
①图中虚线A、B为改变某一条件时的变化,与实线相比,虚线A改变的条件可能是
②该反应在0—4min内H2O的平均反应速率为
③计算该条件下(实线)的Kp为
(3)中科院福建物质结构研究所基于CO2和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示。该装置充电时,阳极的电极反应式为

您最近一年使用:0次
7 . SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-akJ/mol
S(s)+O2(g)═SO2(g) ΔH2=-bkJ/mol
CH4(g)+2SO2(g)═2S(s)+CO2(g)+2H2O(l) ΔH3=____ (用含a、b的代数式表示)。
(2)用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示:
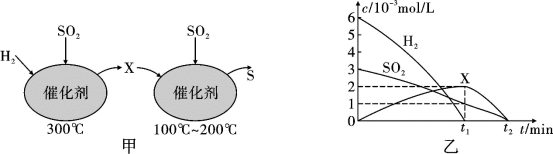
①分析可知X为____ (写化学式),0~t1时间段的反应温度为____ ,0~t1时间段用SO2表示的化学反应速率为____ 。
②总反应的化学方程式为____ 。
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图丙所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图丙所示。
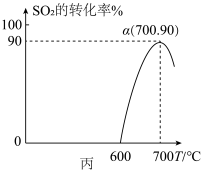
①该反应的平衡常数表达式为____ 。
②反应的ΔH____ 0(填“>”或“<”)。
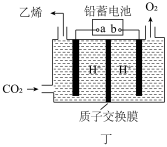
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图丁所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为____ ;每生成0.5mol乙烯,理论上需消耗铅蓄电池中___ mol单质Pb。
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-akJ/mol
S(s)+O2(g)═SO2(g) ΔH2=-bkJ/mol
CH4(g)+2SO2(g)═2S(s)+CO2(g)+2H2O(l) ΔH3=
(2)用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示:

①分析可知X为
②总反应的化学方程式为
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)
 S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图丙所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图丙所示。
①该反应的平衡常数表达式为
②反应的ΔH
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图丁所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为

您最近一年使用:0次
名校
解题方法
8 . 近几年经济发展迅速,汽车数量越来越多,在方便我们的工作和生活的同时,也带来了严重的环境问题,为了消除汽车尾气对大气环境和人体健康造成的影响,科学家们想了很多处理尾气的方法。
(1)活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
①判断该反应达到平衡的标志为___________ 。(填标号)
A.容器内气体的物质的量恒定 B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2) D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:

a.图中A点v正___________ v逆(填“>”“<”或“=”)。
b.0~20min内的N2平均反应速率v=___________ ;在此过程中,气体的平均相对分子质量____ (填“增大”、“减小”或“不变”)。
c.第20min时,外界改变的条件可能是___________ 。
(2)CO可以与NO2反应:4CO(g)+2NO2(g) N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H
N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H___________ 0(填“>”或“<”,下同);p1___________ p2。

(3)在汽车排气管上安装催化转化器可以有效降低汽车尾气中的NO和CO,反应方程式为:2CO(g)+2NO(g) N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=
N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=______ 。(Kp为以分压表示的平衡常数,分压=总压×某物质的物质的量分数)
(1)活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)。
N2(g)+CO2(g)。①判断该反应达到平衡的标志为
A.容器内气体的物质的量恒定 B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2) D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
a.图中A点v正
b.0~20min内的N2平均反应速率v=
c.第20min时,外界改变的条件可能是
(2)CO可以与NO2反应:4CO(g)+2NO2(g)
 N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H
N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H
(3)在汽车排气管上安装催化转化器可以有效降低汽车尾气中的NO和CO,反应方程式为:2CO(g)+2NO(g)
 N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=
N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=
您最近一年使用:0次
2021-05-12更新
|
283次组卷
|
4卷引用:宁夏吴忠市2021届高三下学期4月高考模拟(第二次联考)理综化学试题
名校
解题方法
9 . CO、H2是重要的化工原料,可用于合成许多重要的有机物。
(1)反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的 ΔH=-49.0 kJ/mol,它是由反应①、反应②加和得到的。已知反应①为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ/mol,则反应②的热化学方程式为___________ 。
(2)350℃时,按投料比n(H2)∶n(CO)=2向容积为10 L、初始压强为0.3 MPa的刚性密闭容器中充入H2和CO,在某催化剂存在下使其发生反应:2CO(g)+4H2(g) C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=
C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=___________ (只列式,不计算),若反应从开始到达到平衡过程中ν(H2)=0.012 MPa·min−1,则相应的时间t=___________ min。若本反应是在恒压条件(其他条件相同)下进行的,则达到平衡所用时间___________ t(填“>”“<”或“=”)。
(3)以Na2O/Fe5C2为催化剂时,丙烯催化加氢得到丙烷的反应历程与相对能量的关系如图所示。TS1表示过渡态1、TS2表示过渡态2,吸附在催化剂表面的物种用※标出。
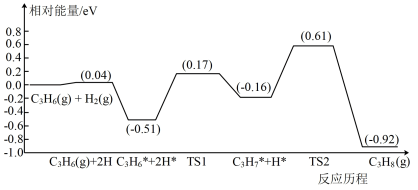
由图可知,该历程中最大活化能=___________ eV,写出该步骤的反应方程式___________ 。该历程中C3H6※转化为C3H7※的速率比C3H7※转化为C3H8的速率___________ (填“大”或“小”)。
(4)熔融盐燃料电池具有较高的能量转化效率,某CO熔融盐燃料电池用Li2CO3、Na2CO3作电解质。则工作时负极上电极反应式为___________ ,当有2 mol  发生定向移动时,电路中转移的电子数目为
发生定向移动时,电路中转移的电子数目为___________ (用NA表示阿伏加德罗常数的值)。
(1)反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的 ΔH=-49.0 kJ/mol,它是由反应①、反应②加和得到的。已知反应①为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ/mol,则反应②的热化学方程式为
(2)350℃时,按投料比n(H2)∶n(CO)=2向容积为10 L、初始压强为0.3 MPa的刚性密闭容器中充入H2和CO,在某催化剂存在下使其发生反应:2CO(g)+4H2(g)
 C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=
C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=(3)以Na2O/Fe5C2为催化剂时,丙烯催化加氢得到丙烷的反应历程与相对能量的关系如图所示。TS1表示过渡态1、TS2表示过渡态2,吸附在催化剂表面的物种用※标出。

由图可知,该历程中最大活化能=
(4)熔融盐燃料电池具有较高的能量转化效率,某CO熔融盐燃料电池用Li2CO3、Na2CO3作电解质。则工作时负极上电极反应式为
 发生定向移动时,电路中转移的电子数目为
发生定向移动时,电路中转移的电子数目为
您最近一年使用:0次
2021-05-02更新
|
193次组卷
|
2卷引用:宁夏海原县第一中学2021届高三第四次模拟考试化学试题
名校
解题方法
10 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
Ⅰ.

Ⅱ.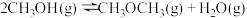

Ⅲ.

则

_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)在1 L恒容密闭容器中充入一定量 发生反应:
发生反应: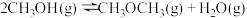
 ,测得
,测得 的浓度与温度的关系如图所示:
的浓度与温度的关系如图所示:

①
_______ (填“>”“<”或“=”)0,说明理由_______ 。
②在 时达到平衡后,再向容器中充入少量甲醇蒸气,
时达到平衡后,再向容器中充入少量甲醇蒸气, 的平衡转化率
的平衡转化率_______ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成 的反应表示如下:
的反应表示如下: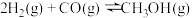
 。向1 L的恒容密闭容器中加入
。向1 L的恒容密闭容器中加入 和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64 kJ。
和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好到平衡状态时, 的平均反应速率
的平均反应速率 为
为_______ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入 和
和 时,平衡
时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
(1)几个有关CO的热化学方程式如下:
Ⅰ.


Ⅱ.
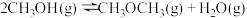

Ⅲ.


则


 、
、 、
、 的代数式表示)。
的代数式表示)。(2)在1 L恒容密闭容器中充入一定量
 发生反应:
发生反应: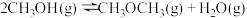
 ,测得
,测得 的浓度与温度的关系如图所示:
的浓度与温度的关系如图所示:
①

②在
 时达到平衡后,再向容器中充入少量甲醇蒸气,
时达到平衡后,再向容器中充入少量甲醇蒸气, 的平衡转化率
的平衡转化率(3)工业上,利用水煤气合成
 的反应表示如下:
的反应表示如下: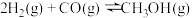
 。向1 L的恒容密闭容器中加入
。向1 L的恒容密闭容器中加入 和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64 kJ。
和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好到平衡状态时,
 的平均反应速率
的平均反应速率 为
为②在温度不变条件下,上述反应达到平衡后再向容器中充入
 和
和 时,平衡
时,平衡
您最近一年使用:0次
2021-04-02更新
|
165次组卷
|
2卷引用:宁夏六盘山高级中学2023-2024学年高三一模考试化学试题



