宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题
宁夏
高三
阶段练习
2021-05-20
723次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、物质结构与性质、认识化学科学、化学反应原理
宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题
宁夏
高三
阶段练习
2021-05-20
723次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、物质结构与性质、认识化学科学、化学反应原理
一、单选题 添加题型下试题
1. 中华优秀传统文化涉及到很多的化学知识。下列有关说法不正确的是( )
| A.“自古书契多编以竹简,其用缣帛者(丝质品)谓之为纸”,这里的纸主要成分为纤维素 |
| B.中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2 |
| C.东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的黄芽是指硫 |
| D.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。这里的瓦属于传统无机非金属材料,主要成分为硅酸盐 |
您最近一年使用:0次
2020-06-17更新
|
1573次组卷
|
11卷引用:东北三省三校哈师大附中2020年高三第三次模拟考试理综化学试题
东北三省三校哈师大附中2020年高三第三次模拟考试理综化学试题湖南省长沙市雅礼中学2019-2020学年高二下学期期末考试化学试题河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(二)化学试题天津市十二区县重点学校2021届高三毕业班联考模拟化学试题宁夏海原县第一中学2021届高三第四次模拟考试化学试题宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题黑龙江省大庆中学2021届高三第一次仿真考试化学试题(已下线)第09讲 无机非金属材料 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-练习黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第五次月考化学试题广东省汕头市第一中学2022届高三下学期4月月考化学试题
单选题
|
较易(0.85)
名校
2. 中医药在抗击新冠肺炎疫情中发挥了重要作用,有些中医药对其他的病症也有着独特的疗效,以下成分(结构如图)对肿瘤细胞的杀伤有独特作用。下列有关该物质的叙述正确的是


| A.该物质有5种官能团 |
| B.分子中苯环上的一氯代物只有6种 |
| C.可以发生取代反应、加成反应、氧化反应、还原反应 |
| D.1 mol该物质与氢气反应,最多消耗7 mol H2 |
【知识点】 有机反应类型 有机官能团的性质及结构 含碳碳双键物质的性质的推断解读
您最近一年使用:0次
2021-05-02更新
|
674次组卷
|
6卷引用:宁夏海原县第一中学2021届高三第四次模拟考试化学试题
宁夏海原县第一中学2021届高三第四次模拟考试化学试题宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题黑龙江省大庆中学2021届高三第一次仿真考试化学试题吉林省长春市第二十中学2020-2021学年高二下学期第二次质量测试化学试题(已下线)专题03 常见有机物的性质及应用—2022年高考化学二轮复习讲练测(全国版)-测试江西省赣州厚德外国语学校、丰城中学2022-2023学年高三上学期10月联考化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 下列制取或收集气体装置中棉花作用不正确的是
| A | B | C | D | |
| 名称 | 加热高锰酸钾制取氧气 | 制取并收集氨气 | 铜与浓硫酸反应制取SO2 | 铁粉与高温下的水蒸气反应 |
| 装置 | 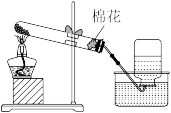 | 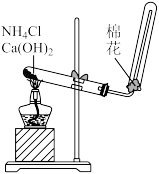 | 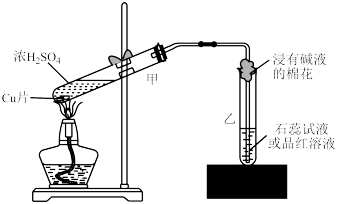 |  + + |
 作用 作用 | 防止高锰酸钾颗粒进入导气管,造成堵塞 | 吸收过量的氨气,防止氨气泄漏到空气中 | 吸收过量的二氧化硫,防止二氧化硫污染空气 | 提供水蒸气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-05更新
|
590次组卷
|
5卷引用:安徽省安庆市2021届高三第二次模拟理综化学试题
安徽省安庆市2021届高三第二次模拟理综化学试题(已下线)押山东卷第05题 实验装置的评价-备战2021年高考化学临考题号押题(山东卷)宁夏海原县第一中学2021届高三第四次模拟考试化学试题宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2022年高考化学一轮复习讲练测
单选题
|
适中(0.65)
名校
4. 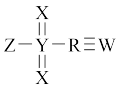 是一种用途广泛的有机合成试剂,R、W、X、Y、Z五种原子序数依次递增的短周期元素,R的最外层电子为内层电子的2倍,R与X形成的化合物可造成温室效应,下列叙述正确的是
是一种用途广泛的有机合成试剂,R、W、X、Y、Z五种原子序数依次递增的短周期元素,R的最外层电子为内层电子的2倍,R与X形成的化合物可造成温室效应,下列叙述正确的是
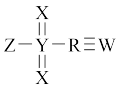 是一种用途广泛的有机合成试剂,R、W、X、Y、Z五种原子序数依次递增的短周期元素,R的最外层电子为内层电子的2倍,R与X形成的化合物可造成温室效应,下列叙述正确的是
是一种用途广泛的有机合成试剂,R、W、X、Y、Z五种原子序数依次递增的短周期元素,R的最外层电子为内层电子的2倍,R与X形成的化合物可造成温室效应,下列叙述正确的是| A.14W与14R的中子数相同 |
| B.离子半径:Z>Y>X |
| C.简单氢化物还原性:Z>Y |
| D.R、W、X三种元素均能与氢元素形成含非极性键的二元化合物 |
您最近一年使用:0次
2021-05-02更新
|
235次组卷
|
3卷引用:宁夏海原县第一中学2021届高三第四次模拟考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 下列反应的离子方程式正确的是
| A.Fe2O3溶于HI溶液中:Fe2O3 + 6H+ = 2Fe3+ + 3H2O |
B.向饱和苯酚钠溶液中通入少量CO2:C6H5O-+ CO2 + H2O = C6H5OH↓+HCO |
C.用足量NaOH浓溶液吸收NO2尾气:3NO2+2OH-=2NO +NO↑+H2O +NO↑+H2O |
| D.Cl2与热的NaOH溶液反应:Cl2 +2OH- = Cl- + ClO- + 2H2O |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读 苯酚的弱酸性解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
6. 科学家首次用CO2高效合成乙酸,其反应路径如图所示,
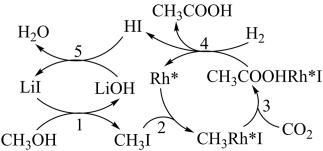
下列叙述不正确的是

下列叙述不正确的是
| A.HI、LiOH、CH3I、CH3Rh*I、CH3COORh*I为反应的中间产物 |
| B.第4步反应的氧化剂是CH3COORh*I |
| C.反应过程中碳元素的化合价始终不变 |
D.催化循环的总反应为CH3OH+CO2+H2 CH3COOH+H2O CH3COOH+H2O |
【知识点】 氧化还原反应定义、本质及特征解读 常见氧化剂与还原剂解读
您最近一年使用:0次
2021-04-01更新
|
477次组卷
|
7卷引用:全国百强名校“领军考试”2021届高三下学期3月联考理综化学试题
单选题
|
适中(0.65)
名校
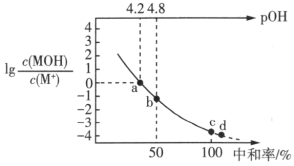
7. 三甲胺 [N(CH3)3]是一种一元有机弱碱,可简写为MOH。常温下,向20mL 0.5mol/L MOH溶液中逐滴加入浓度为0.25mol/L的HCl溶液,溶液中lg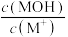 、pOH[pOH=-lgc(OH-)]、中和率(
、pOH[pOH=-lgc(OH-)]、中和率( )的变化如图所示。下列说法正确的是
)的变化如图所示。下列说法正确的是
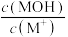 、pOH[pOH=-lgc(OH-)]、中和率(
、pOH[pOH=-lgc(OH-)]、中和率( )的变化如图所示。下列说法正确的是
)的变化如图所示。下列说法正确的是
| A.三甲胺[N(CH3)3]的电离常数为10-4.8 |
| B.a点时,c(MOH)+c(M+)=2c(Cl-) |
| C.b点时,c(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+) |
| D.溶液中水的电离程度:c点<d点 |
您最近一年使用:0次
2021-01-09更新
|
1372次组卷
|
11卷引用:2021年河北省高中名校名师原创预测卷化学(第五模拟)
2021年河北省高中名校名师原创预测卷化学(第五模拟)湖北省孝感市孝感高级中学2021届高三2月调研考试化学试题天津市十二区县重点学校2021届高三毕业班联考模拟化学试题辽宁省锦州市2021届高考第一次模拟(普通高中高三质量检测)化学试题宁夏海原县第一中学2021届高三第四次模拟考试化学试题(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题河南省新乡名校2020-2021学年高二下学期期末联考化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-讲义陕西省西北工业大学附中2020-2021学年高二下学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
8. 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
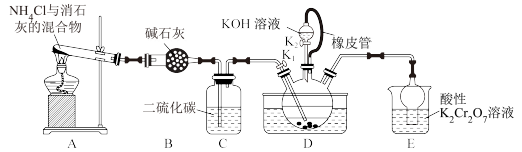
已知:① 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
②三颈烧瓶内盛放: 、水和催化剂。
、水和催化剂。
③ ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。
回答下列问题:
(1)装置A中反应的化学方程式是_______ 。
(2)装置C的作用是_______ 。
(3)制备 溶液:熄灭A处的酒精灯,关闭
溶液:熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,然后打开
,保持三颈烧瓶内液温105℃一段时间,然后打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,写出装置D中生成
溶液,写出装置D中生成 的化学方程式:
的化学方程式:_______ 。
(4)装置E的作用为吸收尾气,防止污染环境,写出吸收 时的离子方程式
时的离子方程式_______ 。
(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压、_______ 、_______ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(6)测定晶体中 【
【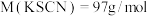 】的含量:称取
】的含量:称取 样品。配成
样品。配成 溶液量取
溶液量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用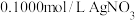 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
[已知:滴定时发生的反应: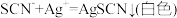 。]
。]
①滴定过程的指示剂a为_______ (用化学式表示)
②晶体中 的质量分数为
的质量分数为_______ 。
③滴定达到终点后,发现滴定管尖嘴部分有悬滴,则 的质量分数
的质量分数__ 。(偏大、偏小或无影响)
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
已知:①
 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;②三颈烧瓶内盛放:
 、水和催化剂。
、水和催化剂。③
 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。回答下列问题:
(1)装置A中反应的化学方程式是
(2)装置C的作用是
(3)制备
 溶液:熄灭A处的酒精灯,关闭
溶液:熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,然后打开
,保持三颈烧瓶内液温105℃一段时间,然后打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,写出装置D中生成
溶液,写出装置D中生成 的化学方程式:
的化学方程式:(4)装置E的作用为吸收尾气,防止污染环境,写出吸收
 时的离子方程式
时的离子方程式(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压、
(6)测定晶体中
 【
【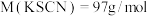 】的含量:称取
】的含量:称取 样品。配成
样品。配成 溶液量取
溶液量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用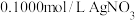 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。[已知:滴定时发生的反应:
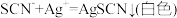 。]
。]①滴定过程的指示剂a为
②晶体中
 的质量分数为
的质量分数为③滴定达到终点后,发现滴定管尖嘴部分有悬滴,则
 的质量分数
的质量分数
您最近一年使用:0次
2021-03-24更新
|
667次组卷
|
4卷引用:天津市十二区县重点学校2021届高三毕业班联考模拟化学试题
天津市十二区县重点学校2021届高三毕业班联考模拟化学试题宁夏海原县第一中学2021届高三第四次模拟考试化学试题宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)
解答题-工业流程题
|
适中(0.65)
名校
解题方法
9. 工业上常用辉铜矿(主要成分为Cu2S,含有Fe2O3、CaO、SiO2等杂质)制备重要催化剂CuCl。工艺如下:
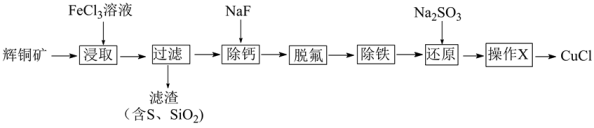
已知:①CuCl为难溶于水的白色固体
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
请回答下列问题:
(1)“浸取”过程中Cu2S转化为可溶性铜盐的离子方程式为:___________ 。
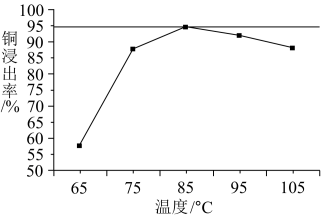
(2) “浸取”是该工艺的第一步,提高浸出率可提高最终产品产率。工程师研究发现单独加入FeCl3溶液时Cu2+浸出率很低,但同时加入FeCl3溶液和H2O2时可提高Cu2+浸出率,其原因可能是___________ 。进一步研究发现,加入H2O2后随温度升高,一定时间后Cu2+浸出率随温度变化的曲线如图。请分析温度高于85℃,Cu2+浸出率下降的原因___________ 。
(3)已知Ksp(CaF2)=4.0×10−11.经测定“浸出液”中Ca2+浓度为4.0×10−3mol·L−1,加入NaF除去溶液中Ca2+,当溶液中c(F-)=1.0×10−3mol·L−1时,除钙率为___________ 。
(4)“除铁”过程包括氧化Fe2+、加入CuO调节pH等过程,为达到“除铁”目的需调节溶液pH范围为___________ 。
(5)“还原”过程中反应的离子方程式为:___________ 。
(6)通过“操作X”___________ (填操作名称),最终得到CuCl产品。

已知:①CuCl为难溶于水的白色固体
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Cu2+ | 4.4 | 6.4 |
请回答下列问题:
(1)“浸取”过程中Cu2S转化为可溶性铜盐的离子方程式为:
(2) “浸取”是该工艺的第一步,提高浸出率可提高最终产品产率。工程师研究发现单独加入FeCl3溶液时Cu2+浸出率很低,但同时加入FeCl3溶液和H2O2时可提高Cu2+浸出率,其原因可能是

(3)已知Ksp(CaF2)=4.0×10−11.经测定“浸出液”中Ca2+浓度为4.0×10−3mol·L−1,加入NaF除去溶液中Ca2+,当溶液中c(F-)=1.0×10−3mol·L−1时,除钙率为
(4)“除铁”过程包括氧化Fe2+、加入CuO调节pH等过程,为达到“除铁”目的需调节溶液pH范围为
(5)“还原”过程中反应的离子方程式为:
(6)通过“操作X”
您最近一年使用:0次
2021-04-05更新
|
1566次组卷
|
7卷引用:安徽省安庆市2021届高三第二次模拟理综化学试题
安徽省安庆市2021届高三第二次模拟理综化学试题宁夏海原县第一中学2021届高三第四次模拟考试化学试题宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题河南省新乡名校2020-2021学年高二下学期期末联考化学试题(已下线)2022年全国乙卷高考变式题(非选择题)山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题(已下线)02 无机化工流程题(2) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解答题-原理综合题
|
适中(0.65)
名校
解题方法
10. CO、H2是重要的化工原料,可用于合成许多重要的有机物。
(1)反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的 ΔH=-49.0 kJ/mol,它是由反应①、反应②加和得到的。已知反应①为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ/mol,则反应②的热化学方程式为___________ 。
(2)350℃时,按投料比n(H2)∶n(CO)=2向容积为10 L、初始压强为0.3 MPa的刚性密闭容器中充入H2和CO,在某催化剂存在下使其发生反应:2CO(g)+4H2(g) C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=
C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=___________ (只列式,不计算),若反应从开始到达到平衡过程中ν(H2)=0.012 MPa·min−1,则相应的时间t=___________ min。若本反应是在恒压条件(其他条件相同)下进行的,则达到平衡所用时间___________ t(填“>”“<”或“=”)。
(3)以Na2O/Fe5C2为催化剂时,丙烯催化加氢得到丙烷的反应历程与相对能量的关系如图所示。TS1表示过渡态1、TS2表示过渡态2,吸附在催化剂表面的物种用※标出。
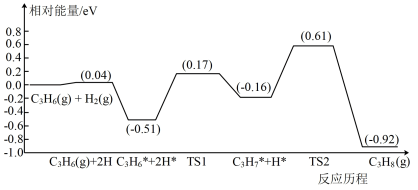
由图可知,该历程中最大活化能=___________ eV,写出该步骤的反应方程式___________ 。该历程中C3H6※转化为C3H7※的速率比C3H7※转化为C3H8的速率___________ (填“大”或“小”)。
(4)熔融盐燃料电池具有较高的能量转化效率,某CO熔融盐燃料电池用Li2CO3、Na2CO3作电解质。则工作时负极上电极反应式为___________ ,当有2 mol  发生定向移动时,电路中转移的电子数目为
发生定向移动时,电路中转移的电子数目为___________ (用NA表示阿伏加德罗常数的值)。
(1)反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的 ΔH=-49.0 kJ/mol,它是由反应①、反应②加和得到的。已知反应①为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ/mol,则反应②的热化学方程式为
(2)350℃时,按投料比n(H2)∶n(CO)=2向容积为10 L、初始压强为0.3 MPa的刚性密闭容器中充入H2和CO,在某催化剂存在下使其发生反应:2CO(g)+4H2(g)
 C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=
C2H4(g)+ 2H2O(g),平衡时CO的转化率为60%,此时的Kp=(3)以Na2O/Fe5C2为催化剂时,丙烯催化加氢得到丙烷的反应历程与相对能量的关系如图所示。TS1表示过渡态1、TS2表示过渡态2,吸附在催化剂表面的物种用※标出。

由图可知,该历程中最大活化能=
(4)熔融盐燃料电池具有较高的能量转化效率,某CO熔融盐燃料电池用Li2CO3、Na2CO3作电解质。则工作时负极上电极反应式为
 发生定向移动时,电路中转移的电子数目为
发生定向移动时,电路中转移的电子数目为
您最近一年使用:0次
2021-05-02更新
|
193次组卷
|
2卷引用:宁夏海原县第一中学2021届高三第四次模拟考试化学试题
解答题-结构与性质
|
较难(0.4)
名校
解题方法
11. 过渡钴元素是磁化一次就能保持磁性的少数金属元素之一,可制成超硬耐热合金、磁性合金或粘合剂等,请回答下列问题:
(1)钴的基态原子的价电子排布为___________ 。
(2)橙红色晶体羰基钴的分子式为Co2(CO)8,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为___________ (填元素符号)
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子中心原子的杂化方式为___________ 。
(4)CoCl2溶液加氨水直接先生成的Co(OH)2沉淀又溶解,再加氨水,生成[CoNH3)6]Cl2,1 mol [Co(NH3)5Cl]Cl2中含σ键数目为___________ (用NA表示阿伏加德罗常数),含有的作用力有___________ (填序号)
a.配位键 b.离子键 c.金属键 d.氢键 e.极性键 f.非极性键
(5)①在HClO4-NaClO4,介质中,K5[Co3+O4W12O36](简写为Co3+W)可催化合成酯,组成HClO4-NaClO4中H、Na、O元素的第一电离能由小到大的顺序为___________ 。
②写出ClO 的一种等电子体的化学式为
的一种等电子体的化学式为___________ 。
(6)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm,设NA为阿伏加德罗常数的值,则晶胞密度为___________ g·cm-3(列出计算式)

(1)钴的基态原子的价电子排布为
(2)橙红色晶体羰基钴的分子式为Co2(CO)8,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子中心原子的杂化方式为
(4)CoCl2溶液加氨水直接先生成的Co(OH)2沉淀又溶解,再加氨水,生成[CoNH3)6]Cl2,1 mol [Co(NH3)5Cl]Cl2中含σ键数目为
a.配位键 b.离子键 c.金属键 d.氢键 e.极性键 f.非极性键
(5)①在HClO4-NaClO4,介质中,K5[Co3+O4W12O36](简写为Co3+W)可催化合成酯,组成HClO4-NaClO4中H、Na、O元素的第一电离能由小到大的顺序为
②写出ClO
 的一种等电子体的化学式为
的一种等电子体的化学式为(6)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm,设NA为阿伏加德罗常数的值,则晶胞密度为

您最近一年使用:0次
2021-04-01更新
|
380次组卷
|
4卷引用:全国百强名校“领军考试”2021届高三下学期3月联考理综化学试题
解答题-有机推断题
|
较易(0.85)
名校
解题方法
12. 下面是有机化合物G(1,3-环已二醇)的一种合成路线。
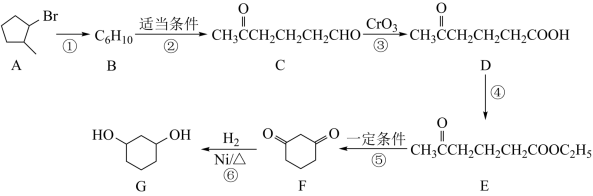
(1)C中官能团的名称为___________ ,B的结构简式为___________ 。
(2)反应③的反应类型是___________ ,反应④中的反应条件及试剂是___________ 。反应⑤中的反应物只有E,则另一种产物的结构简式为___________ 。
(3)写出反应⑥的化学方程式___________ 。
(4)B有多种同分异构体,符合下列条件的同分异构体有___________ 种。
①不含环状结构
②核磁共振氢谱有2个峰
(5)结合上述合成路线,写出以乙醇、丙酮(CH3COCH3)为原料制备2,4,6-庚三醇的合成路线___________ 。(无机试剂任选)

(1)C中官能团的名称为
(2)反应③的反应类型是
(3)写出反应⑥的化学方程式
(4)B有多种同分异构体,符合下列条件的同分异构体有
①不含环状结构
②核磁共振氢谱有2个峰
(5)结合上述合成路线,写出以乙醇、丙酮(CH3COCH3)为原料制备2,4,6-庚三醇的合成路线
【知识点】 有机物的合成 根据题给物质选择合适合成路线解读 有机推断综合考查解读
您最近一年使用:0次
2021-03-15更新
|
680次组卷
|
4卷引用:湖南湘豫名校2021届高三3月联考理综化学试题
湖南湘豫名校2021届高三3月联考理综化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)宁夏海原县第一中学2021届高三第四次模拟考试化学试题宁夏银川一中2020-2021学年高三下学期第二次模拟理综化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、物质结构与性质、认识化学科学、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硅酸盐组成的表示方法 蛋白质的来源及作用 化学科学对人类文明发展的意义 陶瓷 | |
| 2 | 0.85 | 有机反应类型 有机官能团的性质及结构 含碳碳双键物质的性质的推断 | |
| 3 | 0.65 | 氨气的实验室制法 二氧化硫的制备 铁与水蒸气的反应 常见气体的制备与收集 | |
| 4 | 0.65 | 根据原子结构进行元素种类推断 “位构性”关系理解及应用 原子中相关数值及其之间的相互关系 共价键概念及判断 | |
| 5 | 0.65 | 离子反应的发生及书写 离子方程式的正误判断 苯酚的弱酸性 | |
| 6 | 0.65 | 氧化还原反应定义、本质及特征 常见氧化剂与还原剂 | |
| 7 | 0.65 | 影响水电离的因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.4 | 氨气的实验室制法 酸碱中和滴定指示剂选择 常见无机物的制备 物质含量的测定 | 实验探究题 |
| 9 | 0.65 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.65 | 盖斯定律的应用 化学反应速率计算 化学平衡常数的有关计算 原电池电极反应式书写 | 原理综合题 |
| 11 | 0.4 | 等电子原理的应用 利用杂化轨道理论判断化学键杂化类型 配合物的结构与性质 晶胞的有关计算 | 结构与性质 |
| 12 | 0.85 | 有机物的合成 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



