解题方法
1 . 700℃时,向容积为2L的密闭容器中充入一定量的CO(g)和H2O(g),发生反应CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是
 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A.反应在0~t1min内的平均速率为v(H2)=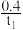 mol·L-1·min-1 mol·L-1·min-1 |
| B.若800℃时该反应的平衡常数为0.64,则逆反应为吸热反应 |
| C.保持其他条件不变,向平衡体系中再通入0.20molH2O(g)和0.40molH2(g),则v正>v逆 |
| D.保持其他条件不变,起始时向容器中充入0.60molCO(g)和1.20molH2O(g),达到平衡时n(CO2)=0.40mol |
您最近一年使用:0次
名校
2 . 利用下列装置能达到相应实验目的的是
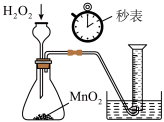 | 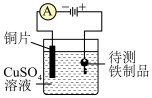 | 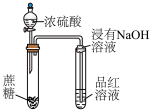 | 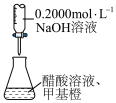 |
| A.测定H2O2催化分解的速率 | B.实现在铁制品表面镀铜 | C.探究浓硫酸的脱水性和强氧化性 | D.用标准NaOH溶液测定醋酸的浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 按要求填空或计算,(1)(2)小题为判断题。
(1)蛋白质溶液中加入饱和的硫酸铵溶液有白色固体析出,这是化学变化。___________ (填“×”或“√”)
(2)合金的熔点一般比成分金属要高,硬度比成分金属要低。___________ (填“×”或“√”)
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出___________ (填“吸水”、“脱水”或“氧化”)性。
(4)Na与水反应,增大水的用量:反应速率___________ (选填“加快”、“减慢”、“不变”)。
(5)某反应的反应物A浓度在5min内由6mol·L-1变成了2mol·L-1,则v(A)=___________ mol·L-1·min-1。
(1)蛋白质溶液中加入饱和的硫酸铵溶液有白色固体析出,这是化学变化。
(2)合金的熔点一般比成分金属要高,硬度比成分金属要低。
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出(4)Na与水反应,增大水的用量:反应速率
(5)某反应的反应物A浓度在5min内由6mol·L-1变成了2mol·L-1,则v(A)=
您最近一年使用:0次
4 . 碳和氮的化合物在生产生活中广泛存在。低碳烃类(甲烷、乙烯、丙烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原 。
。
已知: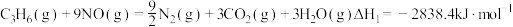
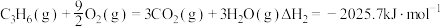
(1)反应
________  ;
;
Ⅱ.甲烷的制备 ,该反应的
,该反应的 与温度的关系如图所示。
与温度的关系如图所示。
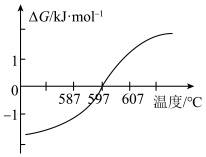
(2)要使该反应能自发进行,理论上温度不高于________ ℃;
(3)在恒温、恒容容器中按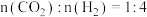 充入反应物进行该反应,下列有关该反应的说法正确的是
充入反应物进行该反应,下列有关该反应的说法正确的是________ ;
a.升高温度会使 的平衡转化率降低
的平衡转化率降低
b. 和
和 的转化率之比不再变化,说明反应达到平衡状态
的转化率之比不再变化,说明反应达到平衡状态
c.若反应达到平衡后,再向容器中充入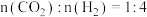 的反应物,则甲烷的体积分数仍保持不变
的反应物,则甲烷的体积分数仍保持不变
Ⅲ.一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应①: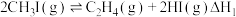
反应②: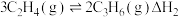
反应①和②在不同温度下的分压平衡常数 如下表,回答下列问题:
如下表,回答下列问题:
(4)根据表中数据推出反应①的活化能 (正)
(正)________ (填“ ”或“
”或“ ”)
”) (逆);
(逆);
(5)反应②的正、逆反应速率表达式有: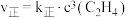 ,
,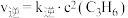 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越________ (填“大”或“小”)。当该反应达到平衡后,升高温度,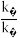 的值
的值________ (填“增大”“减小”或“不变”);
Ⅳ.微生物燃料电池的一种重要应用是废水处理中实现碳氮联合转化为 和
和 ,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
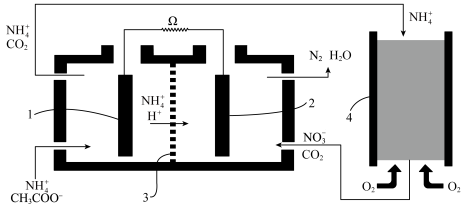
(6)正极的电极反应式是________ ;
(7)协同转化总反应中当有标准状况下 生成时转移电子的个数是
生成时转移电子的个数是________ 。
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原
 。
。已知:
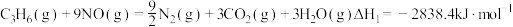
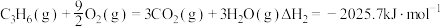
(1)反应

 ;
;Ⅱ.甲烷的制备
 ,该反应的
,该反应的 与温度的关系如图所示。
与温度的关系如图所示。
(2)要使该反应能自发进行,理论上温度不高于
(3)在恒温、恒容容器中按
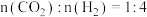 充入反应物进行该反应,下列有关该反应的说法正确的是
充入反应物进行该反应,下列有关该反应的说法正确的是a.升高温度会使
 的平衡转化率降低
的平衡转化率降低b.
 和
和 的转化率之比不再变化,说明反应达到平衡状态
的转化率之比不再变化,说明反应达到平衡状态c.若反应达到平衡后,再向容器中充入
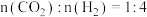 的反应物,则甲烷的体积分数仍保持不变
的反应物,则甲烷的体积分数仍保持不变Ⅲ.一定条件下,碘甲烷
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应①:
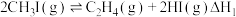
反应②:
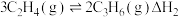
反应①和②在不同温度下的分压平衡常数
 如下表,回答下列问题:
如下表,回答下列问题: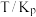 |  |  |  |  |  |  |
| 反应① | 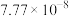 | 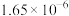 | 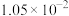 | 2.80 |  | 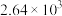 |
| 反应② | 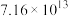 | 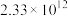 | 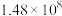 | 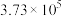 | 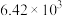 | 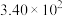 |
(4)根据表中数据推出反应①的活化能
 (正)
(正) ”或“
”或“ ”)
”) (逆);
(逆);(5)反应②的正、逆反应速率表达式有:
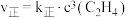 ,
,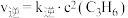 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越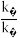 的值
的值Ⅳ.微生物燃料电池的一种重要应用是废水处理中实现碳氮联合转化为
 和
和 ,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
(6)正极的电极反应式是
(7)协同转化总反应中当有标准状况下
 生成时转移电子的个数是
生成时转移电子的个数是
您最近一年使用:0次
名校
解题方法
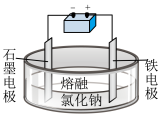
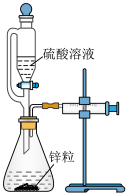
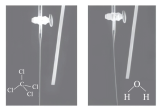
5 . 以下实验目的、方法和相关解释都正确的是
| 选项 | 实验目的 | 实验方法 | 相关解释 |
| A | 电解熔融氯化钠 |
| 该装置阳极反应为2Cl--2e-=Cl2 |
| B | 金属防腐 |
| 该图采用的是外加电流法对铁管道进行保护 |
| C | 测量锌粒和不同浓度的硫酸溶液反应速率的快慢 |
| 该实验用到的实验仪器有恒压滴液漏斗、锥形瓶、双孔塞、注射器 |
| D | 验证分子极性 |
| 该实验是用毛皮摩擦过的橡胶棒靠近 和 和 ,由图中现象可知 ,由图中现象可知 为非极性分子, 为非极性分子, 为极性分子 为极性分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-05更新
|
265次组卷
|
4卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
解题方法
6 . AOPs(高级氧化技术)通过产生·OH(羟基自由基)能有效去除废水中有机污染物。
I.芬顿反应是AOPs中使用最广泛的方法,主要反应过程如下:
i.Fe2+ + H2O2 + H+ =Fe3+ + ·OH + H2O (快反应)
ii.·OH + OM → CO2 + H2O(快反应,OM为有机物)
iii.2Fe3+ + H2O2 =2Fe2+ + O2 + 2H+(慢反应)
反应过程中存在副反应:·OH + Fe2+ + H+ = Fe3+ + H2O。
(1)决定芬顿反应速率的是过程___________ (填“i”“ii”或“iii”)。
(2)·OH氧化苯酚的化学方程式为___________ 。
II.用铁粉代替Fe2+,并加入硼(B),可加快Fe3+转化为Fe2+,提高有机污染物的去除率。
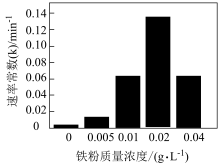
(3)①B与Fe3+反应生成硼酸(H3BO3)的离子方程式为___________ 。
②相同时间内,铁粉投加量与有机污染物去除率的关系如下图所示(k越大,去除效果越好)。铁粉质量浓度大于0.02 g ∙ L−1时,有机污染物去除率下降的原因可能是___________ 。
III.相比于传统的芬顿反应,电芬顿反应具有无需投加H2O2等优点。该方法是利用O2在电极放电生成H2O2,与加入的Fe2+构成芬顿体系,如图1所示。
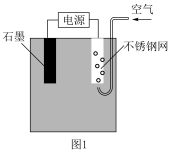
(4)石墨做___________ 极。
(5)溶液pH对H2O2生成量的影响如图2所示。
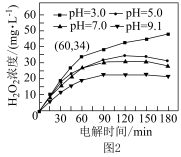
①pH=3,电解时间在0 ~ 60 min内,v(H2O2)=___________ mol·L-1·min-1。
②电解相同时间,随着溶液pH升高,生成的H2O2浓度逐渐减小,结合电极反应式分析原因___________ 。
I.芬顿反应是AOPs中使用最广泛的方法,主要反应过程如下:
i.Fe2+ + H2O2 + H+ =Fe3+ + ·OH + H2O (快反应)
ii.·OH + OM → CO2 + H2O(快反应,OM为有机物)
iii.2Fe3+ + H2O2 =2Fe2+ + O2 + 2H+(慢反应)
反应过程中存在副反应:·OH + Fe2+ + H+ = Fe3+ + H2O。
(1)决定芬顿反应速率的是过程
(2)·OH氧化苯酚的化学方程式为
II.用铁粉代替Fe2+,并加入硼(B),可加快Fe3+转化为Fe2+,提高有机污染物的去除率。
(3)①B与Fe3+反应生成硼酸(H3BO3)的离子方程式为
②相同时间内,铁粉投加量与有机污染物去除率的关系如下图所示(k越大,去除效果越好)。铁粉质量浓度大于0.02 g ∙ L−1时,有机污染物去除率下降的原因可能是

III.相比于传统的芬顿反应,电芬顿反应具有无需投加H2O2等优点。该方法是利用O2在电极放电生成H2O2,与加入的Fe2+构成芬顿体系,如图1所示。

(4)石墨做
(5)溶液pH对H2O2生成量的影响如图2所示。

①pH=3,电解时间在0 ~ 60 min内,v(H2O2)=
②电解相同时间,随着溶液pH升高,生成的H2O2浓度逐渐减小,结合电极反应式分析原因
您最近一年使用:0次
解题方法
7 . 以CO和CO2为原料合成有机物,是科学家研究的主要课题。回答下列问题:
(1) CO2与H2催化重整制备CH3OCH3的过程中存在以下反应:
I. ;
;
Ⅱ. 。
。
已知:相关物质能量变化的示意图如图所示:
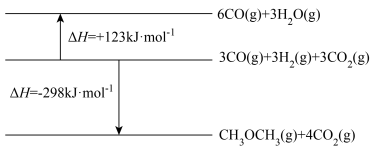
①由已知信息可知
_______  。
。
②向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。
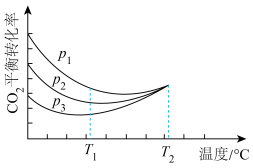
由图2可知, 由大到小的顺序为
由大到小的顺序为_______ , 时主要发生反应为
时主要发生反应为_______ (填“Ⅰ”或“Ⅱ”),平衡转化率随温度变化先降后升的原因是:_______ 。
(2)工业上常用合成气(主要成分为CO、H2)在一定条件下制备甲醇,其涉及反应如下:
反应1: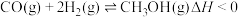
反应2: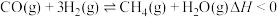
反应3: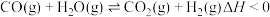
向容积为2L的刚性密闭催化反应器中充入2molCO和4molH2发生上述反应,测得不同温度下,2min内CO的转化率和CH3OH的选择性(CH3OH的选择性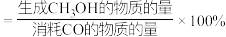 )如图所示。
)如图所示。
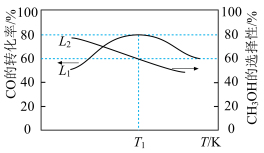
①若反应过程中催化剂的活性几乎不受温度影响,则T1前CO转化率升高的原因是:_______ 。
②反应在T1K下,2min时达到平衡,此时体系压强为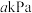 ,
,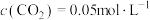 。用CO的分压变化表示的化学反应速率为
。用CO的分压变化表示的化学反应速率为_______  ,反应3的)
,反应3的)
_______ 。( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压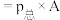 的物质的量分数,以上两空结果均保留3位小数)。
的物质的量分数,以上两空结果均保留3位小数)。
(1) CO2与H2催化重整制备CH3OCH3的过程中存在以下反应:
I.
 ;
;Ⅱ.
 。
。已知:相关物质能量变化的示意图如图所示:

①由已知信息可知

 。
。②向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。

由图2可知,
 由大到小的顺序为
由大到小的顺序为 时主要发生反应为
时主要发生反应为(2)工业上常用合成气(主要成分为CO、H2)在一定条件下制备甲醇,其涉及反应如下:
反应1:
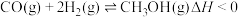
反应2:
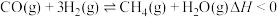
反应3:
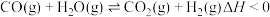
向容积为2L的刚性密闭催化反应器中充入2molCO和4molH2发生上述反应,测得不同温度下,2min内CO的转化率和CH3OH的选择性(CH3OH的选择性
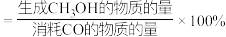 )如图所示。
)如图所示。
①若反应过程中催化剂的活性几乎不受温度影响,则T1前CO转化率升高的原因是:
②反应在T1K下,2min时达到平衡,此时体系压强为
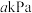 ,
,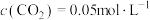 。用CO的分压变化表示的化学反应速率为
。用CO的分压变化表示的化学反应速率为 ,反应3的)
,反应3的)
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压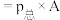 的物质的量分数,以上两空结果均保留3位小数)。
的物质的量分数,以上两空结果均保留3位小数)。
您最近一年使用:0次
解题方法
8 .  是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。
(1)配合物广泛存在于自然界,其中 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为_______ 。
② 的配位原子是
的配位原子是_______ ,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是_______ 。
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.

Ⅱ.

①反应

_______ 。
②不同温度下氨催化氧化的平衡常数如下(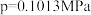 );
);
下列说法正确的是_______ 。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:
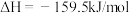
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
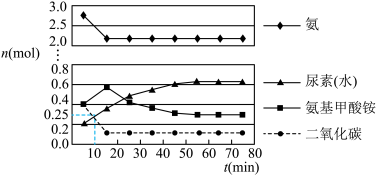
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成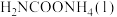 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为_______ 。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是_______ ,第一步反应的平衡常数
_______ (列出算式即可)。
 是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。(1)配合物广泛存在于自然界,其中
 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②
 的配位原子是
的配位原子是(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.


Ⅱ.


①反应


②不同温度下氨催化氧化的平衡常数如下(
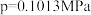 );
);| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( ) ) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( ) ) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.如果对反应不加控制,氨和氧气反应的最终产物主要是

B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:

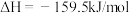
第二步:在体积为5 L的密闭容器中加入1 mol
 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成
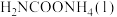 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是

您最近一年使用:0次
9 . Haber法是工业上常使用的合成氨技术,对该技术的改进一直是科学家探索的重要课题,其反应原理为:

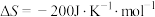 。回答下列问题:
。回答下列问题:
(1)已知:

1molN―H键断裂吸收的能量等于_______ kJ(保留一位小数),合成氨反应在常温(T=298K)下_______ (填“能”或“不能”)自发进行。
(2)将1.00mol 和3.00mol
和3.00mol 充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。

①图甲中反应达到平衡时的平均反应速率
_______ 。
②图乙的平衡体系中A、B、C三点的平衡常数 、
、 、
、 间的大小关系是
间的大小关系是_______ 。
(3)针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成 ,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的
,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的 的物质的量表示)如图所示:
的物质的量表示)如图所示:

①无LiH,催化效率最高的金属是_______ 。
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步: (在M表面解离)
(在M表面解离)
第ⅱ步:
第ⅲ步:_______ 。
(4)工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、_______ 、_______ 。


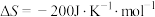 。回答下列问题:
。回答下列问题:(1)已知:

1molN―H键断裂吸收的能量等于
(2)将1.00mol
 和3.00mol
和3.00mol 充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
①图甲中反应达到平衡时的平均反应速率

②图乙的平衡体系中A、B、C三点的平衡常数
 、
、 、
、 间的大小关系是
间的大小关系是(3)针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成
 ,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的
,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的 的物质的量表示)如图所示:
的物质的量表示)如图所示:
①无LiH,催化效率最高的金属是
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步:
 (在M表面解离)
(在M表面解离)第ⅱ步:

第ⅲ步:
(4)工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、
您最近一年使用:0次
10 . 酚类化合物在医疗、环保、工业等方面有着广泛的用途。
(1)苯酚可用于外科器械消毒、皮肤杀菌与止痒,可通过磺化法制备。该工艺具体流程如下:
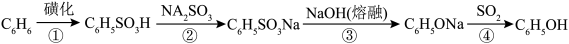
反应③的化学方程式为___________ 。
(2)石油加工、造纸等企业易产生含有苯酚的工业废水,可通过O3-H2O2氧化法进行处理,其原理为C6H5OH+H2O2+O3→CO2+H2O(非可逆反应,反应未配平)。在T1℃和T2℃时,分别向含有苯酚的水样中加入等量的30%H2O2溶液,再以相同的流速向水样中通入O3,测得水样中苯酚的含量随时间变化的曲线如图所示。
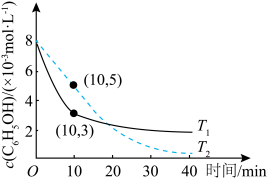
①在T1℃时,0~10min内,C6H5OH的平均反应速率为___________ 。
②请判断T1和T2的大小:T1___________ (填“>”“<”或“=”)T2,T1℃时对工业废水中苯酚的去除率低于T2℃时的原因可能是___________ (写一种即可)。
(3)利用FeCl3溶液与苯酚的显色反应,可定性检测工业废水中的苯酚,其反应原理为Fe3++6C6H5OH [Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
[Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
(4)邻苯二酚钠类配体(L)与金属离子(M)形成的配合物可应用于医药、水处理等领域。其溶液中存在平衡:
M+L ML K1
ML K1
ML+L ML2 K2
ML2 K2
某研究小组配制了M与L起始浓度比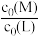 不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
测得平衡时L、ML、ML2的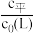 与
与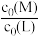 的变化关系如图所示。
的变化关系如图所示。
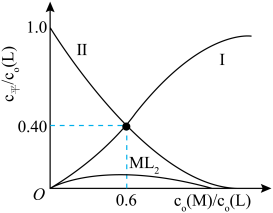
①表示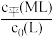 与
与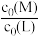 变化关系的曲线为
变化关系的曲线为___________ (填“Ⅰ”或“Ⅱ”)。
②当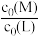 =0.6时,c平(ML2)=
=0.6时,c平(ML2)=___________ ,K1=___________ 。
(1)苯酚可用于外科器械消毒、皮肤杀菌与止痒,可通过磺化法制备。该工艺具体流程如下:
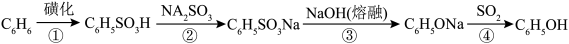
反应③的化学方程式为
(2)石油加工、造纸等企业易产生含有苯酚的工业废水,可通过O3-H2O2氧化法进行处理,其原理为C6H5OH+H2O2+O3→CO2+H2O(非可逆反应,反应未配平)。在T1℃和T2℃时,分别向含有苯酚的水样中加入等量的30%H2O2溶液,再以相同的流速向水样中通入O3,测得水样中苯酚的含量随时间变化的曲线如图所示。

①在T1℃时,0~10min内,C6H5OH的平均反应速率为
②请判断T1和T2的大小:T1
(3)利用FeCl3溶液与苯酚的显色反应,可定性检测工业废水中的苯酚,其反应原理为Fe3++6C6H5OH
 [Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
[Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。| A.加水稀释,溶液pH减小 |
B.滴入几滴浓盐酸,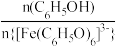 增大 增大 |
| C.加入少量NaOH固体,反应平衡常数增大 |
| D.加入少量Cu粉,溶液紫色变浅 |
(4)邻苯二酚钠类配体(L)与金属离子(M)形成的配合物可应用于医药、水处理等领域。其溶液中存在平衡:
M+L
 ML K1
ML K1ML+L
 ML2 K2
ML2 K2某研究小组配制了M与L起始浓度比
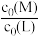 不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。测得平衡时L、ML、ML2的
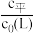 与
与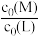 的变化关系如图所示。
的变化关系如图所示。
①表示
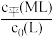 与
与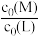 变化关系的曲线为
变化关系的曲线为②当
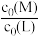 =0.6时,c平(ML2)=
=0.6时,c平(ML2)=
您最近一年使用:0次