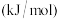1 . 将CO或CO2转化为高附加值化学品是颇具前景的合成路线。
(1)工业上用CO2和H2反应合成二甲醚。
已知:
 ;
;

 。
。
写出 和
和 转化为
转化为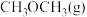 和
和 的热化学方程式:
的热化学方程式:_______________ ,该反应在________ (填“高温”或“低温”)条件下能自发进行。
(2)CO2催化加氢合成乙醇的反应原理为
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。________________ 。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为________ (填化学式)。
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为 、
、 。
。
在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。________________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:________________ (任答两点)。
(4)一定条件下,利用CO2和H2还可制得甲烷: ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
①用单位时间内气体分压的变化表示反应 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
________ 。
②该温度下,平衡时CO的体积分数为8%,反应 的平衡常数
的平衡常数
________ ( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为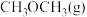 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。

②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
名校
2 . 苯甲醛(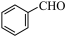 )是生产氨苄青霉素、某些苯胺染料等产品的重要中间体。制备苯甲醛的常用方法有气相催化氧化法和电催化氧化法。
)是生产氨苄青霉素、某些苯胺染料等产品的重要中间体。制备苯甲醛的常用方法有气相催化氧化法和电催化氧化法。
I.气相催化氧化法(以Ce/ZSM-5为催化剂)主要反应: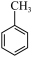 (g)+O2(g)
(g)+O2(g)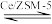
 (g)+H2O(g) ΔH
(g)+H2O(g) ΔH
①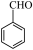 (g)+ 8O2(g)=7CO2(g)+3H2O(g) ΔH=-3452.6kJ/mol
(g)+ 8O2(g)=7CO2(g)+3H2O(g) ΔH=-3452.6kJ/mol
② (g)+9O2(g)= 7CO2(g)+4H2O(g) ΔH=-3784.9kJ/mol
(g)+9O2(g)= 7CO2(g)+4H2O(g) ΔH=-3784.9kJ/mol
则反应 (g)+ O2(g)
(g)+ O2(g)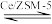
 (g) +H2O(g) ΔH=
(g) +H2O(g) ΔH=
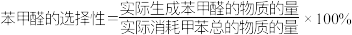



(3)其他条件相同、不同空速下测得苯甲醛的选择性和收率如图所示。
已知:①空缝指鼓入空气的速度,单位为h-1;
②苯甲醛只有吸附在催化剂表面才能被进一步氧化为苯甲酸。
据以上信息,分析空缝由1000h-1增大至2500h-1过程中苯甲醛选择性增加的原因:
(4)合成苯甲醛的最佳温度和空速应为___________(填序号)。
| A.350℃、5000h-1 | B.350℃、2500h-1 |
| C.410℃、5000h-1 | D.410℃、2500h-1 |
II.电催化氧化法
以硫酸酸化的MnSO4溶液作为电解媒质间接氧化甲苯制备苯甲醛的工艺方案如图所示:
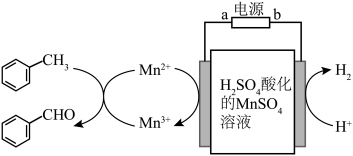
 。
。
您最近一年使用:0次
名校
解题方法
3 .  催化加氢有利于实现碳的循环利用,在催化剂的作用下可发生如下反应:
催化加氢有利于实现碳的循环利用,在催化剂的作用下可发生如下反应:
① ;
;
② ;
;
③ 。
。
回答下列问题:
(1)已知相关化学键键能如表所示:
根据表中键能数据计算出
_______  (用字母表示)。
(用字母表示)。
(2)已知反应③的速率方程为 、
、 ,其中
,其中 、
、 分别为正、逆反应的速率常数。
分别为正、逆反应的速率常数。
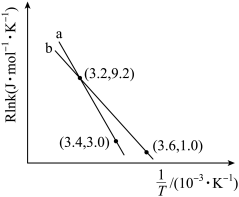
①如图所示(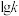 表示速率常数的对数,
表示速率常数的对数, 表示温度的倒数)
表示温度的倒数) 、
、 、
、 、
、 四条斜线中有两条分别表示
四条斜线中有两条分别表示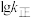 、
、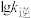 随
随 的变化关系曲线,其中能表示
的变化关系曲线,其中能表示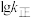 随
随 变化关系的是斜线
变化关系的是斜线_______ (填图中字母)。 减小的是
减小的是_______ (填选项字母)。
A.减小压强 B.减小温度 C.减小 的浓度 D.更换成负催化剂
的浓度 D.更换成负催化剂
(3)在 恒温恒容有某催化剂的密闭容器中充入
恒温恒容有某催化剂的密闭容器中充入 和
和 ,发生上述三个反应。该温度下反应均达平衡时,测得
,发生上述三个反应。该温度下反应均达平衡时,测得 为
为 、
、 为
为 、
、 为
为 ,则
,则 的选择性为
的选择性为
_______ ( 选择性=
选择性= );反应②的平衡常数为
);反应②的平衡常数为_______ (列出计算式即可)。
(4)若测得上述三个反应在不同温度下 的平衡转化率和甲醇的选择性如图所示:
的平衡转化率和甲醇的选择性如图所示:_______ (填选项字母)。
A.400℃ B.600℃ C.800℃ D.1000℃
高于800℃时, 转化率增大的主要原因是
转化率增大的主要原因是_______ 。
 催化加氢有利于实现碳的循环利用,在催化剂的作用下可发生如下反应:
催化加氢有利于实现碳的循环利用,在催化剂的作用下可发生如下反应:①
 ;
;②
 ;
;③
 。
。回答下列问题:
(1)已知相关化学键键能如表所示:
化学键 |
|
|
|
|
|
键能 | a | b | c | d | e |

 (用字母表示)。
(用字母表示)。(2)已知反应③的速率方程为
 、
、 ,其中
,其中 、
、 分别为正、逆反应的速率常数。
分别为正、逆反应的速率常数。①如图所示(
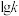 表示速率常数的对数,
表示速率常数的对数, 表示温度的倒数)
表示温度的倒数) 、
、 、
、 、
、 四条斜线中有两条分别表示
四条斜线中有两条分别表示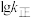 、
、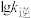 随
随 的变化关系曲线,其中能表示
的变化关系曲线,其中能表示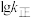 随
随 变化关系的是斜线
变化关系的是斜线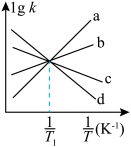
 减小的是
减小的是A.减小压强 B.减小温度 C.减小
 的浓度 D.更换成负催化剂
的浓度 D.更换成负催化剂(3)在
 恒温恒容有某催化剂的密闭容器中充入
恒温恒容有某催化剂的密闭容器中充入 和
和 ,发生上述三个反应。该温度下反应均达平衡时,测得
,发生上述三个反应。该温度下反应均达平衡时,测得 为
为 、
、 为
为 、
、 为
为 ,则
,则 的选择性为
的选择性为
 选择性=
选择性= );反应②的平衡常数为
);反应②的平衡常数为(4)若测得上述三个反应在不同温度下
 的平衡转化率和甲醇的选择性如图所示:
的平衡转化率和甲醇的选择性如图所示:
A.400℃ B.600℃ C.800℃ D.1000℃
高于800℃时,
 转化率增大的主要原因是
转化率增大的主要原因是
您最近一年使用:0次
名校
4 . 丙烯是重要的化工原料,广泛用于合成聚丙烯、丙烯醛等工业领域。回答下列问题:
(1)丙烷无氧脱氢法制备丙烯的反应为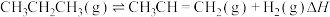 。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓(
。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓( );最稳定的单质的标准摩尔生成焓为零。
);最稳定的单质的标准摩尔生成焓为零。
已知:部分物质的标准摩尔生成焓数据如表:
则上述反应的
______  。
。
(2)T1℃时,将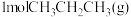 充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:
充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:
①已知: 。
。 内,用H2的分压变化表示上述脱氢反应的平均速率为
内,用H2的分压变化表示上述脱氢反应的平均速率为______  。
。
②T1℃时,反应的平衡常数
______  。
。 随反应温度升高而
随反应温度升高而______ (填“增大”“减小”或“不变”)。
(3)丙烷在有氧气参与的条件下也可以发生脱氢反应: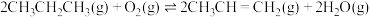 。下列说法正确的是______(填序号)。
。下列说法正确的是______(填序号)。
(4)甲醇催化也可以制取丙烯,其反应为
①该反应的阿伦尼乌斯经验公式的实验数据如图中直线a所示,已知阿伦尼乌斯经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能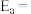
______  。
。______ (填序号)。
a.升高温度 b.增大压强 c.增大
(1)丙烷无氧脱氢法制备丙烯的反应为
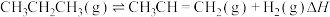 。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓(
。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓( );最稳定的单质的标准摩尔生成焓为零。
);最稳定的单质的标准摩尔生成焓为零。已知:部分物质的标准摩尔生成焓数据如表:
| 物质 | CH3CH2CH3(g | )CH3CH=CH2(g) |
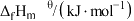 | -104 | 19.8 |

 。
。(2)T1℃时,将
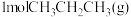 充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:
充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 136 | 163 | 178 | 180 | 180 | 180 |
 。
。 内,用H2的分压变化表示上述脱氢反应的平均速率为
内,用H2的分压变化表示上述脱氢反应的平均速率为 。
。②T1℃时,反应的平衡常数

 。
。 随反应温度升高而
随反应温度升高而(3)丙烷在有氧气参与的条件下也可以发生脱氢反应:
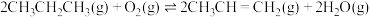 。下列说法正确的是______(填序号)。
。下列说法正确的是______(填序号)。| A.相对于丙烷直接催化脱氢法,有氧气催化脱氢,反应更容易进行 |
| B.相同条件下,氢气、丙烯、丙烷三种气体中,还原性最强的是氢气 |
| C.恒温恒容条件下,当混合气体的密度不再随时间改变时,说明反应达到限度 |
| D.通入更多的氧气,有利于提高丙烷转化率,提高丙烯的产率 |

①该反应的阿伦尼乌斯经验公式的实验数据如图中直线a所示,已知阿伦尼乌斯经验公式为
 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能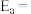
 。
。
a.升高温度 b.增大压强 c.增大

您最近一年使用:0次
名校
解题方法
5 . 汞及其化合物在催化、科学研究等方面具有重要应用。
(1)HgO可作为光催化剂降解有机染料污染物(如罗丹明B,以下简称B)。
①在三组100mL12mg•L-1的B溶液中分别加入0.075gHgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度c0的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是___________ 。___________ mg•L-1•min-1。
(2)乙炔(HC≡CH)能在汞盐溶液催化下与水反应生成CH3CHO,反应历程及相对能垒如下图所示。___________ (用相对能量E表示)。
②下列说法正确的是___________ 。
A.本反应历程涉及的物质中,CH2=CHOH最不稳定
B.过程①中,Hg2+的空轨道接受水分子中氧原子的孤对电子
C.该反应历程中,存在非极性键的断裂和形成
D.增大压强和乙炔的浓度均能加快反应速率,并且增大乙炔的平衡转化率
(3)常温下,Hg2+与Cl-的配合物存在如下平衡:HgCl
 HgCl
HgCl
 HgCl2
HgCl2 HgCl+
HgCl+ Hg2+,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:
Hg2+,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示: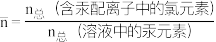
①图中能代表HgCl2曲线是___________ (填字母),平衡常数K4=___________ 。
②在P点,溶液中c(HgCl2):c(Hg2+)=___________ (写出计算过程)。
(1)HgO可作为光催化剂降解有机染料污染物(如罗丹明B,以下简称B)。
①在三组100mL12mg•L-1的B溶液中分别加入0.075gHgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度c0的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是

(2)乙炔(HC≡CH)能在汞盐溶液催化下与水反应生成CH3CHO,反应历程及相对能垒如下图所示。
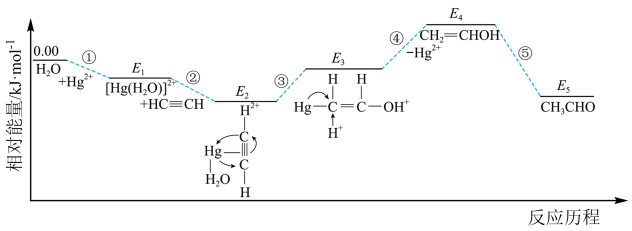
②下列说法正确的是
A.本反应历程涉及的物质中,CH2=CHOH最不稳定
B.过程①中,Hg2+的空轨道接受水分子中氧原子的孤对电子
C.该反应历程中,存在非极性键的断裂和形成
D.增大压强和乙炔的浓度均能加快反应速率,并且增大乙炔的平衡转化率
(3)常温下,Hg2+与Cl-的配合物存在如下平衡:HgCl

 HgCl
HgCl
 HgCl2
HgCl2 HgCl+
HgCl+ Hg2+,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:
Hg2+,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:
①图中能代表HgCl2曲线是
②在P点,溶液中c(HgCl2):c(Hg2+)=
您最近一年使用:0次
解题方法
6 . 研究含碳和含氮物质的反应对生产、生活、科研等方面具有重要的意义。回答下列问题:
(1)已知:
ⅰ.
 kJ⋅mol
kJ⋅mol
ⅱ.
 kJ⋅mol
kJ⋅mol
ⅲ.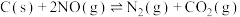
 kJ⋅mol
kJ⋅mol
则 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)在保持T ℃、100 kPa条件下,向反应器中充入2 mol NO和1 mol 发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入
发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入___________ mol Ar作为稀释气(计算时不考虑其他反应)。
(3)一定条件下,向起始压强为90 kPa的2 L恒容密闭容器中通入2 mol NO和1 mol 的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,
的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,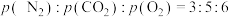 (p为气体分压,单位为kPa)。
(p为气体分压,单位为kPa)。
① 的平均反应速率
的平均反应速率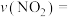
___________ mol⋅L ⋅min
⋅min 。
。
②下列说法正确的是___________ 。
A.将炭块粉碎可加快反应速率
B.平衡时充入Ar,反应ⅰ正向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡状态
③反应ⅰ的相对压力平衡常数
___________ [已知: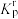 表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以
表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以 (
( kPa)]。
kPa)]。
(4)某科研小组以耐高温催化剂催化NO转化为 ,测得NO转化为
,测得NO转化为 的转化率随温度变化情况如图所示。则加入CO后,NO转化为
的转化率随温度变化情况如图所示。则加入CO后,NO转化为 的转化率增大的原因是
的转化率增大的原因是___________ 。
(1)已知:
ⅰ.

 kJ⋅mol
kJ⋅mol
ⅱ.

 kJ⋅mol
kJ⋅mol
ⅲ.
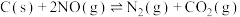
 kJ⋅mol
kJ⋅mol
则
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)在保持T ℃、100 kPa条件下,向反应器中充入2 mol NO和1 mol
 发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入
发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入(3)一定条件下,向起始压强为90 kPa的2 L恒容密闭容器中通入2 mol NO和1 mol
 的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,
的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,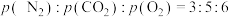 (p为气体分压,单位为kPa)。
(p为气体分压,单位为kPa)。①
 的平均反应速率
的平均反应速率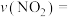
 ⋅min
⋅min 。
。②下列说法正确的是
A.将炭块粉碎可加快反应速率
B.平衡时充入Ar,反应ⅰ正向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡状态
③反应ⅰ的相对压力平衡常数

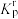 表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以
表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以 (
( kPa)]。
kPa)]。(4)某科研小组以耐高温催化剂催化NO转化为
 ,测得NO转化为
,测得NO转化为 的转化率随温度变化情况如图所示。则加入CO后,NO转化为
的转化率随温度变化情况如图所示。则加入CO后,NO转化为 的转化率增大的原因是
的转化率增大的原因是
您最近一年使用:0次
7 . 甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:
反应I:

反应II:

已知:①平衡状态下,甲醛选择性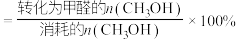 ;甲醛的收率
;甲醛的收率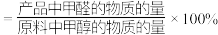 。
。
②几种物质的燃烧热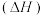 如下表:
如下表:
回答下列问题:
(1)
_______ ,HCHO的空间结构为_______ 形。
(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii: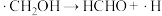
历程iii:
历程iv: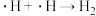
写出历程i的反应方程式:_______ 。
(3)将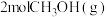 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下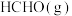 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示:_______ (填“I”或“II”),判断的依据是_______ 。
② ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为_______ ,
_______ ,反应I的平衡常数
_______  。
。
反应I:


反应II:


已知:①平衡状态下,甲醛选择性
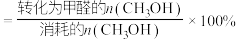 ;甲醛的收率
;甲醛的收率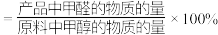 。
。②几种物质的燃烧热
 如下表:
如下表:| 物质 |  |  |  |  |
燃烧热 | -725.8 | -563.6 | -283.0 | -285.8 |
(1)

(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii:
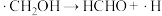
历程iii:

历程iv:
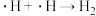
写出历程i的反应方程式:
(3)将
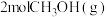 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示: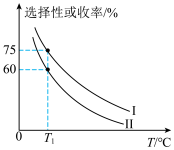
②
 ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为

 。
。
您最近一年使用:0次
7日内更新
|
194次组卷
|
3卷引用:2024届河南省周口市高三5月全真模拟理科综合试题-高中化学
解题方法
8 . 利用 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。
Ⅰ.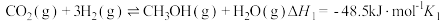
Ⅱ.
回答下列问题:
(1)已知反应Ⅲ的平衡常数 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式___________ 。
(2)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是___________ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是___________ 。
②生成 的最佳条件是
的最佳条件是___________ (填标号)。


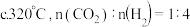

(3)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为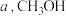 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数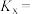
___________ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)向压强恒为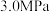 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气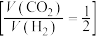 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是___________ 。
② 时,
时, 的平均反应速率
的平均反应速率
___________  。
。
③反应Ⅰ的速率方程可表示为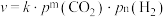 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,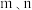 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则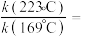
___________ 。
 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。Ⅰ.
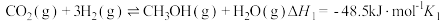
Ⅱ.

回答下列问题:
(1)已知反应Ⅲ的平衡常数
 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式(2)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。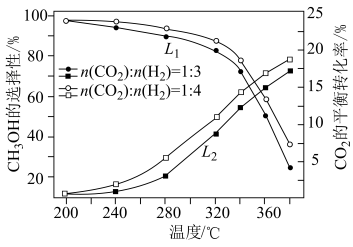
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是


(3)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为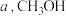 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数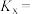
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)向压强恒为
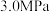 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气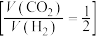 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是②
 时,
时, 的平均反应速率
的平均反应速率
 。
。③反应Ⅰ的速率方程可表示为
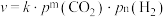 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,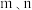 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则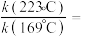
您最近一年使用:0次
9 . 氮氧化物( 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。
(1)反应 分为三步基元反应完成。
分为三步基元反应完成。
第一步: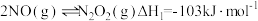 决速步骤)
决速步骤)
第二步: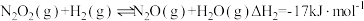
①活化能最高的是第___________ 步。
②为了提高总反应中NO的反应速率和转化率可采用的措施为___________ (写两条)。
(2)已知反应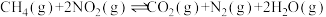 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入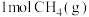 和
和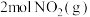 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
①用 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为___________ 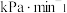 。
。
②该温度下的压强平衡常数
___________ kPa。
(3)NO催化分解ICl制取 和
和 的原理为:
的原理为:
反应I: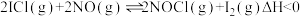 ;
;
反应Ⅱ: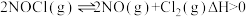 ;
; 。
。
反应的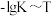 的关系如图所示。
的关系如图所示。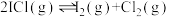 的
的
___________
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。 的电极反应式为
的电极反应式为___________ 。
②当电解电压为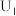 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。(1)反应
 分为三步基元反应完成。
分为三步基元反应完成。第一步:
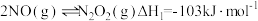 决速步骤)
决速步骤)第二步:
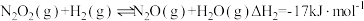
①活化能最高的是第
②为了提高总反应中NO的反应速率和转化率可采用的措施为
(2)已知反应
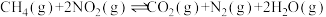 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入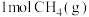 和
和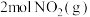 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
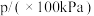 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为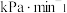 。
。②该温度下的压强平衡常数

(3)NO催化分解ICl制取
 和
和 的原理为:
的原理为:反应I:
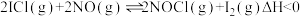 ;
;
反应Ⅱ:
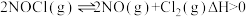 ;
; 。
。反应的
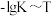 的关系如图所示。
的关系如图所示。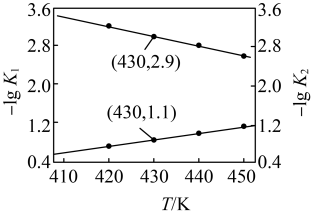
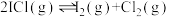 的
的
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为
 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
 的电极反应式为
的电极反应式为②当电解电压为
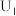 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
10 . 研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
 .回答下列问题。
.回答下列问题。
(1)汽车在行驶过程中有如下反应发生:

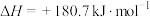

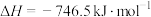
写出表示CO燃烧热的热化学方程式为___________ 。
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(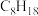 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为___________ (保留三位有效数字)。若实际空燃比大于此值,则该汽车尾气的主要污染物为___________ 。
(3)在汽车上安装三元催化转化器可实现反应:
 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
该反应在1~4s内的平均反应速率为
___________ 。反应达平衡时压强为100kPa,求压强平衡常数
___________  。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出): 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
(4)研究表明,合成氨的速率与相关物质的浓度关系为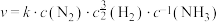 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。
(5)实际工业生产中,原料气中 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)___________ 。
(6)在氨气催化氧化制硝酸过程中,发现 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
① (快)
(快) 
② (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是___________ 。
 .回答下列问题。
.回答下列问题。(1)汽车在行驶过程中有如下反应发生:

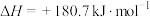

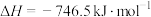
写出表示CO燃烧热的热化学方程式为
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(
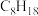 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为(3)在汽车上安装三元催化转化器可实现反应:

 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
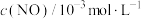 | 1.50 | 1.15 | 0.75 | 0.62 | 0.55 | 0.50 | 0.50 |
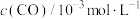 | 3.00 | 2.65 | 2.25 | 2.12 | 2.05 | 2.00 | 2.00 |


 。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)  .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):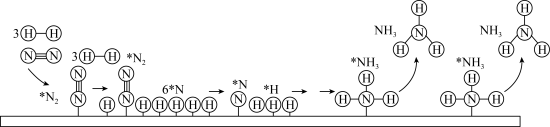
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。(4)研究表明,合成氨的速率与相关物质的浓度关系为
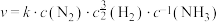 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。| A.合成氨的反应在任意温度下都能自发进行 |
B.增大 、 、 或 或 的浓度都能提高合成氨速率 的浓度都能提高合成氨速率 |
| C.若反应气中混有水蒸气,Fe催化剂可能中毒 |
| D.使用催化剂可提高单位时间内原料气的转化率 |
 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)(6)在氨气催化氧化制硝酸过程中,发现
 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:①
 (快)
(快) 
②
 (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是
您最近一年使用:0次