解题方法
1 . 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)实验计时方法是从溶液混合开始记时,至___________ 时记时结束。
(2)V1=___________ ,V2=___________ ;设计实验Ⅰ、Ⅲ的目的是探究___________ 对反应速率的影响。
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=___________ 。
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①___________ 不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ 。
| 实验编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
| Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
| Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始记时,至
(2)V1=
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是
您最近一年使用:0次
名校
解题方法
2 . 硫和氮是生物必需的营养元素,含硫和氮的化合物在自然界中广泛存在。
(1)火山喷发产生 在大气中发生如下反应:
在大气中发生如下反应:
①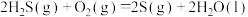 ;
;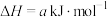
② ;
;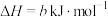
写出 燃烧的热化学方程式:
燃烧的热化学方程式:______ 。
(2)工业上可用NaClO碱性溶液吸收 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对
作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对 的吸收。该催化过程的示意图如图所示。
的吸收。该催化过程的示意图如图所示。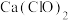 也可用于脱硫,原因是
也可用于脱硫,原因是______ 。 和NO。已知:
和NO。已知: 是一种弱酸。
是一种弱酸。______ 。
②若无能量损失,相同条件下, 和NO的体积比为
和NO的体积比为______ 时,两种气体都能被完全处理。
(4)在起始温度为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入1mol 和4mol
和4mol  ,发生反应
,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,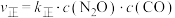 ,
,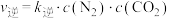 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。______ 。
②T℃时
______ 。
(5)太阳能光电催化-化学耦合分解 的装置如图所示.该太阳能光电催化—化学耦合分解
的装置如图所示.该太阳能光电催化—化学耦合分解 的过程可描述为
的过程可描述为______ 。
(1)火山喷发产生
 在大气中发生如下反应:
在大气中发生如下反应:①
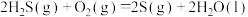 ;
;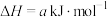
②
 ;
;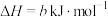
写出
 燃烧的热化学方程式:
燃烧的热化学方程式:(2)工业上可用NaClO碱性溶液吸收
 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对
作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对 的吸收。该催化过程的示意图如图所示。
的吸收。该催化过程的示意图如图所示。 也可用于脱硫,原因是
也可用于脱硫,原因是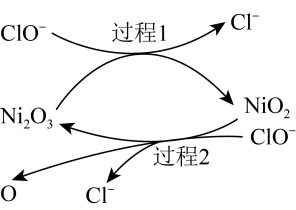
 和NO。已知:
和NO。已知: 是一种弱酸。
是一种弱酸。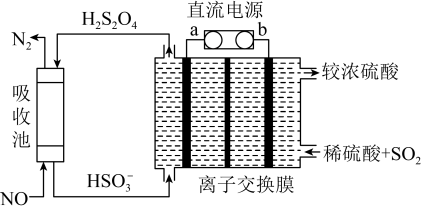
②若无能量损失,相同条件下,
 和NO的体积比为
和NO的体积比为(4)在起始温度为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入1mol
 和4mol
和4mol  ,发生反应
,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,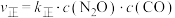 ,
,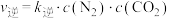 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
②T℃时

(5)太阳能光电催化-化学耦合分解
 的装置如图所示.该太阳能光电催化—化学耦合分解
的装置如图所示.该太阳能光电催化—化学耦合分解 的过程可描述为
的过程可描述为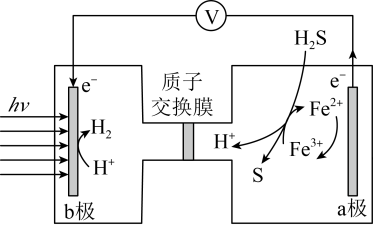
您最近一年使用:0次
解题方法
3 . 含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为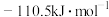 、
、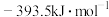 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为___________ 。
(2) 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为___________ 。
(3)汽车尾气中的 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
(4) 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: 、
、 表示,则
表示,则
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的v(逆)___________ z点对应的v(正)。
③若w点的时间为5min,则 的平均反应速率为
的平均反应速率为___________  。此温度下的化学平衡常数为
。此温度下的化学平衡常数为___________ 。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成
 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为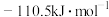 、
、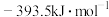 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为(2)
 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示: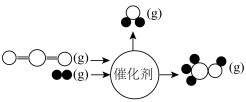
| 化学键 |
|
|
|
|
|
键能/( ) ) | 438 | 326 | 802 | 464 | 414 |
(3)汽车尾气中的
 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。A.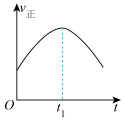 | B.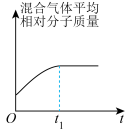 |
C.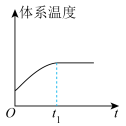 | D. |
 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: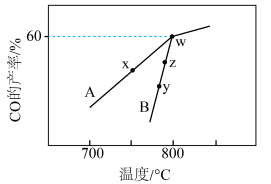
 、
、 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的v(逆)
③若w点的时间为5min,则
 的平均反应速率为
的平均反应速率为 。此温度下的化学平衡常数为
。此温度下的化学平衡常数为
您最近一年使用:0次
4 . 根据要求,回答下列问题:
(1)为比较 、
、 对
对 分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察
分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察______ (填实验现象),即可得出 、
、 的催化效果的差异。有同学提出将
的催化效果的差异。有同学提出将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是______  和
和 (草酸)反应速率的影响,设计实验方案如下:
(草酸)反应速率的影响,设计实验方案如下:
上述反应的离子方程式为______ ,该实验是探究______ 对反应速率的影响。
(3)工业制硫酸的反应之一为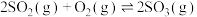 ,在2L恒温恒容密闭容器中投入2mol
,在2L恒温恒容密闭容器中投入2mol 和1mol
和1mol 在一定条件下充分反应,下图是
在一定条件下充分反应,下图是 和
和 随时间的变化曲线。
随时间的变化曲线。 的平均反应速率为
的平均反应速率为______ 。
(2)A点的
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)为比较
 、
、 对
对 分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察
分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察 、
、 的催化效果的差异。有同学提出将
的催化效果的差异。有同学提出将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是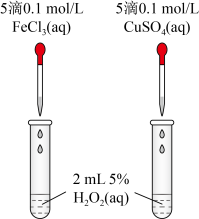
 和
和 (草酸)反应速率的影响,设计实验方案如下:
(草酸)反应速率的影响,设计实验方案如下:实验序号 | 草酸溶液 | 酸性高锰酸钾溶液 |
① |
|
|
② |
|
|
(3)工业制硫酸的反应之一为
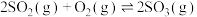 ,在2L恒温恒容密闭容器中投入2mol
,在2L恒温恒容密闭容器中投入2mol 和1mol
和1mol 在一定条件下充分反应,下图是
在一定条件下充分反应,下图是 和
和 随时间的变化曲线。
随时间的变化曲线。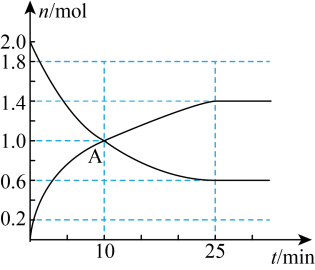
 的平均反应速率为
的平均反应速率为(2)A点的

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
名校
5 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应: ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。
①试判断
_______  (填写“>”“=”或“<”)
(填写“>”“=”或“<”)
②一定温度下,在 密闭容器中充入
密闭容器中充入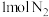 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的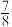 ,则
,则 的转化率
的转化率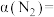
_______ ,以 表示该过程的反应速率
表示该过程的反应速率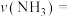
_______ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
I. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为_______ 。
②结合反应过程中能量变化示意图,下列说法正确的是_______ (填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极, 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。
①写出 去除氨气的化学反应方程式
去除氨气的化学反应方程式_______ 。
②阴极区加入 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用_______ 。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。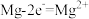 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______ 。
(1)在固定体积的密闭容器中,进行如下化学反应:
 ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 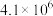 |  |  |

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②一定温度下,在
 密闭容器中充入
密闭容器中充入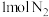 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的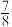 ,则
,则 的转化率
的转化率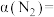
 表示该过程的反应速率
表示该过程的反应速率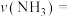
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:I.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为②结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,
 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。①写出
 去除氨气的化学反应方程式
去除氨气的化学反应方程式②阴极区加入
 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用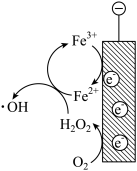
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。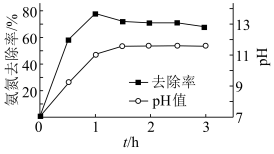
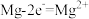 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:④反应1h以后,氨氮去除率随时间的延长反而下降的原因是
您最近一年使用:0次
6 . 某科研团队利用 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为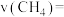
_______ ,此时的化学平衡常数 为
为_______ (保留两位小数),若在此温度下时向A容器的平衡体系中再充入 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②a点时该反应的平衡常数为 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为_______ 。
(2)对于反应③: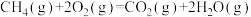 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。如果d点已经达到平衡状态,则e点的
____  逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是____ 。
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol
 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。
 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为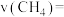
 为
为 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②a点时该反应的平衡常数为
 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为
(2)对于反应③:
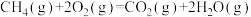 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。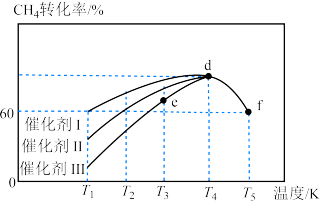

 逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是
您最近一年使用:0次
解题方法
7 . 甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =_______ 。
(2)若在绝热恒容 的容器内进行反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g),初始加入2mol CH3OH和3mol O2下列不能 表示该反应达到平衡状态的有__________ (填字母序号)。
A.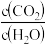 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化
C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变_______ ,初始压强为P,该反应的压强平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)_____ v(逆)(填“>”、“<”或“=”);
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为______ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)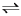 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =
(2)若在
A.
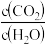 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)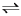 H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为
您最近一年使用:0次
8 . 某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,KIO3和Na2SO3可发生反应生成I2,生成的I2可用淀粉溶液检验,根据出现蓝色的时间来衡量该反应的速率。
回答下列问题:
(1)实验①③中V1=_______ ,V2=_______ 。
(2)出现蓝色的时间t1与t3大到小关系_______ 。
(3)实验②③的目的是_______ 。
(4)实验中加水的目的是_______ 。
(5)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.02 mol·L-1,则5 s内消耗Na2SO3的平均速率v(Na2SO3)=_______ 。
| 实验序号 | 0.1 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.1 mol·L-1Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 5 | t1 |
| ② | 5 | 5 | 30 | 25 | t2 |
| ③ | 5 | V2 | 20 | 25 | t3 |
(1)实验①③中V1=
(2)出现蓝色的时间t1与t3大到小关系
(3)实验②③的目的是
(4)实验中加水的目的是
(5)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.02 mol·L-1,则5 s内消耗Na2SO3的平均速率v(Na2SO3)=
您最近一年使用:0次
9 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子( ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=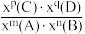 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。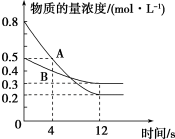
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=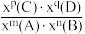 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
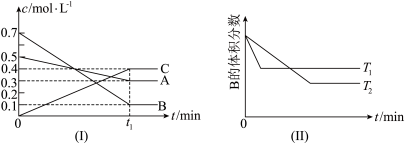
10 . I.T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如(Ⅱ)所示:
(1)反应的化学方程式为___________ 。
(2)当反应达到平衡后升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___________ (填“变大”、“变小”或“不变”)。
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(3)一般说化学平衡常数数值K___________ ,通常认为该反应进行较完全。
(4)该反应为___________ 反应(填“吸热”或“放热”)。
(5)能判断该反应是否达到化学平衡状态的依据是___________。
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为___________ 。
(1)反应的化学方程式为
(2)当反应达到平衡后升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)一般说化学平衡常数数值K
(4)该反应为
(5)能判断该反应是否达到化学平衡状态的依据是___________。
| A.v正(H2) = v逆(H2O) | B.反应停止,正、逆反应速率都等于零 |
| C.容器中压强不再发生变化 | D.混合气体中c(CO2)不变 |
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为
您最近一年使用:0次





 、20mL
、20mL 、30mL
、30mL 、20mL
、20mL

