解题方法
1 . 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是| 容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A.容器Ⅰ中发生反应的平衡常数为0.8 | B.容器Ⅱ中发生反应的起始阶段有v正>v逆 |
C.达到平衡时,容器Ⅲ中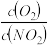 >1 >1 | D.达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17 |
您最近一年使用:0次
2018-05-16更新
|
638次组卷
|
4卷引用:【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题
【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题09 反应速率、化学平衡(已下线)高考母题题源07 化学反应速率与化学平衡2020届高三化学二轮冲刺新题专练——化学平衡状态及其判断(提升练)
名校
解题方法
2 . 锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。
(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______ (填标号)。
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00ml。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
(5)用氢气还原GeO2可制得金属锗。其反应如下:
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________ ℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
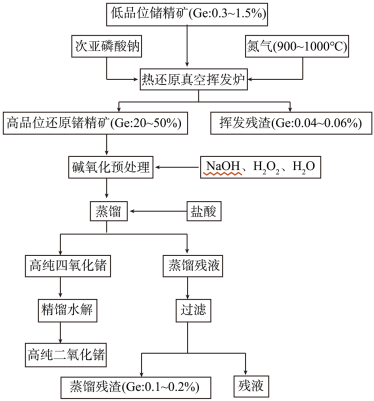
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________ 加剧所致。
(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00ml。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是
②此样品中二氧化锗含量是
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时
您最近一年使用:0次
2018-03-29更新
|
905次组卷
|
2卷引用:湖北省八校(鄂南高中、华师一附中、黄冈中学、黄石二中、荆州中学、孝感高中、襄阳四中、襄阳五中)2018届高三第二次联考理综化学试题
名校
解题方法
3 . 我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2 等杂质) 经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________ 。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________ 。
Ⅱ.以TiO2 为原料制备金属钛,流程如下: TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________ 。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________ 。
(5)已知碳的燃烧热394kJ/mol,请写出TiO2 与Cl2、C反应制取TiCl4的热化学方程式_____________ 。
Ⅲ.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:

(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
该过程的理想温度为_______________ ,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________ ,该反应的离子方程式为________________________ 。
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2 等杂质) 经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:
Ⅱ.以TiO2 为原料制备金属钛,流程如下: TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因
(5)已知碳的燃烧热394kJ/mol,请写出TiO2 与Cl2、C反应制取TiCl4的热化学方程式
Ⅲ.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:

(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O 的转化率 | 80% | 90% | 97% | 93% | 82% |
您最近一年使用:0次
名校
解题方法
4 . 以下对影响反应方向因素的判断不正确的是
| A.有时焓变对反应的方向起决定性作用 |
| B.有时熵变对反应的方向起决定性作用 |
| C.焓变和熵变是判断反应方向的两个主要因素 |
| D.任何情况下,温度都不可能对反应的方向起决定性作用 |
您最近一年使用:0次
2017-07-25更新
|
709次组卷
|
16卷引用:湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题
湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题河南省南阳市第一中学2017-2018学年高二上学期第二次月考化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题贵州省安顺市平坝第一高级中学2018-2019学年高二上学期期中考试化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题云南省迪庆州维西县第二中学2019-2020学年上学期高二期末考试化学试题陕西省宝鸡市渭滨区2019—2020学年高二上学期期末考试化学试题贵州省雷山县第四中学2019-2020学年高二上学期期末考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第二次月考化学试题河南省洛阳市孟津县第二高级中学2020-2021学年高二上学期9月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 作业帮(已下线)2.3 化学反应的方向(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2.3 化学反应的方向(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)吉林江城中学2021-2022学年高二上学期期中考试化学试题
名校
5 . 下列叙述错误的是
| A.过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率 |
| B.空气污染日报中的空气污染指数的主要项目有可吸入颗粒物、二氧化硫、二氧化氮 |
| C.金属冶炼过程主要是利用金属矿物中的金属离子失去电子变成金属单质所发生的氧化还原反应 |
| D.糖类和油脂是重要的基本营养物质,并且是人体所需能量的重要来源 |
您最近一年使用:0次
2017-03-17更新
|
616次组卷
|
4卷引用:2017届湖北省八校(荆州中学、襄阳五中、襄阳四中等)高三下学期第二次联考理综化学试卷
2017届湖北省八校(荆州中学、襄阳五中、襄阳四中等)高三下学期第二次联考理综化学试卷2017届湖北省八校高三第二次联考(3月)理综化学试卷2017届湖南省长沙市长郡中学高三(实验班)第十次月考理综化学试卷(已下线)湖南省长沙市长郡中学2017届高三(实验班)第十次月考理综化学试题
6 .  肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___________ .
(2)实验室用两种固体制取NH3的反应化学方程式为_____________ .
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_____________ .
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为_____________ .
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
①焓变△H_________ 0(填“>”、“<”或“=”).
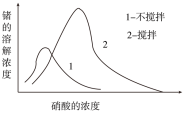
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是_____________ .图中A点处,NH3的平衡转化率为___________ .
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)⇌2NH3(g),测得甲容器中H2的平衡转化率为40%.
①判断乙容器中反应进行的方向是_____________ (填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为_____________ 。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___________________ ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是____________ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_____________________ 。
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是___________ (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为__________ {已知Ksp[Mg(OH)2]=4.0×10-12]}
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:
(2)实验室用两种固体制取NH3的反应化学方程式为
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是

(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)⇌2NH3(g),测得甲容器中H2的平衡转化率为40%.
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为
您最近一年使用:0次
7 . 如何解决好碳排放问题是关系到人类可持续发展的重大课题之一。目前,采用较多的方法是对二氧化碳进行捕集封存和富集再利用。下列与二氧化碳有关的叙述正确的是
| A.CO2是形成酸雨的主要物质 |
| B.CO2导致温室效应,是一种大气污染物 |
C.CO2(g)+C(s) 2CO(g) H>0,高温有利于该反应自发进行 2CO(g) H>0,高温有利于该反应自发进行 |
| D.实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳 |
您最近一年使用:0次
2016-12-09更新
|
123次组卷
|
3卷引用:2016届湖北武汉华中师大一附中等八校高三上联考一理化学卷
8 . 下列说法正确的是
| A.能自发进行的化学反应,一定是△H<0、△S>0 |
| B.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 |
| D.钢铁发生电化学腐蚀时,负极的电极反应式为 Fe–3e- = Fe3+ |
您最近一年使用:0次
解题方法
9 . 甲醇是基本有机化工原料。甲醇及其可制得产品的沸点如下。
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl ,溶液中各离子浓度由大到小的顺序为_______ 。
(2)甲醇合成二甲基甲酰胺的化学方程式为:
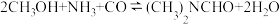

若该反应在常温下能自发进行,则
_______ 0 (填“ > ”、“ < ”或“ = " )。
(3)甲醇制甲醚的化学方程式为:2CH3OH CH3OCH3+H2O
CH3OCH3+H2O  。一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应。
。一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应。

①x/y=_______ 。
②已知387℃时该反应的化学平衡常数K=4。若起始时向容器I中充入0.1 mol CH3OH、0.15 mol CH3OCH3和0.10 mol H2O,则反应将向_______ (填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为_______ 。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如下图所示。

电源负极为_______ (填“A”或“B"),写出阳极的电极反应式_______ 。若参加反应的O2为 1.12m 3(标准状况),则制得碳酸二甲酯的质量为_______ kg。
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构简式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
(2)甲醇合成二甲基甲酰胺的化学方程式为:
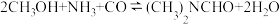

若该反应在常温下能自发进行,则

(3)甲醇制甲醚的化学方程式为:2CH3OH
 CH3OCH3+H2O
CH3OCH3+H2O  。一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应。
。一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应。
①x/y=
②已知387℃时该反应的化学平衡常数K=4。若起始时向容器I中充入0.1 mol CH3OH、0.15 mol CH3OCH3和0.10 mol H2O,则反应将向
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如下图所示。

电源负极为
您最近一年使用:0次
2013·湖北荆州·一模
10 . 下列叙述中正确的个数是
①有新单质生成的化学反应一定是氧化还原反应。
②熵增且放热的反应一定是自发反应。
③Mg比A1活泼,在Mg和A1形成的原电池中,Mg必定做负极。
④难溶电解质的溶度积越小,则它的溶解度越小。
⑤燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量。
⑥干燥的C12和氯水均能使鲜花褪色
①有新单质生成的化学反应一定是氧化还原反应。
②熵增且放热的反应一定是自发反应。
③Mg比A1活泼,在Mg和A1形成的原电池中,Mg必定做负极。
④难溶电解质的溶度积越小,则它的溶解度越小。
⑤燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量。
⑥干燥的C12和氯水均能使鲜花褪色
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次



