解题方法
1 . 研究氮氧化物 (NOₓ)的还原处理方法是环保领域的主要方向之一。回答下列问题:
 .用H2还原NO的反应为
.用H2还原NO的反应为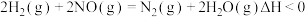

(1)该反应的正反应速率方程可表示为 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。
___________ ,
___________ 。
(2)研究表明上述反应历程分两步基元反应:
i. ;
;
ii.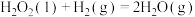 。
。
根据 (1)所给信息判断,H 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应___________ (填“ i”或“ii” ) 决定。
(3)将一定量的H 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是___________ 。
a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:
反应i. ;
;
反应ii. 。
。
反应过程中各物质相对能量如图 2 (TS表示过渡态): 的热化学方程式为
的热化学方程式为___________ 。
将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。___________ (填“高温”或者“低温”)。
(6)实验过程中,高于340℃后N O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是___________ 。
(7)450℃时, 该时间段内NO的脱除率=___________ (保留2位有效数字, NO的脱除率
 .用H2还原NO的反应为
.用H2还原NO的反应为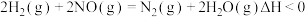

(1)该反应的正反应速率方程可表示为
 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。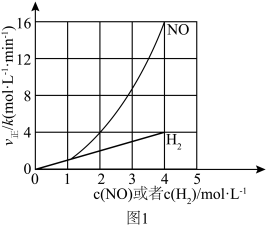
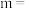

(2)研究表明上述反应历程分两步基元反应:
i.
 ;
;ii.
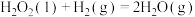 。
。根据 (1)所给信息判断,H
 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应(3)将一定量的H
 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:反应i.
 ;
;反应ii.
 。
。反应过程中各物质相对能量如图 2 (TS表示过渡态):
 的热化学方程式为
的热化学方程式为将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。
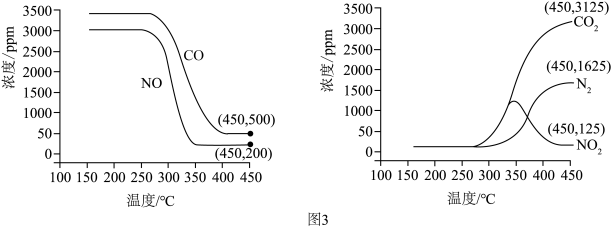
(6)实验过程中,高于340℃后N
 O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是(7)450℃时, 该时间段内NO的脱除率=

您最近一年使用:0次
名校
解题方法
2 . 控制变量法是化学实验的一种常用方法。
Ⅰ.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定_______ 进行判断,在此5组实验中,其速率最快的是_______ (填实验序号)。
(2)实验1和2表明_______ 对反应速率有影响,实验1和3对比发现实验3反应速率明显较快,主要原因是_______ 。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在OA、AB、BC三段中反应速率最快的是AB段,其原因是_______ 。_______ 。
(5)b点对应的反应速率
_______  。
。
(6)通过以上分析可知选择加入下列哪些试剂可以与加入硫酸铜有相似的效果_______
Ⅰ.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
| 序号 | 锌的质量/g | 锌的形式 |  |  | 反应前溶液的温度/℃ | 其他试剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴 溶液 溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴 溶液 溶液 |
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定
(2)实验1和2表明
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在OA、AB、BC三段中反应速率最快的是AB段,其原因是
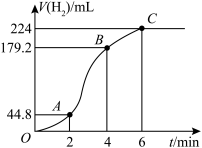
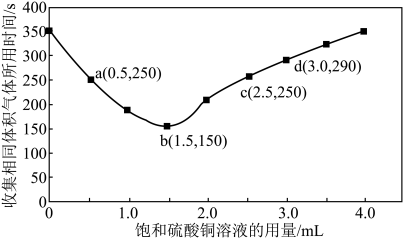
(5)b点对应的反应速率

 。
。(6)通过以上分析可知选择加入下列哪些试剂可以与加入硫酸铜有相似的效果_______
A. 溶液 溶液 | B. 溶液 溶液 | C.稀 | D. 溶液 溶液 |
您最近一年使用:0次
名校
3 . 2020年9月22日,国家主席习近平在第75届联合国大会上宣布:中国二氧化碳排放力争2030年前达到峰值,2060年前实现“碳中和”。为达成这一目标,要尽量减少不可避免的碳排放。
(1)工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为 ,该反应的能量变化图像如图所示。
,该反应的能量变化图像如图所示。_______ 。
A.铝粉与氧化铁的反应
B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应
D.钠与冷水的反应
②一定温度下,在2L的恒容密闭容器中,加入0.02molC(s)和0.01mol 发生反应:
发生反应: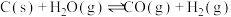 ,充分反应5min时,测得容器中CO的物质的量有0.008mol。以
,充分反应5min时,测得容器中CO的物质的量有0.008mol。以 表示的化学反应速率
表示的化学反应速率 为
为_______ 。
③我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
 反应放热。在低温下获得高产率。反应过程示意图如下图:
反应放热。在低温下获得高产率。反应过程示意图如下图:_______ 。
A.据图可知起始时的2个 分子最终都参与了反应
分子最终都参与了反应
B.过程Ⅰ、过程Ⅱ均为吸热过程,
C.过程Ⅲ只生成了极性共价键
D.使用催化剂缩小反应物和生成物的能量差
(2)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示: 完全分解生成CO(g)和
完全分解生成CO(g)和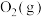 需要
需要_______ (填“吸收”或“放出”)_______ kJ的能量。
(3) 分解产生的CO和
分解产生的CO和 可以作为
可以作为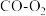 燃料电池的原料。下图为
燃料电池的原料。下图为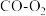 燃料电池的构造示意图,根据电子运动方向,可知氧气从
燃料电池的构造示意图,根据电子运动方向,可知氧气从_______ 口通入(填“a”或“b”);X极为电池的_______ (填“正”或“负”)极,电极反应为_______ , 向
向_______ 极移动(填“X”或“Y”);若两极共消耗气体3.36L(标准状况下),则通过导线的电子数为_______ 。
(1)工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和
 ),其反应的化学方程式为
),其反应的化学方程式为 ,该反应的能量变化图像如图所示。
,该反应的能量变化图像如图所示。
A.铝粉与氧化铁的反应
B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应
D.钠与冷水的反应
②一定温度下,在2L的恒容密闭容器中,加入0.02molC(s)和0.01mol
 发生反应:
发生反应: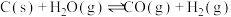 ,充分反应5min时,测得容器中CO的物质的量有0.008mol。以
,充分反应5min时,测得容器中CO的物质的量有0.008mol。以 表示的化学反应速率
表示的化学反应速率 为
为③我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
 反应放热。在低温下获得高产率。反应过程示意图如下图:
反应放热。在低温下获得高产率。反应过程示意图如下图:
A.据图可知起始时的2个
 分子最终都参与了反应
分子最终都参与了反应B.过程Ⅰ、过程Ⅱ均为吸热过程,
C.过程Ⅲ只生成了极性共价键
D.使用催化剂缩小反应物和生成物的能量差
(2)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
 完全分解生成CO(g)和
完全分解生成CO(g)和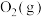 需要
需要(3)
 分解产生的CO和
分解产生的CO和 可以作为
可以作为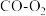 燃料电池的原料。下图为
燃料电池的原料。下图为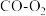 燃料电池的构造示意图,根据电子运动方向,可知氧气从
燃料电池的构造示意图,根据电子运动方向,可知氧气从 向
向
您最近一年使用:0次
解题方法
4 . 利用 脱除烟气中的
脱除烟气中的 具有重要意义。已知在
具有重要意义。已知在 还原
还原 过程中,会发生如下反应:
过程中,会发生如下反应:
反应i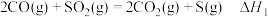
反应ii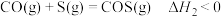
反应iii
回答下列问题:
(1)已知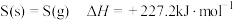 ,
, 和
和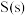 的燃烧热分别为
的燃烧热分别为 、
、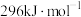 ,则反应i的
,则反应i的 为
为___________  。
。
(2)下列有利于提高反应i中 的平衡转化率的是___________。
的平衡转化率的是___________。
(3)一定条件下,该体系达平衡时各气体物质的量随 进料比的变化如图1所示。
进料比的变化如图1所示。___________ 。
②通入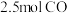 和
和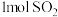 ,达到平衡时
,达到平衡时 ,则反应ii的
,则反应ii的
___________ ( 为物质的量分数,计算结果保留两位小数)。
为物质的量分数,计算结果保留两位小数)。
(4)在刚性容器中,控制反成温度为823K。固定 浓度为
浓度为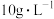 ,
, 进料比分别为
进料比分别为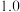 、
、 、
、 时
时 的转化率随时间变化如图2所示。
的转化率随时间变化如图2所示。 进料比为
进料比为 对应图中曲线
对应图中曲线___________ 。
②反应从开始到A点时间内 的生成速率为
的生成速率为___________ 。
(5)在催化剂作用下, 还原
还原 的部分机理如图3所示(
的部分机理如图3所示( 表示S吸附在催化剂表面)。该反应的催化剂为
表示S吸附在催化剂表面)。该反应的催化剂为___________ ,历程②的方程式为___________ 。
 脱除烟气中的
脱除烟气中的 具有重要意义。已知在
具有重要意义。已知在 还原
还原 过程中,会发生如下反应:
过程中,会发生如下反应:反应i
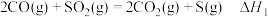
反应ii
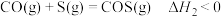
反应iii

回答下列问题:
(1)已知
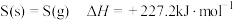 ,
, 和
和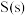 的燃烧热分别为
的燃烧热分别为 、
、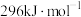 ,则反应i的
,则反应i的 为
为 。
。(2)下列有利于提高反应i中
 的平衡转化率的是___________。
的平衡转化率的是___________。A.恒容时增大 浓度 浓度 | B.降低温度 |
| C.选择合适的催化剂 | D.减小容器的容积 |
(3)一定条件下,该体系达平衡时各气体物质的量随
 进料比的变化如图1所示。
进料比的变化如图1所示。
②通入
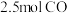 和
和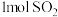 ,达到平衡时
,达到平衡时 ,则反应ii的
,则反应ii的
 为物质的量分数,计算结果保留两位小数)。
为物质的量分数,计算结果保留两位小数)。(4)在刚性容器中,控制反成温度为823K。固定
 浓度为
浓度为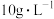 ,
, 进料比分别为
进料比分别为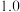 、
、 、
、 时
时 的转化率随时间变化如图2所示。
的转化率随时间变化如图2所示。
 进料比为
进料比为 对应图中曲线
对应图中曲线②反应从开始到A点时间内
 的生成速率为
的生成速率为(5)在催化剂作用下,
 还原
还原 的部分机理如图3所示(
的部分机理如图3所示( 表示S吸附在催化剂表面)。该反应的催化剂为
表示S吸附在催化剂表面)。该反应的催化剂为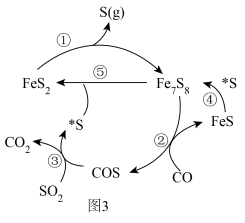
您最近一年使用:0次
5 . 甲硫醇(CH3SH)是重要的有机化工中间体,可用于合成维生素。通过CH3OH和H2S合成CH3SH的主要反应为:
Ⅰ.
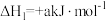
Ⅱ.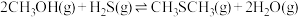
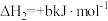
回答下列问题:
(1)计算反应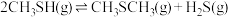 的△H=
的△H=________ kJ/mol。
(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是________ (填选项字母);若按相同比例再充入一定量CH3OH(g)和H2S(g),CH3OH(g)的平衡转化率将________ (填“变大”“变小”或“不变”)。
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为________ (CH3SH的选择性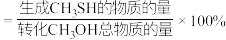 )。
)。
②反应Ⅰ的平衡常数Kp=________ (Kp是用分压表示的平衡常数,结果保留两位小数)。
(4)在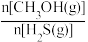 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。________ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为________ 。
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:________ 。
Ⅰ.

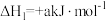
Ⅱ.
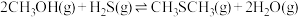
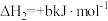
回答下列问题:
(1)计算反应
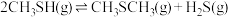 的△H=
的△H=(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为
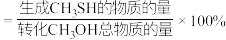 )。
)。②反应Ⅰ的平衡常数Kp=
(4)在
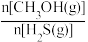 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。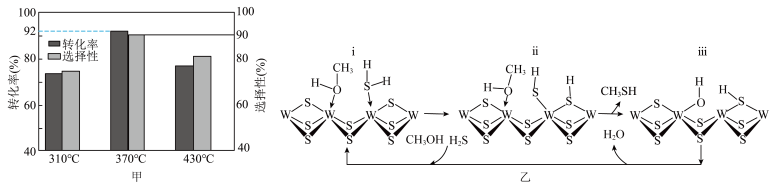
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:
您最近一年使用:0次
名校
6 . 化学反应过程既有物质变化也有能量变化。
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。
(1)由 和
和 合成氨时,需要
合成氨时,需要_____________ (填“吸收”或“放出”)能量,写出该反应的热化学方程式_________________ 。
Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。_______ (填“氧化反应”或“还原反应”),电池工作过程中, 向极移动
向极移动_________ (填“A”或“B”);
②该燃料电池的总反应方程式可表示为__________ 。在标准状况下,若A极区产生11.2L  ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是__________ mol。
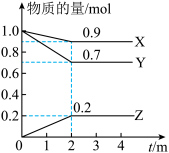
Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:_____________ 。
(4)反应开始至2min,以气体X表示的平均反应速率为___________ 。
(5)下列措施能增大反应速率的是_________ 。
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436
 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。(1)由
 和
和 合成氨时,需要
合成氨时,需要Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。
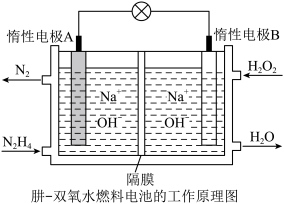
 向极移动
向极移动②该燃料电池的总反应方程式可表示为
 ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(4)反应开始至2min,以气体X表示的平均反应速率为
(5)下列措施能增大反应速率的是
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
| A.混合气体的压强不随时间的变化而变化 | B. |
| C.X体积分数保持不变 | D.混合气体的密度不随时间的变化而变化 |
您最近一年使用:0次
7 . Ⅰ。在下列事实中,什么因素影响了化学反应速率?
(1)集气瓶中有 和
和 的混合气体,在瓶外点燃镁条时发生爆炸
的混合气体,在瓶外点燃镁条时发生爆炸___________ ;
黄铁矿煅烧时要粉碎成细小的矿粒。___________ ;
熔化的 放出气泡很慢,加入少量
放出气泡很慢,加入少量 后很快产生气体。
后很快产生气体。___________ ;
夏天食品容易变质,冬天就不易发生该现象。___________ ;
同样大小的石灰石分别在 的盐酸和
的盐酸和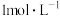 的盐酸中反应,反应速率不同。
的盐酸中反应,反应速率不同。___________ 。
Ⅱ。某温度时,在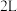 密闭容器中
密闭容器中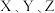 三种气态物质的物质的量
三种气态物质的物质的量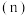 随时间
随时间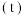 变化的曲线如图所示,由图中数据分析:
变化的曲线如图所示,由图中数据分析:___________ 。
(3)反应开始至 ,用
,用 表示的平均反应速率为
表示的平均反应速率为___________ 。此时, 的转化率为
的转化率为___________ 。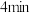 时,加入1体积
时,加入1体积 ,反应速率
,反应速率___________ (填“变大”、“变小”、“不变”)
(4)下列叙述不能说明上述反应达到化学平衡状态的是___________ (填序号)。
A. 的物质的量不随时间变化而变化
的物质的量不随时间变化而变化
B. 的质量分数不随时间变化而变化
的质量分数不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.
E.
F.单位时间内每消耗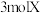 ,同时生成
,同时生成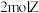
(1)集气瓶中有
 和
和 的混合气体,在瓶外点燃镁条时发生爆炸
的混合气体,在瓶外点燃镁条时发生爆炸黄铁矿煅烧时要粉碎成细小的矿粒。
熔化的
 放出气泡很慢,加入少量
放出气泡很慢,加入少量 后很快产生气体。
后很快产生气体。夏天食品容易变质,冬天就不易发生该现象。
同样大小的石灰石分别在
 的盐酸和
的盐酸和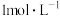 的盐酸中反应,反应速率不同。
的盐酸中反应,反应速率不同。Ⅱ。某温度时,在
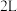 密闭容器中
密闭容器中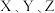 三种气态物质的物质的量
三种气态物质的物质的量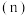 随时间
随时间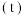 变化的曲线如图所示,由图中数据分析:
变化的曲线如图所示,由图中数据分析: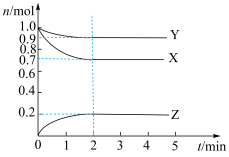
(3)反应开始至
 ,用
,用 表示的平均反应速率为
表示的平均反应速率为 的转化率为
的转化率为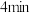 时,加入1体积
时,加入1体积 ,反应速率
,反应速率(4)下列叙述不能说明上述反应达到化学平衡状态的是
A.
 的物质的量不随时间变化而变化
的物质的量不随时间变化而变化 B.
 的质量分数不随时间变化而变化
的质量分数不随时间变化而变化C.混合气体的总物质的量不随时间变化而变化
D.

E.

F.单位时间内每消耗
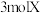 ,同时生成
,同时生成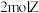
您最近一年使用:0次
名校
解题方法
8 . 按要求回答下列问题:
(1)某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、
)、 、
、 等物质。
等物质。
①汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是_______ (填字母)。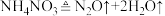 ,推测安全气囊中
,推测安全气囊中 的作用有
的作用有_______ 。
(2)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。_______ 转化为化学能。
②根据数据计算,分解1 mol 需
需_______ (填“吸收”或“释放”)_______ kJ的能量。
(3)汽车尾气净化装置中,三元催化剂能将一氧化碳、碳氢化合物和氮氧化物转化为无毒气体,某研究小组模拟实验,计算反应速率。一定条件下,在2 L密闭容器内,反应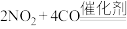
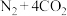 ,
,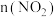 时间变化如表:
时间变化如表:
0~2s内用CO表示该反应的平均速率为_______ 。
(4)氮气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和 ,在一定条件下发生反应:
,在一定条件下发生反应: 。
。
①能说明该反应已达到平衡状态的标志是_______ (填标号)
A.反应速率
B.容器内压强不再随时间而发生变化
C.容器内 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
D.容器内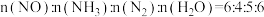
②某次实验中测得容器内NO及 的物质的量随时间变化如图。
的物质的量随时间变化如图。
_______  (填>“<”或“=”),d点对应的速率关系是
(填>“<”或“=”),d点对应的速率关系是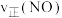
_______ 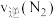 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)某汽车安全气囊的气体发生剂主要含有叠氮化钠(
 )、
)、 、
、 等物质。
等物质。①汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是A.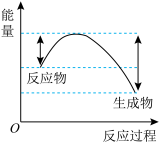 B.
B.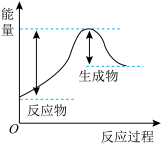 C.
C.
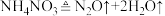 ,推测安全气囊中
,推测安全气囊中 的作用有
的作用有(2)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
②根据数据计算,分解1 mol
 需
需(3)汽车尾气净化装置中,三元催化剂能将一氧化碳、碳氢化合物和氮氧化物转化为无毒气体,某研究小组模拟实验,计算反应速率。一定条件下,在2 L密闭容器内,反应
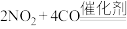
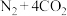 ,
,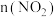 时间变化如表:
时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
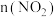 /mol /mol | a | b | c | d | e | f |
(4)氮气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和
 ,在一定条件下发生反应:
,在一定条件下发生反应: 。
。①能说明该反应已达到平衡状态的标志是
A.反应速率

B.容器内压强不再随时间而发生变化
C.容器内
 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化D.容器内
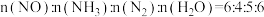
②某次实验中测得容器内NO及
 的物质的量随时间变化如图。
的物质的量随时间变化如图。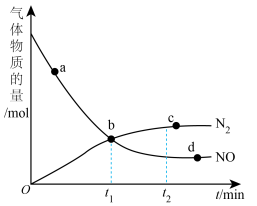

 (填>“<”或“=”),d点对应的速率关系是
(填>“<”或“=”),d点对应的速率关系是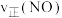
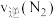 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
名校
9 .  是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
(1)已知利用合成气(主要成分 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为_____________________ (填“放热”或“吸热”)反应。 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收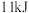 热量,请写出热化学方程式:
热量,请写出热化学方程式:_____________________________________________________ 。
(3)现在实验室中用 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在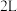 恒容密闭容器内,
恒容密闭容器内,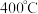 时发生反应:
时发生反应: ,体系中
,体系中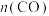 随时间的变化如表:
随时间的变化如表:
①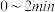 内,以
内,以 表示的该反应速率
表示的该反应速率
_____________________ 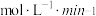 ;
;
②下列措施不能提高反应速率的有_____________________ (请用相应字母填空);
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂
③下列叙述能说明反应达到平衡状态的是_____________________ (请用相应字母填空);
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成
 容器内气体密度保持不变
容器内气体密度保持不变
 容器内质量保持不变
容器内质量保持不变
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。(1)已知利用合成气(主要成分
 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为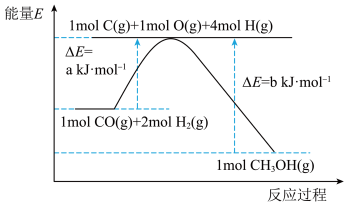
 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收 热量,请写出热化学方程式:
热量,请写出热化学方程式:(3)现在实验室中用
 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,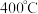 时发生反应:
时发生反应: ,体系中
,体系中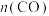 随时间的变化如表:
随时间的变化如表:时间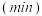 | 0 | 1 | 2 | 3 | 5 |
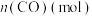 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
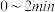 内,以
内,以 表示的该反应速率
表示的该反应速率
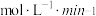 ;
;②下列措施不能提高反应速率的有
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂③下列叙述能说明反应达到平衡状态的是
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成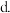 容器内气体密度保持不变
容器内气体密度保持不变 容器内质量保持不变
容器内质量保持不变
您最近一年使用:0次
名校
解题方法
10 . 空气中的氮氧化物主要来源:化石燃料燃烧、工业制硝酸尾气、汽车尾气。
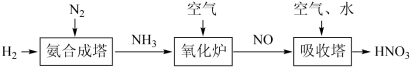
I.请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:___________ 。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
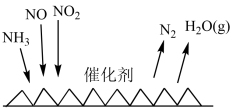
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:___________ 。
II.甲烷在一定条件下可以消除氮氧化物污染。
(4)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为___________ 。
(5)甲烷与NO2发生的反应为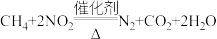 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使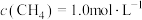 、
、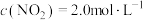 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得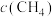 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在10~20min内,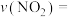
___________ ,40min时v(正)___________ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是___________ 。
I.请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
II.甲烷在一定条件下可以消除氮氧化物污染。
(4)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为
(5)甲烷与NO2发生的反应为
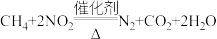 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使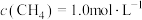 、
、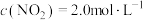 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得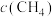 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验序号 | 时间/min 浓度 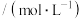 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
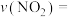
②0~20min内,实验2比实验1反应速率快的原因可能是
您最近一年使用:0次



