名校
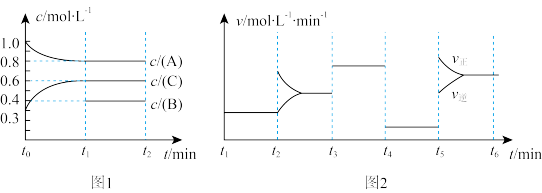
1 . (1)向一体积不变的密闭容器中加入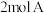 、
、 和一定量的B三种气体。一定条件下发生反应
和一定量的B三种气体。一定条件下发生反应 ,各物质浓度随时间变化如图1所示。图2为
,各物质浓度随时间变化如图1所示。图2为 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知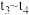 阶段为使用催化剂;图1中
阶段为使用催化剂;图1中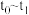 阶段
阶段 未画出。
未画出。
①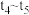 ,
,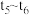 阶段改变的条件为
阶段改变的条件为_________ ,________ B的起始物质的量为________ 。
②为使该反应的反应速率减慢且平衡向逆反应方向移动可以采取的措施有_________ 。
(2)某小组利用 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知: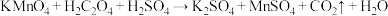 (未配平)。
(未配平)。
①表中
___________ mL,
___________ mL
②探究温度对化学反应速率影响的实验编号是________ (填编号,下同),可探究反应物浓度对反应速率影响的实验编号是____________ 。
③实验①测得 溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率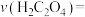
_______________ .
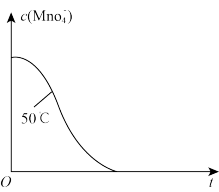
④已知50℃时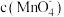 与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时
与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时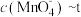 的变化曲线示意图。
的变化曲线示意图。_________
 、
、 和一定量的B三种气体。一定条件下发生反应
和一定量的B三种气体。一定条件下发生反应 ,各物质浓度随时间变化如图1所示。图2为
,各物质浓度随时间变化如图1所示。图2为 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知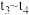 阶段为使用催化剂;图1中
阶段为使用催化剂;图1中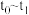 阶段
阶段 未画出。
未画出。①
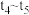 ,
,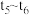 阶段改变的条件为
阶段改变的条件为②为使该反应的反应速率减慢且平衡向逆反应方向移动可以采取的措施有

(2)某小组利用
 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知: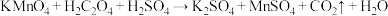 (未配平)。
(未配平)。| 实验编号 | 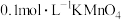 酸性溶液的体积 酸性溶液的体积 | 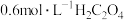 溶液的体积 溶液的体积 |  的体积 的体积 | 实验温度/℃ | 溶液褪色所需时间 |
| ① | 10 |  | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 |  | 50 |


②探究温度对化学反应速率影响的实验编号是
③实验①测得
 溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率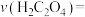
④已知50℃时
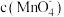 与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时
与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时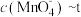 的变化曲线示意图。
的变化曲线示意图。
您最近一年使用:0次
名校
解题方法
2 . 反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
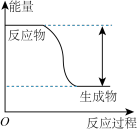
(1)该反应为____________ (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____________ (填字母)。
A.改铁片为铁粉B.改稀硫酸为98%的浓硫酸C.升高温度D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____________ (填“正”或“负”)极。铜片上产生的现象为____________ ,该极上发生的电极反应为____________ ,铁电极的电极反应为____________ ,外电路中电子由____________ (填“正”或“负”,下同)极向____________ 极移动。

(1)该反应为
(2)若要使该反应的反应速率增大,下列措施可行的是
A.改铁片为铁粉B.改稀硫酸为98%的浓硫酸C.升高温度D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
名校
解题方法
3 . 按照要求填空:
(1) 在一可变的容积的密闭容器中进行
在一可变的容积的密闭容器中进行
①增加Fe的量,其反应速率的变化是______ (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,反应速率______________
③保持体积不变,充入N2使体系压强增大,其反应速率________
④保持压强不变,充入N2使容器的体积增大,其反应速率__________
(2)2HI(g) ⇌H2(g)+I2(g)(正反应为吸热反应)改变下列条件:
①减小容器体积:平衡____ (填正移,逆移,不移动,以下相同)颜色___ (加深,变浅,不变,以下相同)
②加热升高温度:平衡____________
③体积不变,充入H2:平衡_____________ 颜色_______________
(3)可逆反应2NO2(g) N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:
N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____ t3:_______

(1)
 在一可变的容积的密闭容器中进行
在一可变的容积的密闭容器中进行①增加Fe的量,其反应速率的变化是
②将容器的体积缩小一半,反应速率
③保持体积不变,充入N2使体系压强增大,其反应速率
④保持压强不变,充入N2使容器的体积增大,其反应速率
(2)2HI(g) ⇌H2(g)+I2(g)(正反应为吸热反应)改变下列条件:
①减小容器体积:平衡
②加热升高温度:平衡
③体积不变,充入H2:平衡
(3)可逆反应2NO2(g)
 N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:
N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:
您最近一年使用:0次
2020-05-27更新
|
115次组卷
|
2卷引用:宁夏石嘴山市第三中学2019-2020学年高一下学期期中考试化学试题
名校
4 . 回答下列问题:
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为 和
和 ,其中
,其中 属于
属于____________ (填“酸性”“碱性”或“两性”)氧化物;
②冶炼过程中需要用到氨,氨溶于水所得溶液呈____________ (填“酸性”或“碱性”);
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取_____________ (填“热还原法”或“电解法”)。
(2)工业上合成氨的反应为: ,一定条件下,将
,一定条件下,将 和
和 置于
置于 的密闭容器中,
的密闭容器中,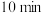 后测得
后测得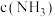 为
为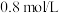 。
。
①用 表示该反应的速率为
表示该反应的速率为___________ ;
②其他条件不变时,再通入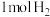 ,该反应的速率将
,该反应的速率将_____________ (填“增大”或“减小”)。
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为
 和
和 ,其中
,其中 属于
属于②冶炼过程中需要用到氨,氨溶于水所得溶液呈
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取
(2)工业上合成氨的反应为:
 ,一定条件下,将
,一定条件下,将 和
和 置于
置于 的密闭容器中,
的密闭容器中,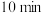 后测得
后测得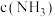 为
为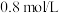 。
。①用
 表示该反应的速率为
表示该反应的速率为②其他条件不变时,再通入
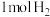 ,该反应的速率将
,该反应的速率将
您最近一年使用:0次
2020-05-12更新
|
409次组卷
|
2卷引用:宁夏吴忠中学2019-2020学年高一下学期期末考试化学试题
名校
5 . 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL某浓度的稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
(1)2~3min段的反应速率比1~2min段的反应速率__________ (填“块”或“慢”),原因是______ ;
(2)求2~3min段以HCl的浓度变化来表示的平均反应速率(设溶液体积不变)____________ ;
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)____________ 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
(1)2~3min段的反应速率比1~2min段的反应速率
(2)求2~3min段以HCl的浓度变化来表示的平均反应速率(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
您最近一年使用:0次
2019-11-05更新
|
114次组卷
|
2卷引用:宁夏长庆高级中学2019-2020学年高二上学期期中考试化学试题
名校
6 . 对于反应2SO2(g) + O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
①增加O2的浓度,平衡___ 移动,SO2的浓度___ ,SO3的物质的量___ 。
②增大压强,平衡___ 移动, SO2的浓度____ ,SO3的浓度___ 。
③升高温度,平衡____ 移动,SO2的浓度___ ,SO3的浓度____ 。
 2SO3(g) △H<0
2SO3(g) △H<0①增加O2的浓度,平衡
②增大压强,平衡
③升高温度,平衡
您最近一年使用:0次
名校
解题方法
7 . 从能量的变化和反应的快慢等角度研究反应: .
.
(1)为了加快正反应速率,可以采取的措施有________ (填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________ .

(3)从断键和成键的角度分析上述反应中能量的变化.
请填写下表:
 .
. (1)为了加快正反应速率,可以采取的措施有
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是

(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 |  |  |  |
键能 | 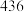 | 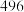 |  |
请填写下表:
| 化学键 | 填“吸收”或“放出”能量 | 能量变化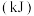 | |
| 拆开化学键 |  中的化学键 中的化学键 | ① | ④ |
 中的化学键 中的化学键 | |||
| 形成化学键 | 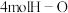 键 键 | ② | ⑤ |
| 总能量变化 | ③ | ⑥ | |
您最近一年使用:0次
名校
8 . (Ⅰ)在体积为2L的密闭容器中,某可逆 反应(ABC均为气体),从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示。
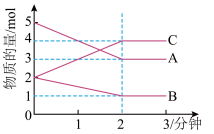
(1)则该反应的反应物是________ ,生成物是_______ ;
(2)该反应的化学方程式为__________ ;
(3)反应开始至2分钟时,用C表示反应速率________ ;
(4)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了______ 状态。
(Ⅱ)对于反应:2SO2(g)+O2(g) 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。

(1)则该反应的反应物是
(2)该反应的化学方程式为
(3)反应开始至2分钟时,用C表示反应速率
(4)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
(Ⅱ)对于反应:2SO2(g)+O2(g)
 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。| 编 号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大O2的浓度 | |
| ④ | 使用V2O5作催化剂 |
您最近一年使用:0次
真题
名校
9 . 反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
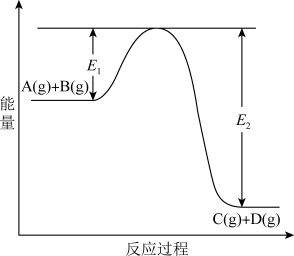
(1)该反应是____________________ 反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______ (填“增大”“减小”“不变”),原因是_______________________________ ;
(3)反应体系中加入催化剂对反应热是否有影响?________ ,原因是_________ :
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________ ,E2________ (填“增大”“减小、”“不变”)。
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
您最近一年使用:0次
2019-01-30更新
|
1406次组卷
|
19卷引用:宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题
宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题2008年普通高等学校招生统一考试化学试题(海南卷)(已下线)2010年河南省长葛三高高二上学期第一次考试化学试题(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2015-2016学年海南文昌中学高一下期末考化学(理)试题2015-2016学年青海省西宁市第五中学高一下学期期末(理)化学试卷山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题山西省运城市稷山中学2019-2020学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题
名校
10 . 在密闭容器中发生3X(g)+Y(g)  Z (g)+2W(g)反应,现在控制下列三种不同的条件:
Z (g)+2W(g)反应,现在控制下列三种不同的条件:
那么,反应开始时,正反应速率最大的是(填序号,下同)__________ ,正反应速率最小的是___________ 。
 Z (g)+2W(g)反应,现在控制下列三种不同的条件:
Z (g)+2W(g)反应,现在控制下列三种不同的条件:①在400℃时,9molX与3molY反应
②在400℃时,15 molX与5molY反应
③在300℃时,9molX与3molY反应
那么,反应开始时,正反应速率最大的是(填序号,下同)
您最近一年使用:0次
2017-05-02更新
|
110次组卷
|
2卷引用:宁夏石嘴山市第三中学2016-2017学年高一下学期期中考试化学试题



