解题方法
1 . 回答下列问题:
(1)将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如下图所示: 速度变化的主要原因
速度变化的主要原因______________ 。
② 速度变化的主要原因是
速度变化的主要原因是_____________ 。
(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是____________ ;配制完毕后要加入少量铁屑,其目的是______________ 。
(1)将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如下图所示:
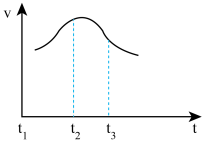
 速度变化的主要原因
速度变化的主要原因②
 速度变化的主要原因是
速度变化的主要原因是(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是
您最近一年使用:0次
名校
解题方法
2 . 反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示:
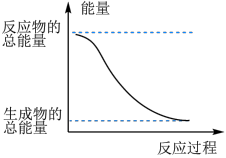
(1)该反应为___________ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为___________ (填“正”或“负”)极;其电极反应式为:___________ ,外电路中电流由___________ 流出。(填电极材料名称)。
(3)若要使该反应的反应速率加快,下列措施可行的是 。

(1)该反应为
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使该反应的反应速率加快,下列措施可行的是 。
| A.增加铁的量 | B.改稀硫酸为98%的硫酸 |
| C.增大压强 | D.滴加几滴CuSO4溶液 |
您最近一年使用:0次
名校
解题方法
3 . 某同学根据外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(1)写出上述反应的离子方程式___________ 。
(2)能说明温度对该反应速率影响的组合比较是___________ (填实验序号);
(3)C1___________ ;
___________ 。
(4)A和B、A和C的组合比较所研究的问题分别是___________ 、___________ 。
| 实验序号 | 反应温度 | 参加反应的物质 | ||||
 |  |  | ||||
 | 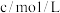 | 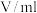 | 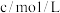 | 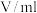 | ||
 |  | 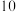 |  | 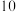 |  |  |
 |  |  |  | 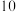 |  |  |
| C |  | 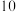 |  |  |  |  |
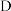 |  |  |  | 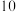 |  |  |
(2)能说明温度对该反应速率影响的组合比较是
(3)C1
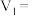
(4)A和B、A和C的组合比较所研究的问题分别是
您最近一年使用:0次
名校
4 . 一定条件下,容积2L的密闭容器中,将1mol L气体和0.5mol M气体混合,发生如下反应: ,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为
,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为 。计算:
。计算:
(1)化学方程式中a的值为___________ 。
(2)前5s内用M表示的化学反应速率为___________ ,L的转化率为___________ 。
(3)一定能使该反应的速率增大的措施有___________(填字母)。
(4)可认定上述可逆反应在一定条件下已达到化学平衡状态的是___________ (填字母)。
A.体系压强不再变化
B.体系的密度不再变化
C.
D.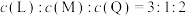
E.Q(g)的物质的量浓度不再发生变化
 ,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为
,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为 。计算:
。计算:(1)化学方程式中a的值为
(2)前5s内用M表示的化学反应速率为
(3)一定能使该反应的速率增大的措施有___________(填字母)。
| A.其他条件不变,充入一定量气体L | B.降低温度 |
| C.保持温度不变,将容器的体积压缩 | D.保持体积不变,充入无关惰性气体 |
A.体系压强不再变化
B.体系的密度不再变化
C.

D.
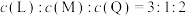
E.Q(g)的物质的量浓度不再发生变化
您最近一年使用:0次
2023-04-26更新
|
328次组卷
|
2卷引用:宁夏吴忠中学2022-2023学年高一下学期学业水平模拟考试(三)化学(B)试题
名校
5 . 定条件下,发生反应A(g)+B(g) C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:
A.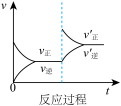 B.
B.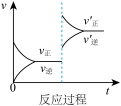 C.
C. D.
D.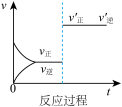 E.
E.
(1)表示升高温度,达到新平衡的是图______ (填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数______ (填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是图______ ,A的转化率______ 。
(3)表示减少C的浓度,达到新平衡的是图______ ,表示使用催化剂,达新平衡的是图。
(4)增加A的浓度,达到新平衡的是图______ ,达到平衡后A的转化率______ 。
 C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:A.
 B.
B. C.
C. D.
D. E.
E.
(1)表示升高温度,达到新平衡的是图
(2)表示降低压强,达到新平衡的是图
(3)表示减少C的浓度,达到新平衡的是图
(4)增加A的浓度,达到新平衡的是图
您最近一年使用:0次
2023-04-24更新
|
263次组卷
|
2卷引用:宁夏青铜峡市宁朔中学2023-2024学年高二上学期期中考试化学试题
名校
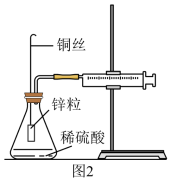
6 . 图1实验装置用于测定锌与稀硫酸反应的速率。 _______ 。
(2)分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者_______ 。 填“长”或“短”
填“长”或“短”
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
b. 在锥形瓶中加入40 mL的1 mol·L-1硫酸;
c. 塞好橡胶塞,_______ 时立即用秒表计时;
d. 注射器内每增加5mL气体时读取一次秒表。
(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是_______ ,反应进行一定时间后速率逐渐减慢,原因是_______ 。
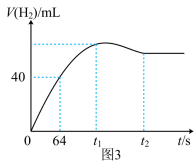
(5)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是_______ ;在64 s内用H+浓度表示的平均反应速率v(H+) = _______ (此时,溶液体积仍为40 mL,气体摩尔体积为25 L·mol-1)。

(2)分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者
 填“长”或“短”
填“长”或“短”
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
b. 在锥形瓶中加入40 mL的1 mol·L-1硫酸;
c. 塞好橡胶塞,
d. 注射器内每增加5mL气体时读取一次秒表。
(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是
(5)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是
您最近一年使用:0次
2022-09-28更新
|
272次组卷
|
4卷引用:宁夏石嘴山市平罗中学2023-2024学年高二下学期4月月考化学试题
宁夏石嘴山市平罗中学2023-2024学年高二下学期4月月考化学试题(已下线)2.3.1 化学反应速率的概念和测定-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)湖南省邵阳市武冈市2022-2023学年高二上学期期中考试化学试题(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
名校
7 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是_______ ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V9=_______ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
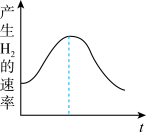
(4)把锌片投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示,刚开始反应速率增大的原因是_______ ,后反应速率又减小的原因是_______ 。(填正确选项前的序号)
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
| A.①②④ | B.①③⑤ | C.③④⑤ | D.①③④ |
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度

您最近一年使用:0次
名校
8 . Ⅰ 氮及其化合物的转化过程如图1所示,其中图2为反应①过程中能量变化的曲线图。
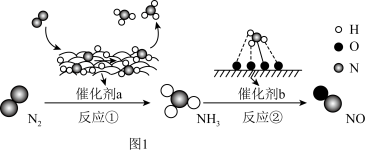
(1)图2中曲线_______ (填字母)是加入催化剂a时的能量变化曲线,该反应破坏生成物全部化学键所需要的总能量_______ (填“大于”或“小于”或“等于”)破坏反应物全部化学键所需要的总能量

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为_______
(3)下列说法正确的是
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式_______ ,该反应的机理及各分子化学键完全断裂时的能量变化如图所示,根据数据计算,分解1molCO2需_______ (填“吸收”或“放出”) _______ kJ的能量。


(1)图2中曲线

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为
(3)下列说法正确的是
| A.合成氨在工业生产中常将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.工业合成氨中,为加快化学反应速率,压强和温度越高越好 |
| C.合成氨工业要用合适的催化剂,目的是降低该反应的活化能 |
| D.工业合成氨中反应物不能百分之百转化为生成物 |
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式

您最近一年使用:0次
名校
解题方法
9 . 化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
①上述实验中溶液最先变浑浊的是___________ (填实验编号,下同)。
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择___________
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答:
①该反应的化学平衡常数表达式为K =___________ 。
②该反应为___________ (填“吸热”或“放热”)反应。
③能说明该反应达到化学平衡状态的是___________ (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___________ ℃。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
| 实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| Ⅰ | 25 | 0.1 | 0.1 |
| Ⅱ | 25 | 0.2 | 0.1 |
| Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
①该反应的化学平衡常数表达式为K =
②该反应为
③能说明该反应达到化学平衡状态的是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
名校
解题方法
10 . 某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制___ 、___ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为___ 。
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用___ 。
A.0.5mol·L-1氯化亚铁溶液
B.0.5mol·L-1氯化铜溶液
C.0.5mol·L-1盐酸
D.0.5mol·L-1氯化亚铁和0.5mol·L-1氯化铜混合溶液
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用
A.0.5mol·L-1氯化亚铁溶液
B.0.5mol·L-1氯化铜溶液
C.0.5mol·L-1盐酸
D.0.5mol·L-1氯化亚铁和0.5mol·L-1氯化铜混合溶液
您最近一年使用:0次



