名校
1 . 某工业生产中发生反应: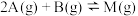
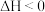 。下列有关该工业生产的说法正确的是
。下列有关该工业生产的说法正确的是
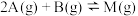
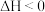 。下列有关该工业生产的说法正确的是
。下列有关该工业生产的说法正确的是| A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成 |
| B.若物质B廉价易得,工业上一般采用加入过量的B的方式来提高A和B的转化率 |
| C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高 |
| D.工业生产中使用催化剂可提高M的日产量 |
您最近一年使用:0次
2022-09-04更新
|
268次组卷
|
9卷引用:辽宁省联合校2020-2021学年高二上学期第一次月考化学试题
辽宁省联合校2020-2021学年高二上学期第一次月考化学试题辽宁省实验中学东戴河分校2020-2021学年高二10月月考化学试题吉林省白城市第一中学2021-2022学年高二上学期9月阶段考试化学试题吉林省长春市十一高中2021-2022学年高二上学期第一学程考试化学试题第四节 化学反应的调控(已下线)【知识图鉴】单元讲练测选择性必修1第2单元01讲核心第二章 第四节 化学反应的调控(已下线)专题06 化学反应的方向及调控【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)内蒙古赤峰实验中学2023-2024学年高二下学期开学化学试题
12-13高一下·四川广安·期末
名校
解题方法
2 . 向四个体积相同的密闭容器中分别充入一定量的 和
和 ,开始反应时,按正反应速率由大到小的顺序排列,正确的是
,开始反应时,按正反应速率由大到小的顺序排列,正确的是
①500℃,10mol 和5mol
和5mol 反应
反应
②500℃,用 作催化剂,10mol
作催化剂,10mol 和5mol
和5mol 反应
反应
③450℃,8mol 和5mol
和5mol 反应
反应
④500℃,8mol 和5mol
和5mol 反应
反应
 和
和 ,开始反应时,按正反应速率由大到小的顺序排列,正确的是
,开始反应时,按正反应速率由大到小的顺序排列,正确的是 ①500℃,10mol
 和5mol
和5mol 反应
反应②500℃,用
 作催化剂,10mol
作催化剂,10mol 和5mol
和5mol 反应
反应③450℃,8mol
 和5mol
和5mol 反应
反应④500℃,8mol
 和5mol
和5mol 反应
反应| A.①②③④ | B.②①③④ | C.②①④③ | D.④③②① |
您最近一年使用:0次
2022-05-19更新
|
1500次组卷
|
77卷引用:辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题
辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题2015-2016学年山东省青岛市华侨中学高二上学期10月月考化学试卷青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题福建省南安第一中学2017-2018学年高二上学期期中考试化学试题陕西省咸阳百灵中学2019-2020学年高二上学期期中考试化学(理)试题辽宁省朝阳市凌源市凌源中学2019-2020高一下学期5月考试化学试题辽宁省葫芦岛市2019-2020学年高一下学期期末考试化学试题江西省南昌市第十中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率江西省赣州市会昌县第五中学2020-2021学年高二上学期第一次月考化学试题四川省夹江中学校2020-2021学年高二下学期期中考试化学试题江苏省淮安市车桥中学2021-2022学年高二上学期入学调研(A)化学试题(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)浙江省温州市平阳县万全综合高级中学2021-2022学年高二上学期期中考试化学试题辽宁省鞍山市第一中学2021-2022学年高一下学期期中考试化学试题黑龙江省伊春市伊美区第二中学2022-2023学年高二上学期开学考试化学试题 云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题(已下线)2012-2013学年四川省广安市高一下学期期末考试化学试卷2014-2015学年吉林省长春外国语学校高一下期末化学试卷12014-2015学年吉林省长春外国语学校高一下期末化学试卷22015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷2015-2016学年新疆生产建设兵团二中高一下期中化学试卷2015-2016学年江西省丰城中学高一下学期第二次月考化学试卷2016-2017学年湖北省七校(荆州中学、襄阳五中、襄阳四中等)高一下学期期中联考化学试卷河北省秦皇岛市卢龙县2016-2017学年高一下学期期末考试化学试题黑龙江省哈尔滨市第六中学2016-2017学年高一下学期期末考试化学试题2017-2018学年高一化学人教版必修2:第二章检测题《课时同步君》2017-2018学年高一化学人教必修2-2.3.1 化学反应的速率(已下线)《周末培优君》2017-2018学年高一下学期化学-第07周 化学反应的速率和限度【全国市级联考】江苏省宿迁市2017-2018学年高一下学期期中考试化学试题【全国市级联考】黑龙江省齐齐哈尔市2017-2018学年高一下学期期末考试化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题1山西省长治市沁县中学2018-2019学年高一下学期期中考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题吉林省吉林市第五十五中学2018-2019学年高一下学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 影响化学反应速率的因素(强化练习)2020年人教版高中化学必修2第二章《化学反应与能量》测试卷26.2.1 化学反应的速率——2020年春高一新人教版第二册化学一课一练(已下线)【南昌新东方】2019 南昌二中 高一下 第二次月考山东省烟台市第二中学2019-2020学年高一下学期4月月考化学试题四川省成都外国语学校2019-2020学年高一下学期开学考试化学试题湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题2020年春高一化学新人教版第二册课后同步:6.2.1 化学反应的速率福建省莆田第二十四中学2019-2020学年高一化学下学期期中测试卷黑龙江省牡丹江市第一高级中学2019-2020学年高一下学期5月线上月考化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题甘肃省张掖市高台县第一中学2019-2020学年高一下学期期中考试化学试题山东省烟台市第三中学2019-2020学年高一下学期4月月考化学试题陕西省渭南市临渭区铁路自立中学2019-2020学年高一下学期5月月考化学试题山东省临沂第一中学2019-2020学年高一下学期期中考试化学试题甘肃省平凉市庄浪县第一中学2019-2020学年高一下学期期中考试化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 方法帮(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率湖北省襄阳市第五中学2019-2020学年高一下学期6月月考化学试题兰州市第二十七中学2020-2021学年高一下学期期中考试化学试题四川省乐山市十校2020-2021学年高一下学期期中联考化学试题黑龙江省嫩江市第一中学校等五校2020-2021学年高一下学期期中联考化学试题安徽省合肥市六校2020-2021学年高一下学期期末教学质量检测化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第09讲 化学反应速率(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)(已下线)6.1.2 化学反应速率(第2课时 影响化学反应速率的因素)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)(已下线)第13讲 化学反应速率(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)课后-6.2.1 化学反应的速率-人教2019必修第二册湖北省襄阳市第三十六中学2021-2022学年高一下学期期中考试化学试题宁夏回族自治区银川一中2021-2022学年高一下学期期中考试化学试题北京市清华大学附属中学2021-2022学年高一下学期期中考试化学试题山东省济宁市泗水县2021-2022学年高一下学期期中考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题山东师范大学附属中学2021-2022学年高一下学期期中考试(等级考)化学试题内蒙古自治区包头市2020-2021高一下学期期末教学质量检测试卷化学试题重庆市二0三中学2021-2022学年高一下学期第二次月考化学试题山东省聊城市颐中外国语学校2021-2022学年高一下学期期中考试化学试题(已下线)专题03 化学反应速率与化学平衡(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)
名校
解题方法
3 . 如图曲线表示一定条件下可逆反应X(g)+ Y(g)  2Z(g) + W(s) ΔH<0 的反应过程。若使a曲线变为b曲线,可采取的措施是
2Z(g) + W(s) ΔH<0 的反应过程。若使a曲线变为b曲线,可采取的措施是
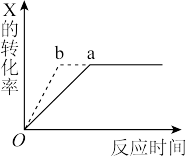
 2Z(g) + W(s) ΔH<0 的反应过程。若使a曲线变为b曲线,可采取的措施是
2Z(g) + W(s) ΔH<0 的反应过程。若使a曲线变为b曲线,可采取的措施是
| A.加入催化剂 | B.增大Y的浓度 |
| C.降低温度 | D.减小体系压强 |
您最近一年使用:0次
2022-01-17更新
|
659次组卷
|
7卷引用:辽宁省大连市2021-2022学年高二上学期期末联考化学试题
辽宁省大连市2021-2022学年高二上学期期末联考化学试题浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题(已下线)2.2.2 影响化学平衡的因素(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)【浙江新东方】96湖南省永州市冷水滩区湖南师范大学附属高阳学校2021-2022学年高二上学期第一次月考化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二上学期期中考试化学试题云南省弥勒市第一中学2021-2022学年高二上学期期末考试化学试题
4 . 某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是


| A.其他条件相同时,催化剂浓度越大,反应速率越大 |
| B.其他条件相同时,降冰片烯浓度越大,反应速率越大 |
C.条件①,反应速率为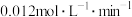 |
D.条件②,降冰片烯起始浓度为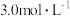 时,半衰期为 时,半衰期为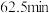 |
您最近一年使用:0次
2021-09-13更新
|
11357次组卷
|
47卷引用:辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题
辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题辽宁省实验中学2021-2022学年高二上学期期中考试化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题2021年新高考辽宁化学高考真题江西省南昌八一中学2021-2022学年高二上学期10月份月考化学试题四川省成都市树德中学2021-2022学年高二上学期10月阶段性测试化学试题江西省南昌市莲塘第一中学2021-2022学年高二上学期9月质量检测化学试题2021年辽宁高考化学试题变式题11-19(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能河南省中原名校2022-2023学年高二上学期第一次联考化学试题山西省太原市第五中学校2022-2023学年高二上学期10月月考化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题内蒙古自治区呼伦贝尔市鄂温克族自治旗第三中学2021-2022学年高二上学期第一次月考化学试题湖南省株洲市第八中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期期末考试化学试题山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题浙江省绍兴市2021-2022学年高三上学期11月选考科目诊断性考试化学试题广东省广州市华南师范大学附属中学2021-2022学年高三上学期第三次月考(11月)化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)山东省淄博市2022届高三下学期第一次模拟考试化学试题(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)湖南省娄底市2022届高三上学期第二次模拟考试化学试题(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第16练 化学反应的速率与限度-2023年高考化学一轮复习小题多维练(全国通用)安徽省芜湖市第一中学2021-2022学年高一下学期期中考试化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第七章 化学反应速率与化学平衡 第40讲 化学反应速率福建省三明市五县联合质检2022-2023学年高一下学期期中考试化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第1讲 化学反应速率及其影响因素(已下线)考点1 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省深圳市宝安区2023-2024学年高三上学期第一次调研测试化学试题浙江省2023-2024学年高三上学期2月 模拟选考化学试题
名校
5 . 已知反应X(g)+3Y(g) ⇌2Z(g) △H的能量变化如下图所示。下列说法正确的是


| A.△H= E2- E1 | B.更换高效催化剂,E3不变 |
| C.恒压下充入一定量的氦气n(Z)减少 | D.压缩容器,c(X)减小 |
您最近一年使用:0次
2021-08-11更新
|
1499次组卷
|
23卷引用:辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题
辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】辽宁省实验中学2019-2020学年高一下学期期中考试化学试题河南省漯河市漯河实验高中2020-2021学年高二上学期期中考试化学试题广东省湛江市2020-2021学年高二下学期期末调研考试化学试题(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题陕西省榆林市子洲中学2021-2022学年高二上学期期中考试化学试题山东省潍坊实验中学2022-2023学年高二上学期第一次单元过关检测化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题云南省昆明市寻甸县2022-2023学年高二上学期期中考试化学试题四川省自贡市田家柄中学教育集团2021-2022学年高二下学期入学考试化学试题河南省兰考县第二高级中学2021-2022学年高二上学期期中考试化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题2020届高三化学二轮冲刺新题专练——能量变化的图像分析(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)
名校
6 . 已知可逆反应: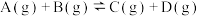
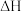 ,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
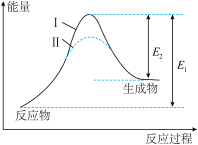
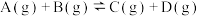
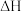 ,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是
A.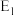 为逆反应的活化能, 为逆反应的活化能, 为正反应的活化能 为正反应的活化能 |
| B.曲线Ⅱ使用了催化剂,降低了反应的焓变 |
C.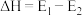 ,该反应为吸热反应 ,该反应为吸热反应 |
| D.活化能越大,反应越容易进行 |
您最近一年使用:0次
2021-07-31更新
|
1254次组卷
|
10卷引用:辽宁省辽东南协作体2021-2022学年高二上学期第一次月考化学试题
辽宁省辽东南协作体2021-2022学年高二上学期第一次月考化学试题选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素(已下线)第2章 化学反应速率与化学平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题广东省梅州市大埔县虎山中学2021-2022学年高二上学期第一次段考(10月)化学试题2.1.2影响化学反应速率的因素 课后黑龙江省鹤岗市第一中学2022-2023学年高二上学期11月期中考试化学试题宁夏吴忠中学2023-2024学年高二上学期11月期中考试化学试题云南省大理市大理白族自治州民族中学2023-2024学年高二上学期12月月考化学试题新疆维吾尔自治区喀什市第十四中学2023-2024学年高二上学期1月期末质量检测化学试题
7 . 对于反应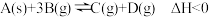 ,下列说法正确的是
,下列说法正确的是
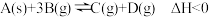 ,下列说法正确的是
,下列说法正确的是| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.该反应△S>0,△H<0,在任何条件下能自发进行 |
| C.恒温恒容条件下,混合气体密度不变达到化学平衡状态 |
| D.达到平衡状态后,若增加A的量,平衡向正反应方向移动 |
您最近一年使用:0次
2021-06-28更新
|
919次组卷
|
6卷引用:辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题
辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题浙江省嘉兴市2020-2021学年高二下学期期末检测化学试题(已下线)第二章 第四节 化学反应进行的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)专题2.3 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)浙江省天台中学2021-2022学年高二上学期返校考试化学试题(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
8 . 下列有关化学反应速率的说法中,正确的是
| A.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
| B.用铁片和稀硫酸反应制取H2时,改用铁片和浓硫酸可以加快产生H2的速率 |
| C.二氧化硫的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢 |
| D.100mL2mol·L-1的盐酸与锌反应时,加入适量的NaCl溶液,生成H2的速率不变 |
您最近一年使用:0次
2021-06-24更新
|
2065次组卷
|
11卷引用:辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题
辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题广西玉林市普通中学2020-2021学年高二下学期月考化学试题(已下线)2.1.2 影响化学反应速率的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)云南省昆明市寻甸县2022-2023学年高二上学期期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期第一次月考化学试题广东华侨中学2022-2023学年高二上学期期中考试化学试题山西省山西大学附属中学校2021-2022学年高一下学期4月考化学试题(已下线)第26练 化学反应速率-2023年高考化学一轮复习小题多维练(全国通用)
9 . 在含有Fe3+、S2O 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
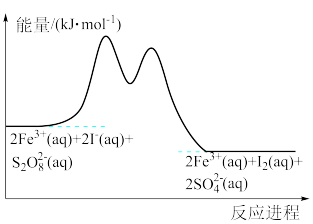
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O (aq)+2Fe2+(aq)=2SO
(aq)+2Fe2+(aq)=2SO (aq)+2Fe3+(aq)
(aq)+2Fe3+(aq)
下列关于该反应的说法错误的是
 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O
 (aq)+2Fe2+(aq)=2SO
(aq)+2Fe2+(aq)=2SO (aq)+2Fe3+(aq)
(aq)+2Fe3+(aq)下列关于该反应的说法错误的是
| A.Fe3+是该反应的催化剂 |
| B.步骤②比步骤①速率快 |
| C.该反应为放热反应 |
| D.若不加Fe3+,则正反应的活化能比逆反应的大 |
您最近一年使用:0次
2021-06-15更新
|
609次组卷
|
5卷引用:辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题
辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河北省承德隆化存瑞中学2021-2022学年高三上学期期中考试化学试题重庆市缙云教育联盟2021-2022学年高三下学期3月质量检测化学试题
名校
10 . Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
| A.反应①的活化能大于反应③的活化能 |
B.反应②的平衡常数K= |
| C.要提高合成COCl2的速率,关键是提高反应③的速率 |
| D.选择合适的催化剂能提高单位时间内COCl2的产率 |
您最近一年使用:0次
2021-01-28更新
|
614次组卷
|
8卷引用:辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题



