解题方法
1 . 化学实验小组同学针对教材中提出的“硫酸铜溶液等对过氧化氢的分解也具有催化作用”进行相关探究。
(1)要证明 溶液可作
溶液可作 分解的催化剂,除需证明
分解的催化剂,除需证明 溶液能改变
溶液能改变 分解的速率外,还需证明
分解的速率外,还需证明 在化学反应前后的
在化学反应前后的________ 不变;
【探究一】:在化学反应前后的质量是否发生改变?
(2)实验小组同学设计了如下实验:将含溶质质量为 的
的 溶液加入一定量的
溶液加入一定量的 溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
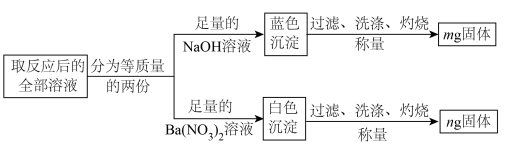
①蓝色沉淀灼烧时发生分解反应,只生成黑色固体和水,该反应的化学方程式________ 。
②流程中生成白色沉淀的化学方程式为________ 。
③若 在化学反应前后质量未改变,则该实验需满足的定量关系为:
在化学反应前后质量未改变,则该实验需满足的定量关系为:
________ (用含m、n的式子表示)。
【探究二】:溶液中起催化作用的是哪种微观粒子?
(3)①【提出猜想】猜想1:起催化作用的是 ;猜想2:起催化作用的是
;猜想2:起催化作用的是________ 。
②【对比实验】设计如图所示实验进行探究。

若观察到________ (填实验现象),则说明猜想1正确。
(1)要证明
 溶液可作
溶液可作 分解的催化剂,除需证明
分解的催化剂,除需证明 溶液能改变
溶液能改变 分解的速率外,还需证明
分解的速率外,还需证明 在化学反应前后的
在化学反应前后的【探究一】:在化学反应前后的质量是否发生改变?
(2)实验小组同学设计了如下实验:将含溶质质量为
 的
的 溶液加入一定量的
溶液加入一定量的 溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
①蓝色沉淀灼烧时发生分解反应,只生成黑色固体和水,该反应的化学方程式
②流程中生成白色沉淀的化学方程式为
③若
 在化学反应前后质量未改变,则该实验需满足的定量关系为:
在化学反应前后质量未改变,则该实验需满足的定量关系为:
【探究二】:溶液中起催化作用的是哪种微观粒子?
(3)①【提出猜想】猜想1:起催化作用的是
 ;猜想2:起催化作用的是
;猜想2:起催化作用的是②【对比实验】设计如图所示实验进行探究。

若观察到
您最近一年使用:0次
名校
2 . 将浓度均为0.01 mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
已知该“碘钟实验”的总反应为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O,反应分A、B两步进行。
+2H2O,反应分A、B两步进行。
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:......
(1)反应B的离子方程式为_______ ,对于总反应,I-的作用相当于_______
(2)为了证明反应A、B的存在,进行实验Ⅰ:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色;
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
则试剂X应该为_______
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
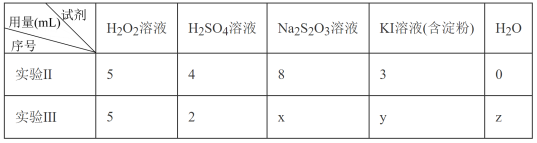
结果为溶液从混合时的无色变为蓝色的时间:实验Ⅱ<实验Ⅲ
① 实验Ⅲ中,x、y、z所对应的数值分别是_______
② 对比实验Ⅱ、实验Ⅲ,可得出的实验结论是_______
已知该“碘钟实验”的总反应为H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O,反应分A、B两步进行。
+2H2O,反应分A、B两步进行。反应A:H2O2+2I-+2H+=I2+2H2O
反应B:......
(1)反应B的离子方程式为
(2)为了证明反应A、B的存在,进行实验Ⅰ:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色;
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
则试剂X应该为_______
| A.KI | B.H2SO4、 | C.KI、淀粉 | D.Na2S2O3溶液、淀粉 |

结果为溶液从混合时的无色变为蓝色的时间:实验Ⅱ<实验Ⅲ
① 实验Ⅲ中,x、y、z所对应的数值分别是
② 对比实验Ⅱ、实验Ⅲ,可得出的实验结论是
您最近一年使用:0次
2021-08-13更新
|
182次组卷
|
2卷引用:重庆市第七中学校2020-2021学年高一下学期半期考试化学试题
13-14高一下·四川雅安·期中
名校
解题方法
3 . 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为_________________________________________ 。
(2)甲同学的实验目的是_____________ ;要得出正确的实验结论,还需控制的实验条件是____________ 。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
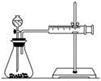
(3)乙同学在实验中应该测定的数据是___________________________________________________ 。
(4)乙同学完成该实验应选用的实验药品是________ ,该实验中不选用某浓度的硫酸,理由是___________ 。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________ 的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________ (填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是

(3)乙同学在实验中应该测定的数据是
(4)乙同学完成该实验应选用的实验药品是
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1625次组卷
|
8卷引用:2013-2014重庆市重庆一中下学期期中考试高二化学试卷
(已下线)2013-2014重庆市重庆一中下学期期中考试高二化学试卷(已下线)2013-2014四川省雅安中学下学期期中考试高一化学试卷新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题
名校
4 . 某反应 的速率方程为
的速率方程为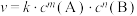 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
 的速率方程为
的速率方程为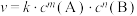 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是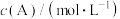 | 0.25 | 0.50 | 1.00 | 0.50 | 1.00 |  |
 | 0.050 | 0.050 | 0.100 | 0.100 | 0.200 |  |
 | 1.6 | 3.2 | 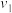 | 3.2 |  | 4.8 |
A.上述表格中的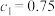 、 、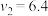 |
B.该反应的速率常数 |
| C.升温、加入催化剂均可使k增大,反应瞬时速率加快 |
| D.在过量的B存在时,当剩余6.25%的A时,所需的时间是375min |
您最近一年使用:0次
2024-01-24更新
|
469次组卷
|
3卷引用:重庆市第七中学校2023-2024学年高三下学期2月月考化学试题
重庆市第七中学校2023-2024学年高三下学期2月月考化学试题2024届浙江省瑞安中学高三上学期首考适应性考试 化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
5 . 研究A的水溶液在密封容器内的分解反应:
Ⅰ.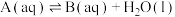 (快)
(快)
Ⅱ. (慢)
(慢)
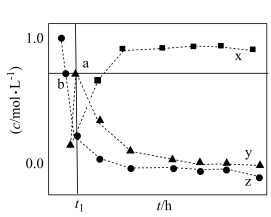
某温度下,在密封容器内完全充满1.0mol/LA溶液,使其分解,分解产物均完全溶于水。A、B、C的浓度与反应时间的变化关系如图所示。反应Ⅰ的平衡常数为5,反应Ⅱ达平衡时 的浓度为wmol/L。下列说法错误的是
的浓度为wmol/L。下列说法错误的是
Ⅰ.
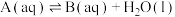 (快)
(快)Ⅱ.
 (慢)
(慢)某温度下,在密封容器内完全充满1.0mol/LA溶液,使其分解,分解产物均完全溶于水。A、B、C的浓度与反应时间的变化关系如图所示。反应Ⅰ的平衡常数为5,反应Ⅱ达平衡时
 的浓度为wmol/L。下列说法错误的是
的浓度为wmol/L。下列说法错误的是
| A.反应Ⅱ的活化能比反应Ⅰ的活化能大 |
| B.曲线x代表物质C |
C.反应Ⅱ达平衡时,体系中B浓度为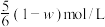 |
| D.若起始时向体系中加入只催化反应Ⅰ的高效催化剂,曲线y的浓度峰值点可能由a变为b |
您最近一年使用:0次
名校
6 . 恒温恒容条件下,对于反应
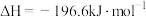 ,能量变化如图所示。下列说法中不正确的是
,能量变化如图所示。下列说法中不正确的是

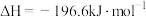 ,能量变化如图所示。下列说法中不正确的是
,能量变化如图所示。下列说法中不正确的是
A.由题意可知,反应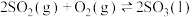 的 的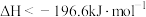 |
B.增大氧气浓度,平衡正向移动,平衡常数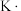 增大 增大 |
| C.与过程I相比,过程II加入了催化剂,增大了活化分子百分数 |
| D.若恒温恒压条件下充入惰性气体,反应速率会降低 |
您最近一年使用:0次
2023-12-14更新
|
268次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高二上学期期中考试化学试题
名校
7 . 某密闭容器中发生如下反应:X(g)+Y(g)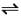 2Z(g) △H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) △H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
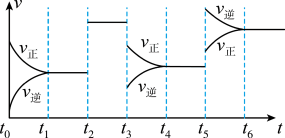
| A.t2时一定加入了催化剂 | B.t3-t4平衡正向移动 |
| C.t5时可能增大了压强 | D.t6之后转化率最低 |
您最近一年使用:0次
名校
8 . 化学与生产、生活息息相关。下列说法不正确的是
A.合成氨工业中,将 及时液化分离有利于提高反应物的利用率 及时液化分离有利于提高反应物的利用率 |
| B.“一斗米、一两曲,加二斗水,相参和,酿七日便成酒”中的“曲”会提高酿酒的转化率 |
C.用 和大量水反应,同时加热,最后焙烧固体制备 和大量水反应,同时加热,最后焙烧固体制备 |
D.废水中的 、 、 等离子可用 等离子可用 处理 处理 |
您最近一年使用:0次
名校
解题方法
9 . 标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知 (g)和
(g)和 (g)的相对能量为0,下列说法不正确的是
(g)的相对能量为0,下列说法不正确的是

 (g)和
(g)和 (g)的相对能量为0,下列说法不正确的是
(g)的相对能量为0,下列说法不正确的是
A.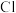 (g)在历程Ⅱ中作催化剂 (g)在历程Ⅱ中作催化剂 |
B.相同条件下, 的平衡转化率:历程Ⅱ>历程I 的平衡转化率:历程Ⅱ>历程I |
C. 的 的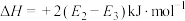 |
D.历程I、历程Ⅱ中速率最快的一步反应的热化学方程式为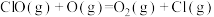  |
您最近一年使用:0次
2023-11-05更新
|
152次组卷
|
4卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
10 . 尿素(分子式 )水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
)水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
 )水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
)水溶液热解产生的NH3可去除尾气中的NOx,流程如下: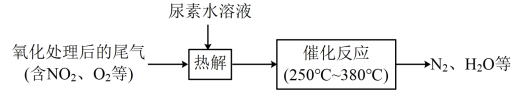
| A.尿素中氮元素的化合价为-3 |
B.“催化反应”过程中NH3还原NO2的化学方程式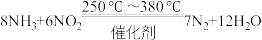 |
| C.若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。硫酸盐的产生是因为SO2被O2、H2O还原成H2SO4,再与NH3反应而得 |
D.“催化反应”过程中需控制温度在 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低 |
您最近一年使用:0次



