1 . 下列关于有效碰撞理论与影响速率因素之间关系正确的是
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 |
| C.温度升高,反应所需活化能减少,反应速率增大 |
| D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 |
您最近一年使用:0次
2 . 下图是我国科研工作者研究MgO(s)与CH4(g)作用最终生成Mg(s)与CH3OH (g)的物质相对能量-反应进程曲线。下列叙述错误的是
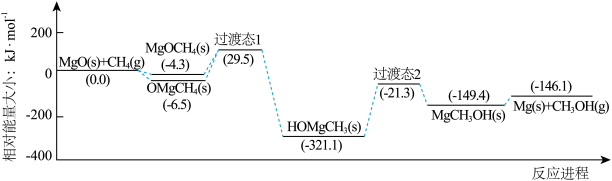

| A.中间体OMgCH4(s)比MgOCH4(s)更稳定 |
| B.MgCH3OH(s)→Mg(s)+CH3OH(g)的速率决定总反应的速率 |
| C.生成HOMgCH3(s)的过程中有极性键的断裂和形成 |
| D.总反应的热化学方程式为MgO(s)+CH4(g)=Mg(s)+CH3OH (g) ΔH= -146.1kJ·mol-1 |
您最近一年使用:0次
3 . 某化学兴趣小组,利用NaHSO3溶液和酸性KMnO4溶液(使用稀H2SO4酸化)反应探究外界因素对化学反应速率的影响。
Ⅰ.原理分析:
(1)反应过程中 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式_______________ 。
(2)实验过程中,NaHSO3的用量要保证足量,通过比较________ (填“实验现象”)所需时间的长短来判断反应的快慢。
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
(3)对比实验①②,使用探究________ 对化学反应速率的影响;若实验②③是用来探究温度对化学反应速率的影响,则V1=________ mL。
(4)若t1=25s,则用HSO 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= ________ 。
Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
(5)为了实验结论的可靠性,试剂X应该选择________。
(6)实验后,若t4_____ t1(填“大于”、“小于”或 “等于”),说明猜想2成立。
Ⅰ.原理分析:
(1)反应过程中
 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式(2)实验过程中,NaHSO3的用量要保证足量,通过比较
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.6mol/L NaHSO3溶液 | 0.2mol/L酸性KMnO4溶液 | 水 | |||
| ① | 25 | 20 | 20 | 10 | t1 |
| ② | 25 | 25 | 20 | 5 | t2 |
| ③ | 50 | V1 | 20 | 5 | t3 |
(3)对比实验①②,使用探究
(4)若t1=25s,则用HSO
 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.5mol/L NaHSO3溶液 | 0.2mol/L 酸性KMnO4溶液 | 试剂X | |||
| ④ | 25 | 20 | 20 | 10 | t4 |
(5)为了实验结论的可靠性,试剂X应该选择________。
| A.MnCl2溶液 | B.MnSO4溶液 |
| C.Mn(NO3)2溶液 | D.Mn(HSO3)2溶液 |
(6)实验后,若t4
您最近一年使用:0次
4 . 制造水煤气时发生可逆反应C(s)+H2O(g) CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是
CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是
 CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是
CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是| A.增大压强 | B.升高温度 | C.增大C的用量 | D.加入催化剂 |
您最近一年使用:0次
名校
5 . 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如下图所示。下列说法不正确 的是
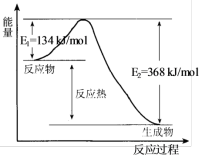

| A.该反应是放热反应 |
| B.该反应的反应热△H=-234kJ/mol |
| C.加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小 |
D.由图可推出:NO(g)+CO2(g)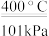 NO2(g)+CO(g) △H=+234kJ/mol NO2(g)+CO(g) △H=+234kJ/mol |
您最近一年使用:0次
名校
6 . 已知反应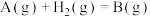 ,在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是
,在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是

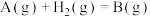 ,在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是
,在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是
A.途径Ⅰ的最大能垒(活化能)为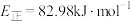 |
| B.该反应为放热反应 |
| C.途径Ⅱ比途径Ⅰ的催化效果好 |
| D.催化剂不能改变该反应的反应热 |
您最近一年使用:0次
2023-10-16更新
|
714次组卷
|
4卷引用:贵州省普通高中部分学校2023-2024学年高二上学期第一次联考化学试题
解题方法
7 . 化学反应速率的影响因素很多。下列因素中对 的化学反应速率影响最显著的是
的化学反应速率影响最显著的是
 的化学反应速率影响最显著的是
的化学反应速率影响最显著的是| A.温度 | B.压强 | C.合适的催化剂 | D.浓度 |
您最近一年使用:0次
2023-10-16更新
|
167次组卷
|
3卷引用:贵州省普通高中部分学校2023-2024学年高二上学期第一次联考化学试题
名校
8 . 人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是
| A.橡胶轮胎中加入防老化剂 |
| B.燃煤中加入CaO |
| C.汽车排气管中使用三元催化器 |
D.制取 时使用催化剂 时使用催化剂 |
您最近一年使用:0次
2023-10-16更新
|
379次组卷
|
10卷引用:贵州省普通高中部分学校2023-2024学年高二上学期第一次联考化学试题
贵州省普通高中部分学校2023-2024学年高二上学期第一次联考化学试题内蒙古部分名校2023-2024学年高二上学期10月联考化学试题山西省部分名校2023-2024学年高二上学期10月联合考试化学试题江西省部分高中学校2023-2024高二上学期10月联考化学试题辽宁省部分学校2023-2024学年高二上学期10月月考化学试卷 江西省吉安市井冈山市宁冈中学2023-2024学年高二上学期11月期中考试化学试题四川省自贡市第一中学校2023-2024学年高二上学期期中考试化学试卷四川省绵阳南山中学实验学校2023-2024学年高二上学期12月月考化学试题广东省惠州一中实验学校2023-2024学年高二上学期期中考试化学试题福建省福州金桥学校2023-2024学年高三上学期期中考试化学试题
9 . 炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。下列说法错误的是
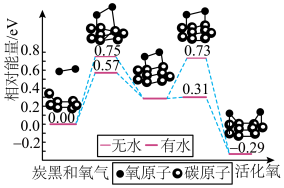

| A.每活化一个氧分子放出能量0.29eV |
| B.无水时正反应的活化能为0.75eV |
| C.水可使氧分子活化反应的活化能降低0.42eV |
| D.氧分子的活化是O-O的断裂与C-O键的生成过程 |
您最近一年使用:0次
10 . 工业制硫酸的关键反应为2SO2(g)+O2(g) 2SO3(g)
2SO3(g)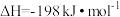 ,在V2O5存在时,该反应的机理为:
,在V2O5存在时,该反应的机理为:
ⅰ.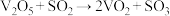 (快) ⅱ.
(快) ⅱ.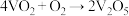 (慢)
(慢)
下列说法正确的是
 2SO3(g)
2SO3(g)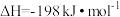 ,在V2O5存在时,该反应的机理为:
,在V2O5存在时,该反应的机理为:ⅰ.
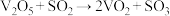 (快) ⅱ.
(快) ⅱ.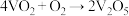 (慢)
(慢)下列说法正确的是
| A.工业生产中应选择低温条件 | B.反应ⅱ是决速步骤 |
| C.逆反应的活化能小于198kJ/mol | D.VO2是该反应的催化剂 |
您最近一年使用:0次



