名校
1 . 关于工业合成 的反应,下列说法正确的是
的反应,下列说法正确的是
 的反应,下列说法正确的是
的反应,下列说法正确的是| A.压缩气体,增大压强,活化分子百分数增大,反应速率加快 |
| B.升高温度,活化分子数增加,活化分子百分数增大,反应速率加快 |
| C.用铁触媒作催化剂,活化分子数增加,活化分子百分数不变,反应速率加快 |
| D.增大体系压强,反应速率加快,平衡正向移动,因此工业上选择压强越高越好 |
您最近一年使用:0次
2023-10-10更新
|
384次组卷
|
3卷引用:贵州省遵义市2023-2024学年高二上学期10月月考化学试题
解题方法
2 . “肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(H2NNH2),其反应历程如下:
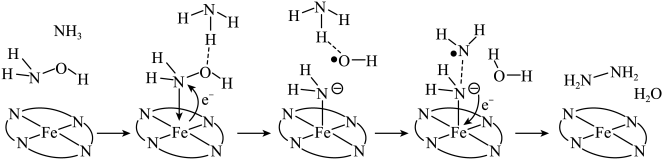
已知肼(H2NNH2)的燃烧热为642 。
。
下列说法错误的是

已知肼(H2NNH2)的燃烧热为642
 。
。下列说法错误的是
| A. H2NNH2中含有非极性键和极性键 |
| B.反应涉及N-H、N-O键断裂和N-N键生成 |
| C.催化中心铁元素的化合价在反应过程中有变化 |
D.肼燃烧热的热化学方程式为: 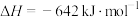 |
您最近一年使用:0次
解题方法
3 .  是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为
是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为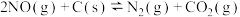 。回答下列问题:
。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的
_____ (填“>”“<”或“=”)0。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中 (mol·L
(mol·L )随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为
)随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为 ℃、
℃、 ℃、
℃、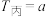 ℃)
℃)
甲容器中,该反应的平衡常数
______ ,丙容器的反应温度a______ (填“>”“<”或“=”)400。
(3)已知:
 。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生
。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生 的量随时间的变化关系如图所示。
的量随时间的变化关系如图所示。
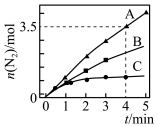
①在催化剂A的作用下0~4min的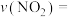
______ 。
②该反应活化能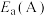 、
、 、
、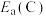 由小到大的顺序是
由小到大的顺序是____________ ,理由是____________ 。
③下列说法不正确的是______ (填字母)。
a.使用催化剂A达平衡时, 值更大
值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
 是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为
是造成大气污染的主要物质,工业上脱硝有多种方法。利用碳还原NO的反应为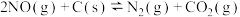 。回答下列问题:
。回答下列问题:(1)该反应在常温下可以自发进行,则反应的

(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中
 (mol·L
(mol·L )随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为
)随时间(s)的变化如下表所示。(已知:三个容器的反应温度分别为 ℃、
℃、 ℃、
℃、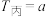 ℃)
℃)| 时间 | 0s | 10s | 20s | 30s | 40s |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| 丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |

(3)已知:

 。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生
。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生 的量随时间的变化关系如图所示。
的量随时间的变化关系如图所示。
①在催化剂A的作用下0~4min的
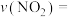
②该反应活化能
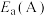 、
、 、
、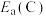 由小到大的顺序是
由小到大的顺序是③下列说法不正确的是
a.使用催化剂A达平衡时,
 值更大
值更大b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
您最近一年使用:0次
2023-07-26更新
|
89次组卷
|
3卷引用:贵州省威宁彝族回族苗族自治县第八中学2023-2024学年高二上学期期中考试化学试卷
4 .  和
和 分别在催化剂1和催化剂2作用下合成
分别在催化剂1和催化剂2作用下合成 的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是
的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是

 和
和 分别在催化剂1和催化剂2作用下合成
分别在催化剂1和催化剂2作用下合成 的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是
的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是
| A.上述两种催化剂没有改变合成氨的反应路径 |
B.图1中的决速步骤为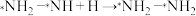 |
| C.图2中有5个放出能量和5个吸收能量的过程 |
| D.使用高效催化剂可以缩短合成氨反应到达平衡的时间 |
您最近一年使用:0次
5 . 工业上,利用正丁烷可以获得乙烯、丙烯等化工原料。
反应1: ;
;
反应2: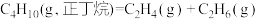 。
。
(1)工业上利用正丁烷获得乙烯、丙烯等化工原料,属于石油炼制方法中的石油的___________ (填分留、裂化或裂解)。
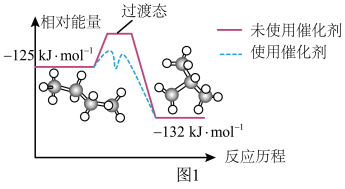
(2)正丁烷和异丁烷之间转化的能量变化如图1所示。下列有关催化剂的叙述错误的是________(填标号)。
(3)丁烷、空气和氢氧化钾溶液组成的燃料电池(如图2所示)是一种高效能的车载电池,则a电极为___________ (填正或负)极,其电极反应式为___________ 。
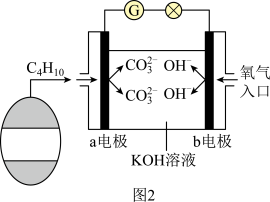
(4)正丁烷分解可生成乙烯。
①乙烯分子中有___________ 个σ键和___________ 个π键,其中碳原子未杂化的___________ 轨道形成π键;
②分子中多一个碳原子且与乙烯互为同系物的有机物M,写出M通入溴的四氯化碳溶液的反应化学方程式___________ 。
反应1:
 ;
;反应2:
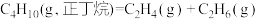 。
。(1)工业上利用正丁烷获得乙烯、丙烯等化工原料,属于石油炼制方法中的石油的
(2)正丁烷和异丁烷之间转化的能量变化如图1所示。下列有关催化剂的叙述错误的是________(填标号)。

| A.能改变反应活化能 | B.能降低反应焓变 |
| C.能加快反应速率 | D.能增大平衡常数 |

(4)正丁烷分解可生成乙烯。
①乙烯分子中有
②分子中多一个碳原子且与乙烯互为同系物的有机物M,写出M通入溴的四氯化碳溶液的反应化学方程式
您最近一年使用:0次
6 . 乙醇催化氧化生成乙醛的机理图如图所示。关于机理中涉及物质的说法正确的是
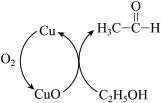
| A.上述机理中所涉及的物质除Cu外均属于分子晶体 |
| B.图中涉及反应包含非极性键和极性键的断裂和生成 |
| C.催化剂Cu的存在改变了反应途径,使不能发生的该过程得以发生 |
| D.乙醇的沸点高于乙醛的沸点,其主要原因是乙醇中存在分子间氢键 |
您最近一年使用:0次
解题方法
7 . 已知工业合成氨的过程中发生,N2 + 3H2 2NH3 △H< 0,其中催化剂的成分有Fe3O4、Al2O3、K2O、CaO等。下列措施既能提高化学反应速率,又能提高H2转化率的是
2NH3 △H< 0,其中催化剂的成分有Fe3O4、Al2O3、K2O、CaO等。下列措施既能提高化学反应速率,又能提高H2转化率的是
 2NH3 △H< 0,其中催化剂的成分有Fe3O4、Al2O3、K2O、CaO等。下列措施既能提高化学反应速率,又能提高H2转化率的是
2NH3 △H< 0,其中催化剂的成分有Fe3O4、Al2O3、K2O、CaO等。下列措施既能提高化学反应速率,又能提高H2转化率的是| A.升高反应温度 | B.充入一定量的H2 |
| C.缩小体积来增大压强 | D.调节催化剂中各物质的比列 |
您最近一年使用:0次
名校
解题方法
8 . 下列过程中,不会使化学反应速率增大的是
A. 与稀硫酸的反应换成浓硫酸 与稀硫酸的反应换成浓硫酸 |
| B.合成氨中使用铁触煤催化剂 |
| C.镀铜的钢管破损 |
| D.大理石与盐酸的反应中将大理石研磨成粉末 |
您最近一年使用:0次
名校
解题方法
9 . 已知化合物A与H2O在一定条件下反应生成化合物B与HCOO−,其反应历程如图所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是
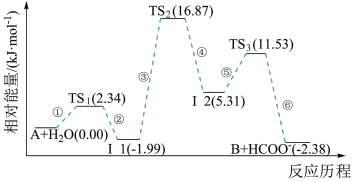
| A.化合物A与H2O之间的碰撞均为有效碰撞 |
| B.平衡状态时,升温使反应逆向移动 |
| C.该历程中的最大活化能E正=16.87kJ·mol-1 |
| D.使用更高效的催化剂可降低反应所需的活化能和反应热 |
您最近一年使用:0次
2022-12-05更新
|
1313次组卷
|
49卷引用:贵州省贵阳市三新改革联盟校2023-2024学年高二上学期10月月考化学试题
贵州省贵阳市三新改革联盟校2023-2024学年高二上学期10月月考化学试题江西省南昌市南昌大学附属中学 2021-2022学年高二上学期第一次月考化学试卷湖南省邵阳市文德高级中学2021-2022学年高二上学期第一次月考化学试题河北省大名县第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省实验中学2021-2022学年高二上学期第一次月考化学试题四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题江西省九江市第三中学2021-2022学年高二上学期第一次月考化学试卷黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题河北饶阳中学2021-2022学年高二上学期第一阶段考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷江西省九校2021-2022学年高二上学期期中联考化学试题吉林省榆树市第一高级中学校2021-2022学年高二上学期10月月考化学试题四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 辽宁省辽河油田第一高级中学2021-2022学年高二(甲部)上学期11月考化学试题江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题河南省温县第一高级中学2021-2022学年高二上学期1月月考化学试题安徽省安庆桐城市第八中学2021-2022学年高二上学期第一次月考化学试题第二章 综合拔高练(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题福建省龙岩市一级校联盟(九校)联考2022-2023学年高二上学期半期考化学试题广东省广州市真光中学2022-2023学年高二上学期期中考试化学试题广东省江门市新会第一中学2022-2023学年高二上学期期中考试化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题浙江省杭州外国语学校2022-2023学年高二上学期期中考试 化学试题新疆昌吉州行知学校2022-2023学年高二上学期期末考试化学试题河南省南阳市2022-2023学年高二下学期期末考试化学试题福建省龙岩市连城县2022-2023学年高二上学期11月期中考试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第一次调研考试化学试题江苏省苏北三市2022-2023学年高二上学期阶段调研测试化学试题四川省成都市天府新区太平中学2022-2023学年高二上学期期中考试化学试题吉林省长春市新解放学校2022-2023学年高二上学期11月月考化学试题陕西省安康市安康中学2023-2024学年高二上学期10月月考化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题陕西省兴平市南郊高级中学2023-2024学年高二上学期第一次质量检测化学试题福建省建瓯市芝华中学2023-2024学年高二上学期期中考试化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题山东省泰安肥城市2021-2022学年高三上学期第一次摸底考试化学试题2021年山东高考化学试题变式题11-20(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试湖南省娄底涟源市第一中学2022届高三下学期四月月考化学试题山东省蓬莱第二中学2021-2022学年高三上学期第一次月考化学试题(已下线)化学反应速率与化学平衡——进阶学习(已下线)选择题11-14
10 . 用酸性 和
和 (草酸)反应研究影响反应速率的因素,其离子方程式为
(草酸)反应研究影响反应速率的因素,其离子方程式为
 。某小组同学设计了如下表的实验方案。
。某小组同学设计了如下表的实验方案。
回答下列问题:
回答下列问题:
(1)上述实验①②是探究__________ 对化学反应速率的影响;上述实验②④是探究__________ 对化学反应速率的影响。上述实验②③可探究__________ 对化学反应速率的影响,且a为__________ 。
(2)实验③中加入amL蒸馏水的目的是________________________________________ 。
(3)除通过测定一定时间内 的体积来比较反应速率外,本实验还可通过测定
的体积来比较反应速率外,本实验还可通过测定____________________ 来比较化学反应速率。
(4)小组同学发现实验②③的反应速率变化趋势如图,其中 时间内速率变快的主要原因可能是①该反应放热、②
时间内速率变快的主要原因可能是①该反应放热、②________________________________________ 。

 和
和 (草酸)反应研究影响反应速率的因素,其离子方程式为
(草酸)反应研究影响反应速率的因素,其离子方程式为 。某小组同学设计了如下表的实验方案。
。某小组同学设计了如下表的实验方案。回答下列问题:
物理量编号 | V(0.20mol/L | V(蒸馏水)/mL | V(0.010mol/L | M( | T/℃ |
① | 2.0 | 0 | 4.0 | 0 | 50 |
② | 2.0 | 0 | 4.0 | 0 | 25 |
③ | 1.0 |
| 4.0 | 0 | 25 |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(1)上述实验①②是探究
(2)实验③中加入amL蒸馏水的目的是
(3)除通过测定一定时间内
 的体积来比较反应速率外,本实验还可通过测定
的体积来比较反应速率外,本实验还可通过测定(4)小组同学发现实验②③的反应速率变化趋势如图,其中
 时间内速率变快的主要原因可能是①该反应放热、②
时间内速率变快的主要原因可能是①该反应放热、②
您最近一年使用:0次
2022-11-27更新
|
131次组卷
|
2卷引用:贵州省部分学校2022-2023学年高二上学期10月联考化学试题

 溶液)/mL
溶液)/mL 溶液)/mL
溶液)/mL 固体)/g
固体)/g


