名校
1 .  转化为NO的过程如图所示。下列说法正确的是
转化为NO的过程如图所示。下列说法正确的是
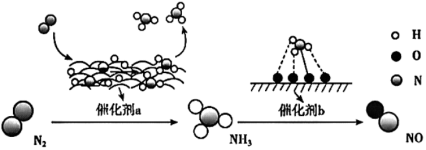
 转化为NO的过程如图所示。下列说法正确的是
转化为NO的过程如图所示。下列说法正确的是
A.催化剂a和b可增大反应的活化能( ) ) |
| B.在催化剂b作用下,氮元素发生了还原反应 |
C.催化剂a、b不会改变反应的焓变( ) ) |
D.催化剂b可提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
2021-08-31更新
|
476次组卷
|
3卷引用:福建省泉州市2022届高三上学期(8月)毕业班质量监测(一)化学试题
名校
2 . 在不同条件下进行 分解实验,
分解实验, 的浓度减少一半所需时间(t)如下表所示,
的浓度减少一半所需时间(t)如下表所示,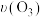 表示该段时间内
表示该段时间内 的平均分解速率。已知
的平均分解速率。已知 的起始浓度为
的起始浓度为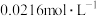 ,下列说法正确的是
,下列说法正确的是
 分解实验,
分解实验, 的浓度减少一半所需时间(t)如下表所示,
的浓度减少一半所需时间(t)如下表所示, 表示该段时间内
表示该段时间内 的平均分解速率。已知
的平均分解速率。已知 的起始浓度为
的起始浓度为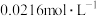 ,下列说法正确的是
,下列说法正确的是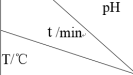 | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
A.依据信息可知, 对 对 分解起催化作用 分解起催化作用 |
B.在30℃、pH=4.0条件下, |
C.50℃、PH=5.5条件下的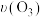 比25℃、pH=6.0条件下的 比25℃、pH=6.0条件下的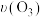 的大 的大 |
D.相同pH条件下,温度每升高10℃,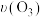 增大一倍 增大一倍 |
您最近一年使用:0次
2021-07-08更新
|
318次组卷
|
2卷引用:福建省龙岩第一中学2021-2022学年高一(实验班)下学期第三次月考化学试题
名校
3 . 氯化硫酰( )常用作氧化剂,它是一种无色液体,熔点:
)常用作氧化剂,它是一种无色液体,熔点: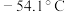 ,沸点:69.1℃,可用干燥的
,沸点:69.1℃,可用干燥的 和
和 在活性炭作催化剂的条件下制取:
在活性炭作催化剂的条件下制取: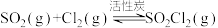
 。下列有关
。下列有关 制取的说法正确的是
制取的说法正确的是
 )常用作氧化剂,它是一种无色液体,熔点:
)常用作氧化剂,它是一种无色液体,熔点: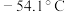 ,沸点:69.1℃,可用干燥的
,沸点:69.1℃,可用干燥的 和
和 在活性炭作催化剂的条件下制取:
在活性炭作催化剂的条件下制取: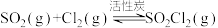
 。下列有关
。下列有关 制取的说法正确的是
制取的说法正确的是| A.该反应在高温下能自发进行 |
| B.使用活性炭作催化剂能缩短该反应达平衡的时间 |
C.反应中每消耗22.4L 转移的电子数目约为 转移的电子数目约为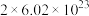 |
D.使 液化从平衡体系中分离,能加快正反应速率,增大 液化从平衡体系中分离,能加快正反应速率,增大 转化率 转化率 |
您最近一年使用:0次
2021-06-27更新
|
507次组卷
|
5卷引用:福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题
福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题广东省珠海市第二中学2022-2023学年高二上学期10月月考化学试题江苏省马坝高级中学2022-2023学年高三上学期9月份质量检测化学试题江苏省无锡市2020-2021学年期高二下学期期终教学质量抽测建议卷化学试题(已下线)专题2.4 化学反应的调控(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
名校
解题方法
4 . 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法不正确的是
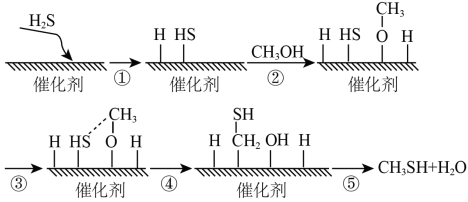

| A.CH3SH为共价化合物 |
| B.该过程中断裂了O—H键、S—H键和C—S键 |
| C.该催化剂可降低该反应的活化能 |
D.该过程的总反应为H2S+CH3OH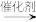 CH3SH+H2O CH3SH+H2O |
您最近一年使用:0次
2021-05-13更新
|
876次组卷
|
14卷引用:福建省连城县第一中学2022届高三上学期第一次月考化学试题
福建省连城县第一中学2022届高三上学期第一次月考化学试题福建省莆田市2021届高三第三次质量检测化学试题山西省2020-2021学年高二下学期5月考试化学试题河南省南阳地区2020-2021学年高二下学期阶段检测考试化学试题湖南省重点中学2020-2021学年高二下学期5月份联合考试化学试题湖南省汨罗市第二中学2021-2022学年高三下学期4月月考化学试题辽宁省朝阳市2021届高三第三次模拟考试化学试题山东省泰安市与济南章丘区2021届高三5月联合模拟考试化学试题(已下线)考点06 原子结构 化学键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点06 原子结构 化学用语-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第07讲 活化能(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)进阶训练4广东省肇庆市百花中学2021届高三下学期5月模拟考试化学试题
名校
5 . 取50 mL过氧化氢水溶液,在少量I−存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2的物质的量浓度(c),如下表:
下列说法不正确 的是
| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L−1) | 0.80 | a | 0.20 | 0.10 | 0.050 |
| A.反应20 min时,测得O2体积为224 mL(标准状况),则a=0.40 |
| B.第30 min时的瞬时速率大于第40 min时的瞬时速率 |
| C.60~80 min,H2O2分解的平均速率为0.0050 mol·(L·min)−1 |
| D.MnO2和FeCl3对H2O2的分解也有催化作用 |
您最近一年使用:0次
2021-04-13更新
|
380次组卷
|
2卷引用:福建省福州市闽侯县第一中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
6 . 在恒压、H2和CO2的起始浓度一定的条件下,用催化剂Ni/xMg(x值越大表示Mg含量越高)催化反应4H2(g)+CO2(g)⇌CH4(g)+2H2O(g),相同时间测得不同温度下CO2的转化率如图所示。下列说法正确的是
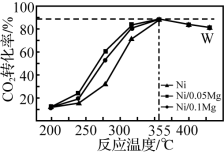

| A.升高温度,平衡逆向移动 |
| B.355℃时,催化剂的活性最强 |
| C.反应足够长时间可提高W点CO2的转化率 |
| D.相同条件下催化剂中Mg的含量越高催化效率越高 |
您最近一年使用:0次
2021-04-04更新
|
666次组卷
|
6卷引用:福建省漳州市正兴学校2023-2024学年高二上学期10月月考化学试卷
福建省漳州市正兴学校2023-2024学年高二上学期10月月考化学试卷福建省福州市福建师范大学附属中学2021-2022学年高二上学期期末考试化学试题山东省烟台市2021届高考一模(诊断性测试)化学试题(已下线)难点5 化学反应速率与化学平衡图表分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)专题09 反应速率、化学平衡-备战2022年高考化学真题及地市好题专项集训【山东专用】河北省邢台市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 . 据文献报道,金红石 Ti3+L3表面催化氮气固定机理如下图所示,下列叙述错误的是
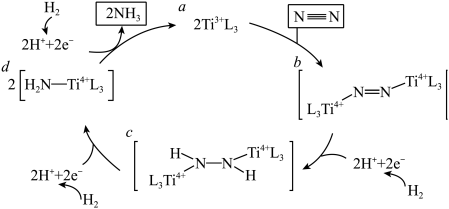

| A.催化剂可以提高固氮速率的原因是改变该反应的 ΔH |
| B.该催化固氮总反应为 3H2+N2=2NH3 |
C.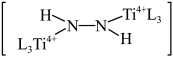 是反应中间体 是反应中间体 |
| D.整个催化过程中存在 N—Ti键的断裂和生成 |
您最近一年使用:0次
2021-03-14更新
|
1271次组卷
|
10卷引用:福建省晋江二中、鹏峰中学、广海中学、泉港五中2022-2023学年高三上学期12月联考化学试题
福建省晋江二中、鹏峰中学、广海中学、泉港五中2022-2023学年高三上学期12月联考化学试题福建省泉州市第七中学2022-2023学年高三上学期期中考化学试题河南省洛阳市2021届高三3月调研考试理综化学试题(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)黑龙江省哈尔滨市第六中学2021届高三下学期第二次模拟考试理科综合化学试题(已下线)第18讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题13 反应机理图(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题二 化学反应机理图象(练)(已下线)热点题型训练 催化剂与反应历程(机理)天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷
名校
解题方法
8 . 我国科研人员提出了由 CO2和CH4转化为CH3COOH的催化反应历程。该催化反应历程示意图如下。下列说法错误的是
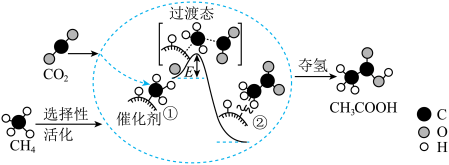

| A.①→②放出能量并形成了C一C键 |
| B.CH4→CH3COOH过程中,有C一H键发生断裂 |
| C.该催化剂可有效提高反应物的平衡转化率 |
| D.生成CH3COOH总反应的原子利用率为100% |
您最近一年使用:0次
2021-02-25更新
|
536次组卷
|
5卷引用:福建省尤溪第一中学2021-2022学年高二上学期第二次月考化学试题
福建省尤溪第一中学2021-2022学年高二上学期第二次月考化学试题 广东省广州市越秀区2020-2021学年高二上学期期末考试化学试题广东省广州市第十六中学2022-2023学年高二上学期期中化学试题(已下线)专题13 反应机理图(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题二 化学反应机理图象(练)
名校
9 . 已知反应CO(g)+2H2(g)  CH3OH(g) ΔH,生成1mol CH3OH(g)的能量变化如图曲线Ⅰ所示。曲线Ⅱ表示使用催化剂的情况。下列判断不正确的是
CH3OH(g) ΔH,生成1mol CH3OH(g)的能量变化如图曲线Ⅰ所示。曲线Ⅱ表示使用催化剂的情况。下列判断不正确的是

 CH3OH(g) ΔH,生成1mol CH3OH(g)的能量变化如图曲线Ⅰ所示。曲线Ⅱ表示使用催化剂的情况。下列判断不正确的是
CH3OH(g) ΔH,生成1mol CH3OH(g)的能量变化如图曲线Ⅰ所示。曲线Ⅱ表示使用催化剂的情况。下列判断不正确的是
| A.ΔH=-91 kJ·mol-1 |
| B.该反应中反应物的总能量高于生成物的总能量 |
| C.按照曲线II历程进行反应,反应速率更快 |
D.CO(g)+2H2(g)  CH3OH(l) ΔH1, 则ΔH1>ΔH CH3OH(l) ΔH1, 则ΔH1>ΔH |
您最近一年使用:0次
2021-01-27更新
|
140次组卷
|
2卷引用:福建省南安市侨光中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
10 . (1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______ (填实验编号); 若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为_______ 和_______ 。
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(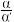 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
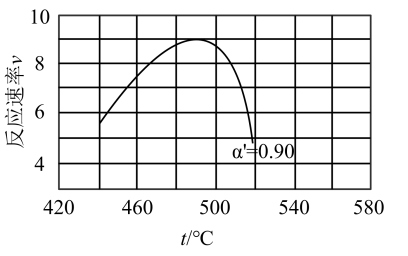
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是_______
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
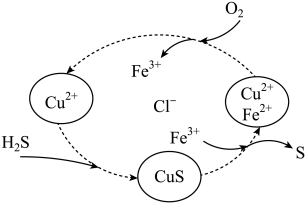
图2
①该循环过程中 Fe3+起的作用是:________ 写出该该反应的化学方程式_______
| 实验 编号 | 实验温 度/℃ | c(Na2S2O3) /(mol·L-1) | V(Na2S2O3) /mL | c(H2SO4) /(mol·L-1) | V(H2SO4) /mL | V(H2O) /mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(
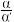 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:

图2
①该循环过程中 Fe3+起的作用是:
您最近一年使用:0次



