名校
1 . I.氢气是一种清洁能源,水煤气变换反应的制氢原理为: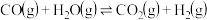
 ,回答下列问题:
,回答下列问题:
(1)水煤气变换部分基元反应如下:
第②步基元反应逆反应的活化能为___________ eV。
(2)某研究所探究CuO/ 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:___________ 。
②C/Z-120曲线先上升后下降的原因___________ 。
II.长征运载火箭推进剂为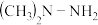 和
和 。
。
(3)在t℃、pMPa下,将 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①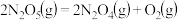 ,②
,②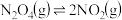 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
___________ MPa。
(4)T℃时,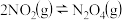 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: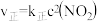 ,
,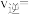
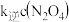 (
( 、
、 这是速率常数)。
这是速率常数)。
①图中表示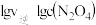 的线是
的线是___________ (填“m”或“n”) 气体,平衡后测得
气体,平衡后测得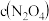 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=________ (用含a的表达式表示)。
③T℃时,向2L的容器中充入5mol 气体和1mol
气体和1mol 气体,此时
气体,此时
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
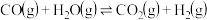
 ,回答下列问题:
,回答下列问题:(1)水煤气变换部分基元反应如下:
| 基元反应 | 活化能Ea(eV) | 反应热△H(eV) |
①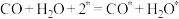 | 0 | -1.73 |
② | 0.81 | -0.41 |
(2)某研究所探究CuO/
 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图: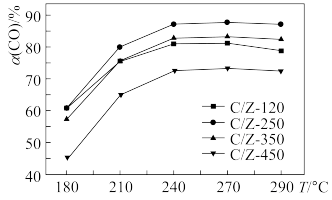
②C/Z-120曲线先上升后下降的原因
II.长征运载火箭推进剂为
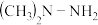 和
和 。
。(3)在t℃、pMPa下,将
 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①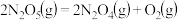 ,②
,②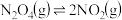 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
(4)T℃时,
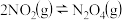 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: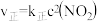 ,
,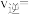
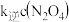 (
( 、
、 这是速率常数)。
这是速率常数)。①图中表示
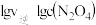 的线是
的线是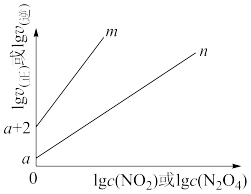
 气体,平衡后测得
气体,平衡后测得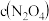 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=③T℃时,向2L的容器中充入5mol
 气体和1mol
气体和1mol 气体,此时
气体,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2022-03-06更新
|
660次组卷
|
4卷引用:福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题山东省日照市 2022届高三第一次模拟考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(山东专用)2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
2 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) ΔH2=-1267.1kJ·mol-1;
c.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH3=-907.3kJ·mol-1
①主反应的ΔH1=_______ kJ·mol-1
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是_______ (填序号)。
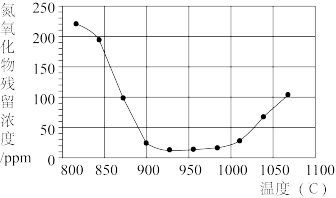
a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_______ 。
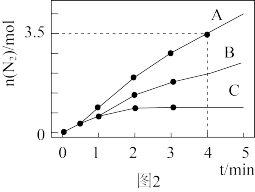
(2)已知:8NH3(g)+6NO2(g)⇌7N2(g) +12H2O(l) ΔH<0.相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______ ,理由是_______ 。
(3)随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。某课题组设计的液体燃料电池示意图如图:
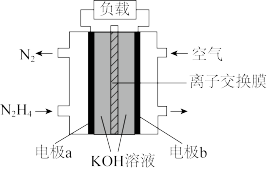
①该电池中通入N2H4的电极为_______ (填“负极”或“正极”), 其电极反应式是_______ 。
②电池工作时,K+移向_______ (填“a”或“b”)。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) ΔH2=-1267.1kJ·mol-1;
c.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH3=-907.3kJ·mol-1
①主反应的ΔH1=
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是

a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是
(2)已知:8NH3(g)+6NO2(g)⇌7N2(g) +12H2O(l) ΔH<0.相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是

(3)随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。某课题组设计的液体燃料电池示意图如图:

①该电池中通入N2H4的电极为
②电池工作时,K+移向
您最近一年使用:0次
名校
解题方法
3 . 十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18 C10H12
C10H12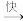 C10H8”的脱氢过程释放氢气。反应Ⅰ:C10H18(l)
C10H8”的脱氢过程释放氢气。反应Ⅰ:C10H18(l) C10H12(l)+3H2(g) ΔH1;反应Ⅱ:C10H12(l)
C10H12(l)+3H2(g) ΔH1;反应Ⅱ:C10H12(l) C10H8(l)+2H2(g) ΔH2;在一定温度下,其反应过程对应的能量变化如图。下列说法正确的是
C10H8(l)+2H2(g) ΔH2;在一定温度下,其反应过程对应的能量变化如图。下列说法正确的是
 C10H12
C10H12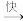 C10H8”的脱氢过程释放氢气。反应Ⅰ:C10H18(l)
C10H8”的脱氢过程释放氢气。反应Ⅰ:C10H18(l) C10H12(l)+3H2(g) ΔH1;反应Ⅱ:C10H12(l)
C10H12(l)+3H2(g) ΔH1;反应Ⅱ:C10H12(l) C10H8(l)+2H2(g) ΔH2;在一定温度下,其反应过程对应的能量变化如图。下列说法正确的是
C10H8(l)+2H2(g) ΔH2;在一定温度下,其反应过程对应的能量变化如图。下列说法正确的是 
| A.总反应的ΔH1=Ea1-Ea2 |
| B.C10H18(1)的脱氢过程中,不会有大量中间产物C10H12(1)积聚 |
| C.十氢萘脱氢的总反应速率由反应Ⅱ决定 |
| D.选择合适的催化剂不能改变Ea1、Ea2的大小 |
您最近一年使用:0次
名校
4 . 我国科研人员研究了不同含金催化剂催化乙烯加氢的反应历程如下图所示(已知反应:C2H4(g)+H2(g)=C2H6(g) △H=akJ·mol-1)
下列说法正确的

下列说法正确的
| A.a=129.6 |
| B.1molC2H4(g)和1molH2(g)的键能之和比lmolC2H6(g)的键能大 |
C.催化乙烯加氢效果较好的催化剂是AuPF |
| D.稳定性:过渡态1>过渡态2 |
您最近一年使用:0次
2022-01-22更新
|
367次组卷
|
5卷引用:福建省连城县第一中学2023-2024学年高二上学期12月月考化学试题
福建省连城县第一中学2023-2024学年高二上学期12月月考化学试题四川省成都市成华区列五中学2022-2023学年高二下学期6月月考化学试题山东省滨州市2021-2022学年高二上学期期末考试化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)河北省秦皇岛市青龙满族自治县青龙部分2023-2024学年高二上学期1月期末化学试题
名校
解题方法
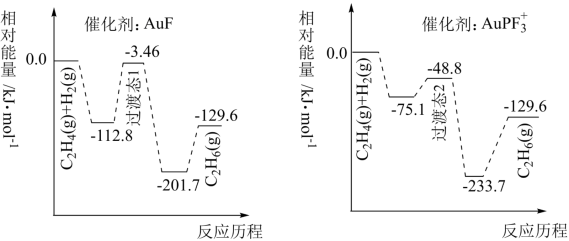
5 . 研究表明汽车尾气处理存在反应:N2O(g)+CO(g)=N2(g)+CO2(g),N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。下列说法不正确 的是
| A.升高温度,该反应的平衡常数减小 |
| B.Fe+不影响该反应的焓变 |
| C.FeO+属于有中间产物,故FeO+不能作为该反应的催化剂 |
| D.Fe++N2O→FeO++N2,FeO++CO→Fe++CO2两步反应,前者反应速率慢 |
您最近一年使用:0次
2021-12-09更新
|
218次组卷
|
3卷引用:福建省长汀县第一中学2021-2022学年高三上学期第三次月考化学试题
名校
6 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性:Cl2>Br2>I2 |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH: ①NaHCO3溶液②CH3COONa溶液 | pH:①>② | H2CO3酸性弱于CH3COOH |
| D | 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0 mol∙L−1的CuSO4溶液和CuCl2溶液中 | CuSO4溶液中无明显现象;CuCl2溶液中反应剧烈,铝片表面有红色物质生成 | 则Cl-能加速破坏铝片表面的氧化膜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是___ 。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是____ (用实验中所提供的几种试剂)。
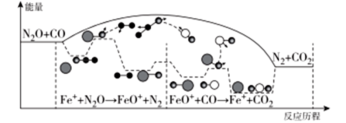
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:
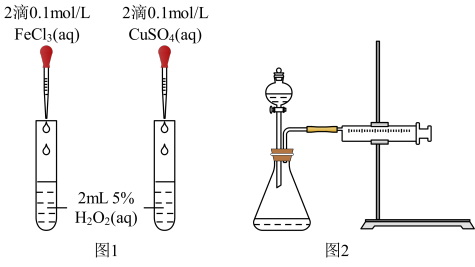
①定性分析:如图1可通过观察____ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是___ 。
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是___ 。
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
①实验结果表明,催化剂的催化效果与___ 有关。
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因___ 。
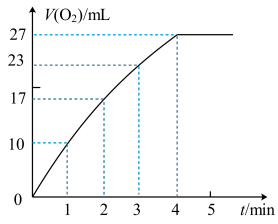
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡;试管B中产生的气泡量增多 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液 | 两支试管中均未明显见到有气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:

①定性分析:如图1可通过观察
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
| MnO2状态 | 触摸锥形瓶情况 | 该温度下针筒内收集到气体的体积 | 所需时间 |
| 粉末状 | 很烫 | 30mL | 3min |
| 块状 | 微热 | 30mL | 9min |
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因
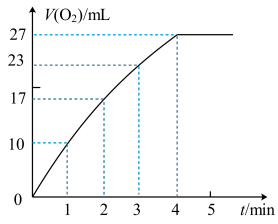
您最近一年使用:0次
名校
解题方法
8 . 以二氧化钛表面覆盖Cu2Al2O4为催化剂,可将CO2和CH4直接转化成乙酸,如图为反应过程中催化剂的催化效率(实线)与乙酸的生成速率(虚线)随温度的变化情况。下列说法不正确的是
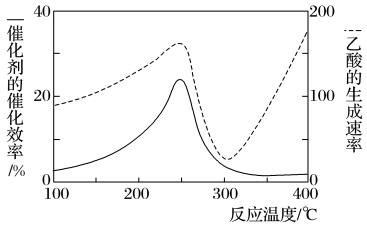

| A.该制备乙酸的反应中,原子利用率为100% |
| B.Cu2Al2O4写成氧化物的形式是Cu2O·Al2O3 |
| C.由图可知,工业上制备乙酸最适宜的温度应为250℃或者400℃ |
| D.250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低 |
您最近一年使用:0次
9 . 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程如图所示(图中只画出了HAP的部分结构,用18O标记羟基磷灰石中的羟基氧原子)。下列说法正确的是
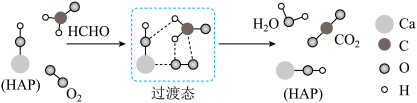

| A.反应物的键能之和大于生成物的键能之和 |
| B.经过该催化氧化过程后18O仍然在HAP中 |
| C.HAP改变了该反应的历程和焓变,加快了反应速率 |
| D.HAP降低了反应的活化能,提高活化分子百分数 |
您最近一年使用:0次
名校
解题方法
10 . 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。下列说法错误 的是


| A.使用催化剂,不能改变反应的焓变 |
| B.决定整个反应速率快慢的是反应① |
| C.B物质比反应物和生成物都稳定 |
| D.该反应的热化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g) ∆H=(Ed-Ea) kJ·mol−1 |
您最近一年使用:0次
2021-09-05更新
|
564次组卷
|
4卷引用:福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题



