1 . 中国提出二氧化碳排放在2030年前达到峰值,2060年前实现碳中和。这体现了中国作为全球负责任大国的环境承诺和行动决心。二氧化碳选择性加氢制甲醇是解决温室效应、发展绿色能源和实现经济可持续发展的重要途径之一、常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注),下列说法错误的是
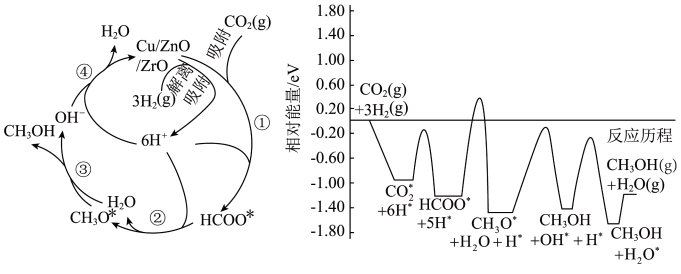
| A.二氧化碳选择性加氢制甲醇是放热反应 |
| B.催化剂能改变反应机理,加快反应速率,降低反应热 |
| C.总反应为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) |
| D.该历程的决速步为HCOO*+4H*=CH3O*+H2O |
您最近半年使用:0次
2 . 劳动创造美好生活。下列与劳动项目相关的解释正确的是
选项 | 劳动项目 | 解释 |
A | 厨师用酵母菌发酵面粉 | 催化剂可以加快反应速率 |
B | 医护人员利用酒精消毒 | 乙醇具有强氧化性 |
C | 工人向食品包装袋内充 |
|
D | 保洁员用84消毒液清洗公共桌椅 | 84消毒液中的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
3 . 从科技前沿到日常生活,化学无处不在。下列说法不正确的是
| A.今年诺贝尔化学奖授予量子点研究,2nm~20nm硅量子点属于纳米材料 |
| B.中科院研发出水煤气直接转化为烯烃的催化剂,催化剂能改变反应历程 |
C.我国在世界上首次将 合成淀粉,合成中发生了氧化还原反应 合成淀粉,合成中发生了氧化还原反应 |
D.自来水厂用系列水处理剂净化水,明矾与 都属于杀菌消毒剂 都属于杀菌消毒剂 |
您最近半年使用:0次
解题方法
4 . 钢铁冶炼所排放的烟气是造成雾霾的主要大气污染物,其中含有 (
( 以上为
以上为 )。
)。
回答下列问题:
(1)目前,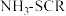 R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是:
R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是:
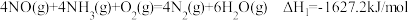
已知: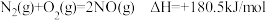 。
。
写出 被
被 直接氧化为
直接氧化为 的热化学方程式
的热化学方程式____________________ 。
(2)对于含 的烟气,可以直接利用
的烟气,可以直接利用 还原
还原 (
( 脱硝技术),生成
脱硝技术),生成 和
和 ,实现“以废治废”。右图为
,实现“以废治废”。右图为 还原
还原 过程的能量图。
过程的能量图。
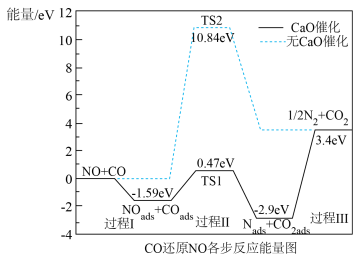
①“ads”表示吸附态,“*”表示催化剂活性表面。在 催化的条件下,反应可分为三个过程:
催化的条件下,反应可分为三个过程:
过程I: ;
;
过程Ⅱ:____________________ ;
过程Ⅲ: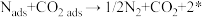 。
。
过程I为__________ 反应(填“吸热”或“放热”),整个反应的决速步为过程__________ (填“I”或“Ⅱ”或“Ⅲ”)。
②对比无 催化的过程,有催化剂
催化的过程,有催化剂 的吸附利于键的断裂
的吸附利于键的断裂__________ (填“N—O”或“C—O”),从而降低反应能垒。
(3)科研团队研究了在 催化作用下烟气(含
催化作用下烟气(含 )中
)中 含量对
含量对 去除率的影响,结果如下图所示。
去除率的影响,结果如下图所示。
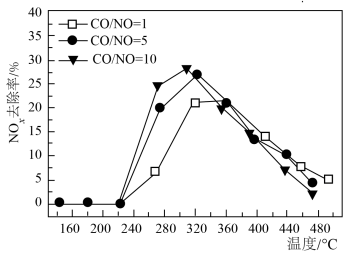
①在 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率增大,原因是
去除率增大,原因是__________ 。
②在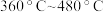 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率差别不大,可能的原因是
去除率差别不大,可能的原因是_________ 。
(4)向某恒温恒容的密闭容器内按照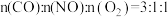 投料,若初始压强为
投料,若初始压强为 ,模拟上述脱硝反应(忽略
,模拟上述脱硝反应(忽略 变化),平衡时脱硝率达到
变化),平衡时脱硝率达到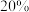 ,则脱硝反应的
,则脱硝反应的
____ (列出计算式)
 (
( 以上为
以上为 )。
)。回答下列问题:
(1)目前,
 R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是:
R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是: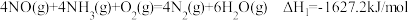
已知:
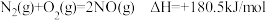 。
。写出
 被
被 直接氧化为
直接氧化为 的热化学方程式
的热化学方程式(2)对于含
 的烟气,可以直接利用
的烟气,可以直接利用 还原
还原 (
( 脱硝技术),生成
脱硝技术),生成 和
和 ,实现“以废治废”。右图为
,实现“以废治废”。右图为 还原
还原 过程的能量图。
过程的能量图。
①“ads”表示吸附态,“*”表示催化剂活性表面。在
 催化的条件下,反应可分为三个过程:
催化的条件下,反应可分为三个过程:过程I:
 ;
;过程Ⅱ:
过程Ⅲ:
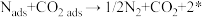 。
。过程I为
②对比无
 催化的过程,有催化剂
催化的过程,有催化剂 的吸附利于键的断裂
的吸附利于键的断裂(3)科研团队研究了在
 催化作用下烟气(含
催化作用下烟气(含 )中
)中 含量对
含量对 去除率的影响,结果如下图所示。
去除率的影响,结果如下图所示。
①在
 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率增大,原因是
去除率增大,原因是②在
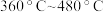 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率差别不大,可能的原因是
去除率差别不大,可能的原因是(4)向某恒温恒容的密闭容器内按照
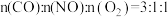 投料,若初始压强为
投料,若初始压强为 ,模拟上述脱硝反应(忽略
,模拟上述脱硝反应(忽略 变化),平衡时脱硝率达到
变化),平衡时脱硝率达到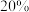 ,则脱硝反应的
,则脱硝反应的
您最近半年使用:0次
解题方法
5 . 向 溶液中通入
溶液中通入 气体至饱和,观察到溶液由棕黄色迅速变为红棕色[经检验无
气体至饱和,观察到溶液由棕黄色迅速变为红棕色[经检验无 胶体],较长时间后变为浅绿色。
胶体],较长时间后变为浅绿色。
已知:①反应I: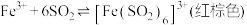
反应II: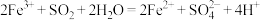
②溶液酸性越强, 溶解度越低
溶解度越低
下列说法正确的是
 溶液中通入
溶液中通入 气体至饱和,观察到溶液由棕黄色迅速变为红棕色[经检验无
气体至饱和,观察到溶液由棕黄色迅速变为红棕色[经检验无 胶体],较长时间后变为浅绿色。
胶体],较长时间后变为浅绿色。已知:①反应I:
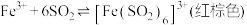
反应II:
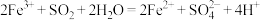
②溶液酸性越强,
 溶解度越低
溶解度越低下列说法正确的是
A.反应II中 体现漂白性 体现漂白性 | B.反应II的活化能比反应I的活化能高 |
C. 在反应I、II中均作氧化剂 在反应I、II中均作氧化剂 | D.向红棕色溶液中滴加浓盐酸,颜色加深 |
您最近半年使用:0次
2023-12-04更新
|
627次组卷
|
3卷引用:四川省宜宾市2024届高三上学期第一次诊断性测试(一模)理综化学试题
四川省宜宾市2024届高三上学期第一次诊断性测试(一模)理综化学试题(已下线)专题01 基本概念-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)福建省厦门市国祺中学2023-2024学年高三上学期第三次月考化学试题
名校
6 . 下列实验方案能达到实验目的的是
| 选项 | A | B | C | D |
| 实验 方案 | 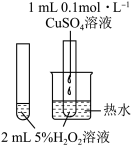 | 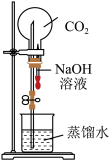 | 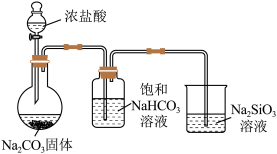 | 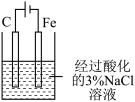 |
| 实验 目的 | 验证CuSO4对H2O2分解反应有催化作用 | 进行喷泉实验 | 验证非金属性:Cl>C>Si | 用铁氰化钾溶液验证牺牲阳极的阴极保护法 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-06-20更新
|
514次组卷
|
2卷引用:四川省成都市石室中学2023届高三下学期高考适应性考试(一)理科综合化学试题
解题方法
7 . NH3还原技术是当今有效且成熟的去除NOx的技术之一。使用钒催化剂、采用NH3还原技术能有效脱除电厂烟气中的氮氧化物,消除NO的可能反应机理如图所示(“ …”表示催化剂吸附)。
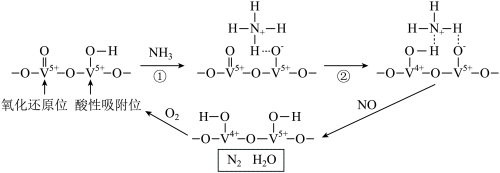
下列说法不正确的是

下列说法不正确的是
A.步骤②可表述为 在催化剂的氧化还原位被还原为 在催化剂的氧化还原位被还原为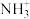 ,而催化剂的氧化还原位被氧化为 ,而催化剂的氧化还原位被氧化为  |
| B.反应过程中消耗1molO2,理论上可处理NO的物质的量为4mol |
| C.钒催化剂能加快反应,但不能提高氮氧化物的平衡转化率 |
| D.该过程中原子利用率未达到100% |
您最近半年使用:0次
解题方法
8 . 以CH3OH(g)和CO2(g)为原料在一定条件下可制备HCOOCH3(g),发生的主要反应如下:
I.CH3OH(g)+CO2(g)⇌HCOOH(g)+HCHO(g) ΔH1=+757kJ·mol-1
Ⅱ.HCOOH(g)+CH3OH(g)⇌HCOOCH3(g)+H2O(g) ΔH2=+316kJ·mol-1
Ⅲ.2HCHO(g)⇌HCOOCH3(g) ΔH3=-162kJ·mol-1
回答下列问题:
(1)反应4CH3OH(g)+2CO2(g)⇌3HCOOCH3(g)+2H2O(g)的ΔH=___________ (用含ΔH1、ΔH2、ΔH3符号的表达式表示)
(2)已知:压强平衡常数(Kp)与温度(T)之间存在定量关系: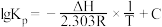 (其中R、C为常数,ΔH为反应的焓变)。反应I、Ⅱ、Ⅲ的lgKp与
(其中R、C为常数,ΔH为反应的焓变)。反应I、Ⅱ、Ⅲ的lgKp与 之间均为线性关系,如图1所示。其中反应Ⅱ对应的曲线为
之间均为线性关系,如图1所示。其中反应Ⅱ对应的曲线为___________ (选填“a”、“b”或“c”)。

(3)T℃时,向体积为VL的恒容密闭容器中充入2molCH3OH(g)和1molCO2(g),发生反应I、Ⅱ、Ⅲ达到平衡时测得容器中n(HCHO)、n(HCOOH)和n(HCOOCH3)分别为0.1mol、0.1mol和1.2mol。
①CH3OH(g)的平衡转化率为___________ 。
②T℃时,反应Ⅱ的平衡常数K=___________ 。
③当温度高于T℃时,HCOOCH3(g)的产率随温度的升高而下降的原因为___________ 。
(4)利用金属Ti的氧化物作催化剂也可实现由CH3OH(g)和CO2(g)合成HCOOCH3(g),其反应机理如图2所示。

①该反应的总反应为:___________ 。
②T℃时,将 的混合气体以aL·h-1的流速通过装有催化剂的反应器,试计算当HCOOCH3(g)的产率为90%时,其生成速率v(HCOOCH3)=
的混合气体以aL·h-1的流速通过装有催化剂的反应器,试计算当HCOOCH3(g)的产率为90%时,其生成速率v(HCOOCH3)=___________ L·h-1。
③若向反应体系中通入适量H2,可大大提高总反应速率,其原因可能为___________ 。
I.CH3OH(g)+CO2(g)⇌HCOOH(g)+HCHO(g) ΔH1=+757kJ·mol-1
Ⅱ.HCOOH(g)+CH3OH(g)⇌HCOOCH3(g)+H2O(g) ΔH2=+316kJ·mol-1
Ⅲ.2HCHO(g)⇌HCOOCH3(g) ΔH3=-162kJ·mol-1
回答下列问题:
(1)反应4CH3OH(g)+2CO2(g)⇌3HCOOCH3(g)+2H2O(g)的ΔH=
(2)已知:压强平衡常数(Kp)与温度(T)之间存在定量关系:
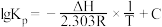 (其中R、C为常数,ΔH为反应的焓变)。反应I、Ⅱ、Ⅲ的lgKp与
(其中R、C为常数,ΔH为反应的焓变)。反应I、Ⅱ、Ⅲ的lgKp与 之间均为线性关系,如图1所示。其中反应Ⅱ对应的曲线为
之间均为线性关系,如图1所示。其中反应Ⅱ对应的曲线为
(3)T℃时,向体积为VL的恒容密闭容器中充入2molCH3OH(g)和1molCO2(g),发生反应I、Ⅱ、Ⅲ达到平衡时测得容器中n(HCHO)、n(HCOOH)和n(HCOOCH3)分别为0.1mol、0.1mol和1.2mol。
①CH3OH(g)的平衡转化率为
②T℃时,反应Ⅱ的平衡常数K=
③当温度高于T℃时,HCOOCH3(g)的产率随温度的升高而下降的原因为
(4)利用金属Ti的氧化物作催化剂也可实现由CH3OH(g)和CO2(g)合成HCOOCH3(g),其反应机理如图2所示。

①该反应的总反应为:
②T℃时,将
 的混合气体以aL·h-1的流速通过装有催化剂的反应器,试计算当HCOOCH3(g)的产率为90%时,其生成速率v(HCOOCH3)=
的混合气体以aL·h-1的流速通过装有催化剂的反应器,试计算当HCOOCH3(g)的产率为90%时,其生成速率v(HCOOCH3)=③若向反应体系中通入适量H2,可大大提高总反应速率,其原因可能为
您最近半年使用:0次
名校
解题方法
9 . 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学的经典反应之一是铜催化的叠氮-炔环加成反应。反应过程如图所示。
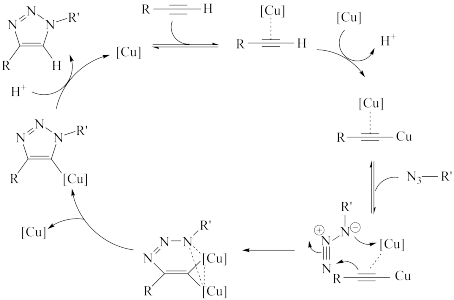
下列说法错误的是

下列说法错误的是
| A.H+是点击反应的中间产物 | B.反应前后碳元素的化合价不变 |
| C.铜催化时点击反应的活化能减小 | D.总反应式为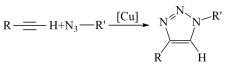 |
您最近半年使用:0次
2023-04-21更新
|
524次组卷
|
5卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)2023年普通高中学业水平选择性考试化学押题卷(三)黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期第四次模拟考试理综化学试题(已下线)选择题16-20广东省深圳外国语学校2024届高三上学期第三次月考化学试题
10 . CO2与氢气在固载金属催化剂上可发生以下反应:
反应i. CO2(g)+H2(g) HCOOH(g) ΔH1
HCOOH(g) ΔH1
反应ii. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2>0
H2O(g)+CO(g) ΔH2>0
反应iii.……
可能的反应机理如下(M为催化剂);

回答下列问题:
(1)反应iii的化学方程式为___________ 。
(2)已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1mol指定产物时所放出的热量):
依据以上信息,ΔH1=___________ 。
(3)在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性= 随温度变化曲线如下图所示。
随温度变化曲线如下图所示。
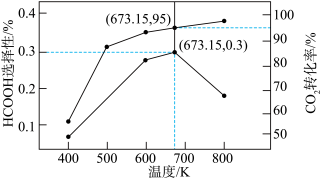
①下列措施能提高CO2平衡转化率的是___________ ( 填标号)。
A.降低温度 B.再充入Ar C.分离出HCOOH
②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp=___________ MPa-1。
③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应___________ (填“ i”或“ii”),判断的理由是___________ 。
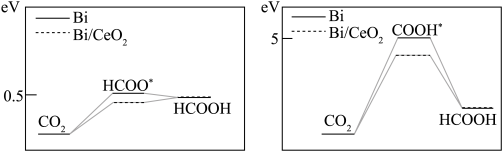
(4)若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成___________ 中间体,且___________ (填 “Bi”或“Bi/CeO2”)的催化活性更优异。
反应i. CO2(g)+H2(g)
 HCOOH(g) ΔH1
HCOOH(g) ΔH1反应ii. CO2(g)+H2(g)
 H2O(g)+CO(g) ΔH2>0
H2O(g)+CO(g) ΔH2>0反应iii.……
可能的反应机理如下(M为催化剂);

回答下列问题:
(1)反应iii的化学方程式为
(2)已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1mol指定产物时所放出的热量):
| 物质 | CO2(g) | H2(g) | HCOOH(g) |
| 标准摩尔生成焓/kJ·mol-1 | -393.51 | 0 | -362.3 |
(3)在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性=
 随温度变化曲线如下图所示。
随温度变化曲线如下图所示。
①下列措施能提高CO2平衡转化率的是
A.降低温度 B.再充入Ar C.分离出HCOOH
②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp=
③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应
(4)若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成

您最近半年使用:0次
2023-04-15更新
|
979次组卷
|
4卷引用:四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题
四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题云南省2023届高三下学期第二次统一检测理科综合化学试题四川省成都外国语学校2023-2024学年高三上学期期中考试理综化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(原理综合题)


 有强氧化性
有强氧化性

