1 . 回答下列问题。
(1)某学习小组同学研究过氧化氢溶液与氢碘酸反应,查到一组室温下的实验数据,如下表所示:
回答下列问题:
①过氧化氢与氢碘酸反应的化学方程式为___________ 。
②该反应的速率方程可表示为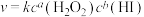 ,对比表中数据可知a=
,对比表中数据可知a=___________ ,b=___________ 。
③该小组同学将实验④的温度升高,发现加热到一定温度下,溶液出现棕黄色所需时间变长,可能的原因是___________ 。
(2)工业上用CH4催化还原NO2可以消除氮氧化物的污染,反应原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
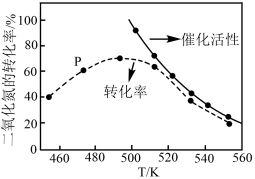
①温度为470K时,图中P点___________ (填“处于”或“不处于”)平衡状态。判断理由是___________ 。490K之后,二氧化氮的转化率随温度升高而减小的原因可能是___________ 。
A.催化剂的活性降低 B.平衡常数变大 C.反应活化能增大
②为提高反应中的二氧化氮的转化率,有人提出可以采取在恒压条件下充入稀有气体,解释其原因:___________ 。
(1)某学习小组同学研究过氧化氢溶液与氢碘酸反应,查到一组室温下的实验数据,如下表所示:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(H2O2) mol/L | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
| c(HI) mol/L | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 从混合至溶液出现棕黄色的时间/s | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
①过氧化氢与氢碘酸反应的化学方程式为
②该反应的速率方程可表示为
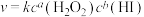 ,对比表中数据可知a=
,对比表中数据可知a=③该小组同学将实验④的温度升高,发现加热到一定温度下,溶液出现棕黄色所需时间变长,可能的原因是
(2)工业上用CH4催化还原NO2可以消除氮氧化物的污染,反应原理为:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
①温度为470K时,图中P点
A.催化剂的活性降低 B.平衡常数变大 C.反应活化能增大
②为提高反应中的二氧化氮的转化率,有人提出可以采取在恒压条件下充入稀有气体,解释其原因:
您最近一年使用:0次
2023-10-10更新
|
168次组卷
|
2卷引用:福建省福清西山学校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
2 . 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2 s内的平均反应速率υ(N2)=_______ 。
(2)达到平衡时NO的转化率为_______ 。
(3)若上述反应在密闭恒容容器中进行,判断该反应达到平衡的依据为_______(填字母)。
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①表中t2=_______ ℃,c1=_______ mol·L−1,c2= _______ mol·L−1。
②三组实验中的浓度随时间的变化如下图所示:
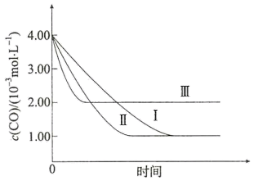
由曲线Ⅰ、Ⅱ可知,其它条件相同时,增大催化剂的比表面积,该化学反应的速率将_______ (填“增大”、“减小”或“无影响”)。由实验Ⅰ和Ⅲ可得出的结论是_______ 。
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L−1 | 1.00×10−3 | 4.50×10−4 | 2.50×10−4 | 1.50×10−4 | 1.00×10−4 | 1.00×10−4 |
| c(CO)/mol·L−1 | 3.60×10−3 | 3.05×10−3 | 2.85×10−3 | 2.75×10−3 | 2.70×10−3 | 2.70×10−3 |
(1)前2 s内的平均反应速率υ(N2)=
(2)达到平衡时NO的转化率为
(3)若上述反应在密闭恒容容器中进行,判断该反应达到平衡的依据为_______(填字母)。
| A.c(N2)不随时间改变 | B.气体的密度不随时间改变 |
| C.压强不随时间改变 | D.单位时间内消耗2 mol NO的同时生成1 mol N2 |
| 编号 | t/℃ | NO初始浓度/mol·L−1 | CO初始浓度/mol·L−1 | 催化剂的比表面积/m2·g−1 |
| Ⅰ | 280 | 6.50×10−3 | 4.00×10−3 | 80.0 |
| Ⅱ | t2 | c1 | 4.00×10−3 | 120 |
| Ⅲ | 350 | 6.50×10−3 | c2 | 80.0 |
②三组实验中的浓度随时间的变化如下图所示:

由曲线Ⅰ、Ⅱ可知,其它条件相同时,增大催化剂的比表面积,该化学反应的速率将
您最近一年使用:0次
2021-11-17更新
|
283次组卷
|
3卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
解题方法
3 . 对于反应:N2(g)+3H2(g) 2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
 2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
2NH3(g)。当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):| 编号 | 改变的条件 | 生成NH3的速率 |
| ① | 升高温度 | |
| ② | 恒容时充入N2 | |
| ③ | 使用催化剂 | |
| ④ | 压缩体积 |
您最近一年使用:0次
2020-12-20更新
|
239次组卷
|
2卷引用:福建省福州市福清市西山学校2020-2021学年高一下学期3月月考化学试题
解题方法
4 . 分析下列实例,根据已有的知识和经验,填如表中。______________
| 实例 | 影响速率的因素 |
| 夏天食物易变质 | |
| 硫在氧气中比在空气中燃烧快 | |
| 粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 | |
| 氯酸钾与二氧化锰混合共热可快速产生氧气 | |
| 工业合成氨通常在高压下进行 |
您最近一年使用:0次
名校
解题方法
5 . 化石燃料燃烧时会产生 SO2进入大气,有多种方法可用于 SO2的脱除。
(1)NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2。
①反应离子方程式是__________________________________________ 。
②为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:
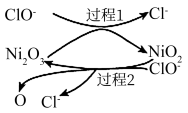
a.过程1的离子方程式是Ni2O3+ClO- =2NiO2 +Cl-,则过程2的离子方程式____________ 。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是________________ 。
(2)碘循环工艺也能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
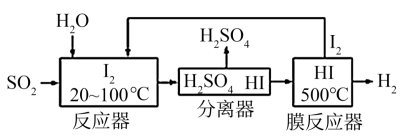
则碘循环工艺的总反应为:___________________________________________ 。
(1)NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2。
①反应离子方程式是
②为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:

a.过程1的离子方程式是Ni2O3+ClO- =2NiO2 +Cl-,则过程2的离子方程式
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是
(2)碘循环工艺也能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

则碘循环工艺的总反应为:
您最近一年使用:0次
2018-11-16更新
|
356次组卷
|
3卷引用:福建省泉州市泉港区第一中学2019届高三上学期第二次月考化学试题



