名校
1 . H2O2是一种绿色试剂,在化学工业中用作生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组欲探究双氧水的性质做了如下实验:MnO2是中学实验中的常用试剂。常用来作为H2O2分解实验的催化剂。
甲同学设计如下实验探究影响双氧水分解反应速率的外界因素。
(1)写出相关反应方程式___________ 。
(2)若 且实验②反应后MnO2的质量和化学性质不变,则实验结论是
且实验②反应后MnO2的质量和化学性质不变,则实验结论是_________________ 。
(3)设计实验①和③的目的是___________________ 。
甲同学设计如下实验探究影响双氧水分解反应速率的外界因素。
| 实验 | 30%的双氧水/ | 温度/℃ | MnO2/g | 收集等体积的O2所用时间/s |
| ① | 20ml | 25 | 0 | a |
| ② | 20ml | 25 | 1 | b |
| ③ | 20ml | 50 | 0 | c |
(2)若
 且实验②反应后MnO2的质量和化学性质不变,则实验结论是
且实验②反应后MnO2的质量和化学性质不变,则实验结论是(3)设计实验①和③的目的是
您最近一年使用:0次
2 . 为了深入探究某个化学问题,往往需要我们会依据一定的原理作出假设,并设计一定的化学实验方案。某化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
[探究一]为探究影响双氧水分解速率的某种因素,A小组记录了如下实验数据:
(1)写出本实验中反应的化学方程式为___________ ;测量 体积的装置是
体积的装置是___________ (选填下图1中的装置编号)。
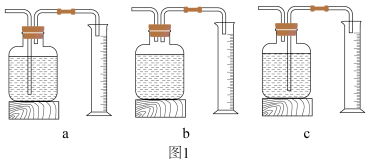
(2)由实验I、Ⅱ、Ⅲ可知:影响双氧水分解速率的因素是:___________
[探究二]B小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。于是他们用天平称量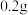 氧化铜,取5%过氧化氢溶液
氧化铜,取5%过氧化氢溶液 于试管中,进行如图2实验:
于试管中,进行如图2实验:
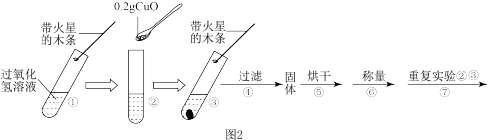
(3)填表:
(4)步骤①的目的是___________ 。
(5)步骤④需用到的玻璃仪器有铁架台(带铁圈)、烧杯、___________ 、___________ 。
(6)步骤⑦中应选用___________ 的过氧化氢溶液。
(7)过氧化氢能将二氧化硫氧化,请写出离子方程式为___________ 。
[探究一]为探究影响双氧水分解速率的某种因素,A小组记录了如下实验数据:
| 双氧水的质量 | 双氧水的浓度 |  的质量 的质量 | 相同时间内产生 的体积 的体积 | |
| I | 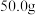 | 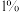 |  |  |
| Ⅱ | 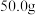 |  |  | 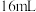 |
| Ⅲ | 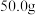 | 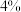 |  | 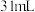 |
(1)写出本实验中反应的化学方程式为
 体积的装置是
体积的装置是
(2)由实验I、Ⅱ、Ⅲ可知:影响双氧水分解速率的因素是:
[探究二]B小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。于是他们用天平称量
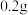 氧化铜,取5%过氧化氢溶液
氧化铜,取5%过氧化氢溶液 于试管中,进行如图2实验:
于试管中,进行如图2实验:
(3)填表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 称得氧化铜的质量为 | 将固体加入盛有过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象。 | 在过氧化氢溶液的分解实验中,氧化铜也能作催化剂。 |
(4)步骤①的目的是
(5)步骤④需用到的玻璃仪器有铁架台(带铁圈)、烧杯、
(6)步骤⑦中应选用
(7)过氧化氢能将二氧化硫氧化,请写出离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图所示。
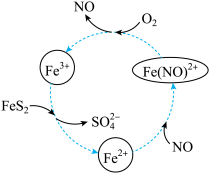
①图中转化过程的总反应中,FeS2作
②写出图中Fe3+与FeS2反应的离子方程式:
(2) Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图所示(图中所示加入1mol是指相同微粒数)。
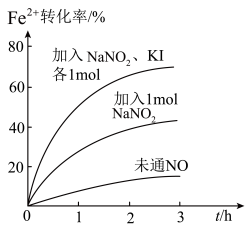
①加入NaNO2发生反应: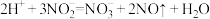 。该反应中若有6个
。该反应中若有6个 离子完全反应,转移
离子完全反应,转移
②加入NaNO2、KI发生反应: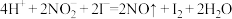 。解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:
。解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:
您最近一年使用:0次
2023-11-11更新
|
122次组卷
|
2卷引用:山东省青岛市第五十八中学2023-2024学年高一上学期10月月考化学试题
名校
4 . 某化学兴趣小组阅读课外资料得知:过氧化氢制氧气除了二氧化锰为催化剂,还可以用氧化铜、马铃薯、铁锈、红砖粉末等物质作为催化剂,于是他们想检验生活中马铃薯是否能作为过氧化氢分解的催化剂。
【提出问题】马铃薯是否能作为过氧化氢分解的催化剂?
【查阅资料】马铃薯中含有过氧化氢酶,过氧化氢酶对过氧化氢的分解起催化剂作用。
【设计实验】化学兴趣小组的同学设计了一系列实验:
(1)设计实验Ⅰ的目的是___________ 。
(2)实验Ⅲ的实验现象是___________ 。
(3)要得出马铃薯可以作为过氧化氢分解的催化剂,还需要做的一步实验是___________ 。
(4)化学兴趣小组还想比较马铃薯和二氧化锰的催化效果,他们又设计了如下实验:
实验Ⅳ和Ⅴ中的待测数据测定除了该方法,还可使用的方法是___________ 。
【得出结论】
(5)___________ 。
【反思交流】
(6)影响上述反应的化学反应速率除了催化剂外,还可能有温度、反应物的浓度等,请选择其中一项用文字叙述一个操作方案来证明:___________ 。
【提出问题】马铃薯是否能作为过氧化氢分解的催化剂?
【查阅资料】马铃薯中含有过氧化氢酶,过氧化氢酶对过氧化氢的分解起催化剂作用。
【设计实验】化学兴趣小组的同学设计了一系列实验:
| 实验 | 实验步骤 | 实验现象 |
| Ⅰ | 取5%的过氧化氢溶液5mL,用带火星的木条伸入试管口 | |
| Ⅱ | 取5%的过氧化氢溶液5mL,加入0.5g马铃薯(切成豆粒大小),用带火星的木条伸入试管口 | 木条复燃 |
| Ⅲ | 待实验Ⅱ中没有气泡放出后,继续加入5%的过氧化氢溶液,用带火星的木条伸入试管口 |
(2)实验Ⅲ的实验现象是
(3)要得出马铃薯可以作为过氧化氢分解的催化剂,还需要做的一步实验是
(4)化学兴趣小组还想比较马铃薯和二氧化锰的催化效果,他们又设计了如下实验:
| 实验 | 5%的过氧化氢溶液 | 催化剂 | 待测数据(排水法收集100mL氧气所需时间) | |
| Ⅳ | 15mL | 二氧化锰0.5g | x秒 | 测得x>y |
| Ⅴ | 15mL | 马铃薯0.5g | y秒 | |
【得出结论】
(5)
【反思交流】
(6)影响上述反应的化学反应速率除了催化剂外,还可能有温度、反应物的浓度等,请选择其中一项用文字叙述一个操作方案来证明:
您最近一年使用:0次
解题方法
5 . 化学实验小组同学针对教材中提出的“硫酸铜溶液等对过氧化氢的分解也具有催化作用”进行相关探究。
(1)要证明 溶液可作
溶液可作 分解的催化剂,除需证明
分解的催化剂,除需证明 溶液能改变
溶液能改变 分解的速率外,还需证明
分解的速率外,还需证明 在化学反应前后的
在化学反应前后的________ 不变;
【探究一】:在化学反应前后的质量是否发生改变?
(2)实验小组同学设计了如下实验:将含溶质质量为 的
的 溶液加入一定量的
溶液加入一定量的 溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
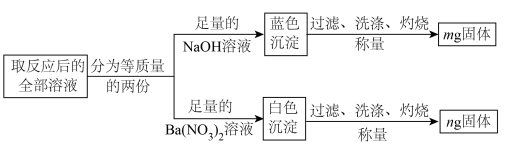
①蓝色沉淀灼烧时发生分解反应,只生成黑色固体和水,该反应的化学方程式________ 。
②流程中生成白色沉淀的化学方程式为________ 。
③若 在化学反应前后质量未改变,则该实验需满足的定量关系为:
在化学反应前后质量未改变,则该实验需满足的定量关系为:
________ (用含m、n的式子表示)。
【探究二】:溶液中起催化作用的是哪种微观粒子?
(3)①【提出猜想】猜想1:起催化作用的是 ;猜想2:起催化作用的是
;猜想2:起催化作用的是________ 。
②【对比实验】设计如图所示实验进行探究。

若观察到________ (填实验现象),则说明猜想1正确。
(1)要证明
 溶液可作
溶液可作 分解的催化剂,除需证明
分解的催化剂,除需证明 溶液能改变
溶液能改变 分解的速率外,还需证明
分解的速率外,还需证明 在化学反应前后的
在化学反应前后的【探究一】:在化学反应前后的质量是否发生改变?
(2)实验小组同学设计了如下实验:将含溶质质量为
 的
的 溶液加入一定量的
溶液加入一定量的 溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
溶液中,取充分反应后的全部溶液继续进行实验,流程如图(实验过程中的损耗忽略不计)。
①蓝色沉淀灼烧时发生分解反应,只生成黑色固体和水,该反应的化学方程式
②流程中生成白色沉淀的化学方程式为
③若
 在化学反应前后质量未改变,则该实验需满足的定量关系为:
在化学反应前后质量未改变,则该实验需满足的定量关系为:
【探究二】:溶液中起催化作用的是哪种微观粒子?
(3)①【提出猜想】猜想1:起催化作用的是
 ;猜想2:起催化作用的是
;猜想2:起催化作用的是②【对比实验】设计如图所示实验进行探究。

若观察到
您最近一年使用:0次
6 . 下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。

请回答下列问题:
(1)装置甲的作用是_______ 。
(2)写出在催化剂表面所发生反应的化学方程式:_______ ,X中所含的气体有_______ 。
(3)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?_______ 。
(4)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是_______ (填字母)。
A.浓硫酸对三氧化硫的吸收效率远好于水,三氧化硫被浓硫酸充分吸收
B.三氧化硫的通气速率太快,三氧化硫未被浓硫酸充分吸收
C.丙中的导气管插得太深,导致三氧化硫未通入丙中

请回答下列问题:
(1)装置甲的作用是
(2)写出在催化剂表面所发生反应的化学方程式:
(3)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?
(4)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是
A.浓硫酸对三氧化硫的吸收效率远好于水,三氧化硫被浓硫酸充分吸收
B.三氧化硫的通气速率太快,三氧化硫未被浓硫酸充分吸收
C.丙中的导气管插得太深,导致三氧化硫未通入丙中
您最近一年使用:0次
名校
解题方法
7 . 页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2)。
已知下列热化学反应方程式:C(s)+2H2(g)=CH4(g);ΔH=-74.5kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-40.0kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g);ΔH=+132.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=_______ kJ·mol-1。
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。

①260℃时生成主要产物所发生反应的化学方程式为_______ 。
②温度高于320℃,CO2的转化率下降的原因是_______ 。
Ⅱ.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图3所示。

(3)Fe2O3脱硫和Fe2O3再生过程可以描述为_______ 。
(4)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是_______ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2)。
已知下列热化学反应方程式:C(s)+2H2(g)=CH4(g);ΔH=-74.5kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-40.0kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g);ΔH=+132.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。

①260℃时生成主要产物所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
Ⅱ.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图3所示。

(3)Fe2O3脱硫和Fe2O3再生过程可以描述为
(4)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
您最近一年使用:0次
解题方法
8 . Ⅰ.化学反应中伴随着能量的变化。
(1)下列变化中属于吸热反应的是________ (填序号)。
①冰融化②碳与水蒸气制取水煤气(CO和H2) ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华 ⑦Ba(OH)2∙8H2O晶体和氯化铵晶体反应
Ⅱ.在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应: ,测得和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
,测得和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。

(2)从反应开始至达到平衡,以CO表示的反应的平均反应速率v(CO)=________ mol·L-1·min-1。下列措施能增大反应速率的是________ (填字母)。
A.升高温度 B.降低压强
C.减小CH3OH的浓度 D.加入合适的催化剂
(3)下列描述中能说明上述反应达到平衡状态的是___________。
(4)已知断开1molCO(g)和2molH2(g)中的化学键需要吸收的能量为1924kJ,则断开1mol CH3OH(g)中的化学键所需要吸收___________ kJ的能量。
(1)下列变化中属于吸热反应的是
①冰融化②碳与水蒸气制取水煤气(CO和H2) ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华 ⑦Ba(OH)2∙8H2O晶体和氯化铵晶体反应
Ⅱ.在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:
 ,测得和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
,测得和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(2)从反应开始至达到平衡,以CO表示的反应的平均反应速率v(CO)=
A.升高温度 B.降低压强
C.减小CH3OH的浓度 D.加入合适的催化剂
(3)下列描述中能说明上述反应达到平衡状态的是___________。
| A.CO、H2和CH3OH三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内消耗2molH2的同时生成1molCH3OH |
您最近一年使用:0次
名校
解题方法
9 . 化学反应过程伴随有热量的变化。
(1)下列反应中属于放热反应的有___________ 。
①燃烧木炭取暖 ②C与H2O(g)反应制取水煤气 ③煅烧石灰石(主要成分是CaCO3)制生石灰 ④氯化铵晶体和Ba(OH)2·8H2O混合搅拌 ⑤食物因氧化而腐败 ⑥盐酸与NaOH溶液反应 ⑦镁与稀硫酸溶液反应
(2)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如下表:
①已知2CH4(g)=C2H4(g)+2H2(g),其中1mol C2H4中存在1mol C=C和4mol C-H键,已知每生成1 mol H2反应吸收83.5 kJ热量,则a=___________ 。
②已知5SO2(g)+2 (aq)+2H2O(l)=2Mn2+(aq)+5
(aq)+2H2O(l)=2Mn2+(aq)+5 (aq)+4H+(aq),每1 mol SO2参加反应放出热量m kJ,那么当放出的热量为n kJ时,该反应转移的电子数为
(aq)+4H+(aq),每1 mol SO2参加反应放出热量m kJ,那么当放出的热量为n kJ时,该反应转移的电子数为___________ 。(用含m、n的代数式表示,NA为阿伏加德罗常数的值。)
(3)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:

①该反应为___________ (填“吸热”或“放热”)反应。
②若要使该反应的反应速率增大,下列措施可行的是___________ (填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.使用催化剂
(4)若将上述反应设计成原电池,则化学反应速率会___________ (填“变大”或“变小”)
铜为原电池某一极材料,则铜为:___________ (填“正”或“负”)极,该极上发生的电极反应为:___________ 。
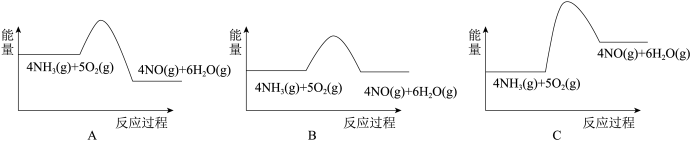
(5)关于氨气的催化氧化反应,先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达700 ℃以上。下列图示中,能够正确表示该反应过程中能量变化的是___________ (填序号),说明断键吸收的能量___________ (填“大于”“小于”或“等于”)成键放出的能量。
(1)下列反应中属于放热反应的有
①燃烧木炭取暖 ②C与H2O(g)反应制取水煤气 ③煅烧石灰石(主要成分是CaCO3)制生石灰 ④氯化铵晶体和Ba(OH)2·8H2O混合搅拌 ⑤食物因氧化而腐败 ⑥盐酸与NaOH溶液反应 ⑦镁与稀硫酸溶液反应
(2)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如下表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
②已知5SO2(g)+2
 (aq)+2H2O(l)=2Mn2+(aq)+5
(aq)+2H2O(l)=2Mn2+(aq)+5 (aq)+4H+(aq),每1 mol SO2参加反应放出热量m kJ,那么当放出的热量为n kJ时,该反应转移的电子数为
(aq)+4H+(aq),每1 mol SO2参加反应放出热量m kJ,那么当放出的热量为n kJ时,该反应转移的电子数为(3)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:

①该反应为
②若要使该反应的反应速率增大,下列措施可行的是
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.使用催化剂
(4)若将上述反应设计成原电池,则化学反应速率会
铜为原电池某一极材料,则铜为:
(5)关于氨气的催化氧化反应,先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达700 ℃以上。下列图示中,能够正确表示该反应过程中能量变化的是

您最近一年使用:0次
名校
10 . 利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 ,化学方程式是:
,化学方程式是: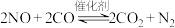
(1)某温度下,在容积不变的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为_______  。
。
(2)反应物初始浓度相同时,实验温度为 和
和 ,进行以下实验:
,进行以下实验:
【实验分析与结论】
①补全表格a._______ ,b._______ ,c._______ ,d._______ 。
②测得 ,对比实验Ⅰ、Ⅱ,可得结论:
,对比实验Ⅰ、Ⅱ,可得结论:_______ 。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是_______ 。
 和
和 转化为
转化为 和
和 ,化学方程式是:
,化学方程式是: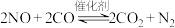
(1)某温度下,在容积不变的密闭容器中通入
 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间 | 0 | 1 | 2 | 3 | …… |
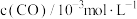 | 3.60 | 3.05 | 2.85 | 2.76 | …… |
 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为 。
。(2)反应物初始浓度相同时,实验温度为
 和
和 ,进行以下实验:
,进行以下实验:| 实验编号 | 实验目的 |  | 同种催化剂的比表面积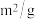 | 一段时间内的平均速率/ |
| Ⅰ | 对照实验 | 280 | 80 | 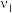 |
| Ⅱ | 研究催化剂比表面积对尾气转化速率的影响 | a | 120 | 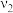 |
| Ⅲ | b | c | d | 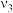 |
①补全表格a.
②测得
 ,对比实验Ⅰ、Ⅱ,可得结论:
,对比实验Ⅰ、Ⅱ,可得结论:③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是
您最近一年使用:0次
2023-07-18更新
|
176次组卷
|
2卷引用:北京市昌平区2022-2023学年高一下学期期末质量抽测化学试题



