名校
解题方法
1 . 肼( )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。
(1)“肼合成酶”以其中的 “配合物为催化中心,可将
“配合物为催化中心,可将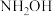 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
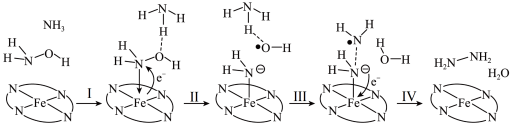
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为___________ 。
②将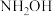 替换为
替换为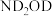 ,反应所得产物的化学式为
,反应所得产物的化学式为___________ 。
(2)在碱性条件下,水合肼( )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:
反应Ⅰ: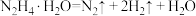
反应Ⅱ: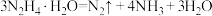
转化频率(TOF)能反映催化剂的性能。
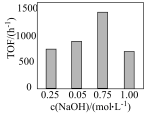
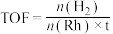 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g- 可由三聚氰胺(
可由三聚氰胺(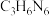 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知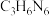 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为___________ 。
②TOF随 变化的原因是
变化的原因是___________ 。
(3)相同条件下,测得 诱导肼、甲肼(
诱导肼、甲肼(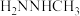 )和偏二甲肼[
)和偏二甲肼[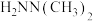 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。
①请补充上表所缺反应产物的结构简式___________ 。
②相较甲肼而言,肼、偏二甲肼与 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是___________ 。
(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应___________ 。

 )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。(1)“肼合成酶”以其中的
 “配合物为催化中心,可将
“配合物为催化中心,可将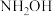 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为
②将
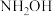 替换为
替换为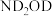 ,反应所得产物的化学式为
,反应所得产物的化学式为(2)在碱性条件下,水合肼(
 )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:反应Ⅰ:
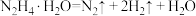
反应Ⅱ:
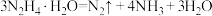
转化频率(TOF)能反映催化剂的性能。
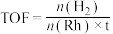 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g-
 可由三聚氰胺(
可由三聚氰胺(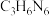 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知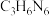 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为②TOF随
 变化的原因是
变化的原因是(3)相同条件下,测得
 诱导肼、甲肼(
诱导肼、甲肼(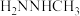 )和偏二甲肼[
)和偏二甲肼[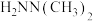 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。| 燃料 | 反应产物 |  | k值 |
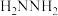 | 5.73 | 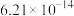 | |
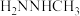 | 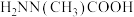 | 14.15 | 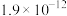 |
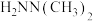 |  | 47.81 | - |
②相较甲肼而言,肼、偏二甲肼与
 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应

您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 已知2SO2(g)+O2(g) 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:
(1)应选择的温度是___________ ,理由是___________ 。
(2)应采用的压强是___________ ,理由是___________ 。
(3)生产中通入过量空气的目的是___________ 。
 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105 Pa | 5×105 Pa | 1×106 Pa | 5×106 Pa | 1×107 Pa | |
| 450 ℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 ℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(2)应采用的压强是
(3)生产中通入过量空气的目的是
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 一个化工生产的过程中只考虑反应的限度问题即可。(______)
您最近一年使用:0次
4 . 合成氨反应选择在700 K左右进行的重要原因是催化剂在700 K左右时的活性最大。(______)
您最近一年使用:0次
2023高三·全国·专题练习
5 . 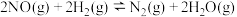 的反应速率表达式为
的反应速率表达式为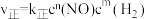 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。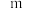 和
和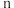 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
(1)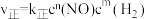 中,m=
中,m=_______ ,n=_______ 。
(2)经研究,有人提出上述反应分两步进行: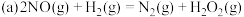 ;
; 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能_______ (填“大于”“小于”或“等于”)(b)正反应活化能。
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式: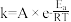 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,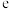 为自然对数的底数,
为自然对数的底数,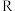 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能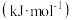 ]。
]。
①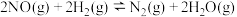 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数_______ (填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
②由此判断下列说法中正确的是_______ (填序号,K正、K逆为正、逆速率常数)。
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
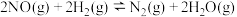 的反应速率表达式为
的反应速率表达式为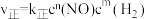 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。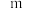 和
和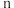 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。为了探究一定温度下 NO、
 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:| 序号 | 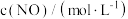 |  | 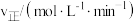 |
| I | 0.10 | 0.10 | 0.414 |
| II | 0.10 | 0.20 | 0.828 |
| III | 0.30 | 0.10 | 3.726 |
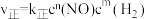 中,m=
中,m=(2)经研究,有人提出上述反应分两步进行:
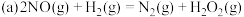 ;
; 。
。化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:
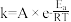 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,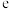 为自然对数的底数,
为自然对数的底数,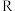 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能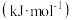 ]。
]。①
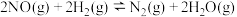 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数②由此判断下列说法中正确的是
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
您最近一年使用:0次
6 . 某储氢合金(M)的储氢机理简述如下:合金吸附H2→氢气解离成氢原子→形成含氢固溶体MHx( 相)→形成氢化物MHy(
相)→形成氢化物MHy(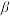 相)。已知:
相)。已知: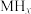 (
( 相)与MHy(
相)与MHy(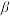 相)之间可建立平衡:
相)之间可建立平衡:

请回答下列问题:
(1)上述平衡中化学计量数k=________ (用含x、y的代数式表示)。
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。
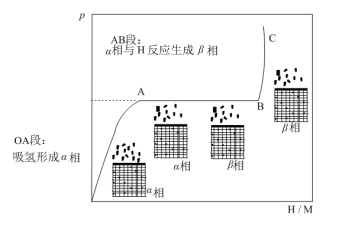
①在________ 温________ 压强下有利于该储氢合金(M)储存H2(填“低”或“高”)。
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=________ mL/(g∙s)。
③关于该储氢过程的说法错误的是________ 。
a.OA段:其他条件不变时,适当升温能提升形成 相的速率
相的速率
b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高 相中氢原子物质的量
相中氢原子物质的量
(3)实验表明,H2中常含有O2、CO2、 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是___________ 。
(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是________________ 。
(5)某镁系储氢合金的晶体结构如图所示:
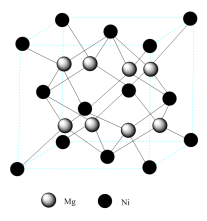
该储氢合金的化学式为________ 。若储氢后每个Mg原子都能结合2个氢原子,则该储氢合金的储氢容量为________ mL/g(储氢容量用每克合金结合标准状况下的氢气体积来表示,结果保留到整数)。
 相)→形成氢化物MHy(
相)→形成氢化物MHy(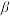 相)。已知:
相)。已知: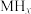 (
( 相)与MHy(
相)与MHy(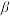 相)之间可建立平衡:
相)之间可建立平衡:
请回答下列问题:
(1)上述平衡中化学计量数k=
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。

①在
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=
③关于该储氢过程的说法错误的是
a.OA段:其他条件不变时,适当升温能提升形成
 相的速率
相的速率b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高
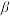 相中氢原子物质的量
相中氢原子物质的量(3)实验表明,H2中常含有O2、CO2、
 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是
(5)某镁系储氢合金的晶体结构如图所示:

该储氢合金的化学式为
您最近一年使用:0次
2022高三·全国·专题练习
真题
名校
7 . 某兴趣小组设计实验探究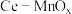 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: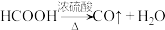

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究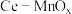 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: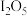 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: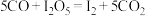 )
)
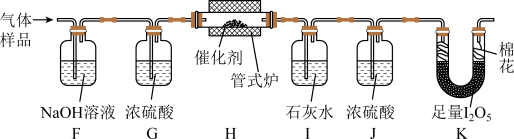
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了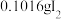 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
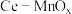 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: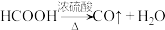

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
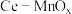 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: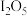 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: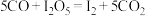 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了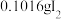 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近一年使用:0次
2023-02-20更新
|
6646次组卷
|
15卷引用:安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)
(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年福建省高考真题化学试题(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题
8 . 钛是航空、军工、电力等领域重要的金属材料。一种由钛铁矿[主要成分是钛酸亚铁(FeTiO3),还含有少量 等杂质]制备金属钛同时获得
等杂质]制备金属钛同时获得 的工艺流程如图:
的工艺流程如图:
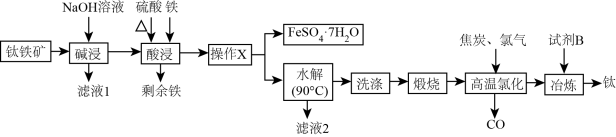
已知:“酸浸”后钛主要以 的形式存在;“水解”后钛以
的形式存在;“水解”后钛以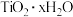 的形式存在。
的形式存在。
回答下列问题:
(1)基态 的最外层电子排布式为
的最外层电子排布式为_______ 。
(2)写出“水解( )”时发生反应的离子方程式:
)”时发生反应的离子方程式:_______ ;验证“洗涤”达到目的的操作为_______ 。
(3)“高温氯化”时发生反应的化学方程式为_______ ;有利于该过程中“气—固—固”接触的措施是_______ (写一种)。某科研小组模拟“高温氯化”反应理论计算结果显示,在 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是_______ (写一种)。
(4)每次取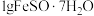 样品,加适量水溶解并加入
样品,加适量水溶解并加入 溶液和
溶液和 溶液,再用
溶液,再用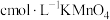 标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液
标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液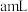 。
。
已知: (黄色)
(黄色)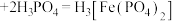 (无色)
(无色)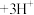 。
。
滴定终点溶液颜色变为_______ ;该样品中 的质量分数为
的质量分数为_______ (填含c,a的表达式)。
 等杂质]制备金属钛同时获得
等杂质]制备金属钛同时获得 的工艺流程如图:
的工艺流程如图:
已知:“酸浸”后钛主要以
 的形式存在;“水解”后钛以
的形式存在;“水解”后钛以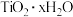 的形式存在。
的形式存在。回答下列问题:
(1)基态
 的最外层电子排布式为
的最外层电子排布式为(2)写出“水解(
 )”时发生反应的离子方程式:
)”时发生反应的离子方程式:(3)“高温氯化”时发生反应的化学方程式为
 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是(4)每次取
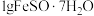 样品,加适量水溶解并加入
样品,加适量水溶解并加入 溶液和
溶液和 溶液,再用
溶液,再用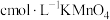 标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液
标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液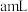 。
。已知:
 (黄色)
(黄色)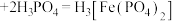 (无色)
(无色)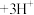 。
。滴定终点溶液颜色变为
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
9 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如下图所示。
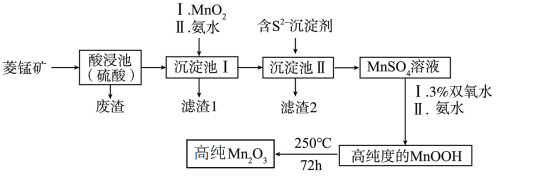
已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
回答下列问题:
(1)为了提高酸浸速率,可采取的措施为_______ (任写2条即可)。
(2)向“沉淀池I”中加入MnO2的作用是_______ ;在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度小于1.0×10-5mol·L-1时,可认为该离子沉淀完全)。
(3)“滤渣2”的主要成分是_______ (填化学式)。
(4)请写出MnSO4转化为MnOOH的离子方程式_______ 。
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为_______ 。
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。


已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)为了提高酸浸速率,可采取的措施为
(2)向“沉淀池I”中加入MnO2的作用是
(3)“滤渣2”的主要成分是
(4)请写出MnSO4转化为MnOOH的离子方程式
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。

| A.反应Ⅱ的方程式为C7H8+36MnO2=7CO2+4H2O+18Mn2O3 |
| B.反应Ⅰ中Mn元素的化合价升高 |
| C.反应Ⅱ中O-H键的形成会吸收能量 |
| D.Mn2O3作催化剂可降低总反应C7H8(g)+9O2(g)=7CO2(g)+4H2O(g)的焓变 |
您最近一年使用:0次
2023-01-12更新
|
166次组卷
|
2卷引用:湖北省部分重点中学2023届高三上学期第二次联考化学试题
21-22高三上·甘肃白银·阶段练习
10 . 铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:

回答下列问题:
(1)绿柱石写成氧化物的形式为___________ 。
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和___________ 。
(3)“水浸”时“产物压碎磨细”的目的是___________ ,为检验“过滤1”的滤液中是否含有Na+,可选用的方法是___________ (填方法名称)。
(4)“沉氟”的化学方程式为___________ 。
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为___________ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是___________ 。

回答下列问题:
(1)绿柱石写成氧化物的形式为
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和
(3)“水浸”时“产物压碎磨细”的目的是
(4)“沉氟”的化学方程式为
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为
您最近一年使用:0次



