真题
名校
1 . 已知反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
 CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是| A.升高温度,K减小 | B.减小压强,n(CO2)增加 |
| C.更换高效催化剂,α(CO)增大 | D.充入一定量的氮气,n(H2)不变 |
您最近一年使用:0次
2017-08-08更新
|
2953次组卷
|
9卷引用:2017年全国普通高等学校招生统一考试化学(海南卷精编版)2
2017年全国普通高等学校招生统一考试化学(海南卷精编版)2山东省师范大学附属中学2017-2018学年高二上学期第六次学分认定(期末)考试(理)化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题山东省惠民县第二中学致远部2020-2021学年高二上学期10月月考化学试题西藏拉萨市第二高级中学2021-2022学年高二上学期期中考试化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题上海市嘉定区安亭高级中学2022-2023学年高二上学期期中考试化学试题宁夏回族自治区贺兰县第二高级中学2023-2024学年高二上学期10月第一次阶段性考试化学试题
2 . 已知:X(g)+2Y(g) 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是| A.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol |
| B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化 |
| C.达到化学平衡状态时,反应放出的总热量可达a kJ |
| D.升高反应温度,逆反应速率增大,正反应速率减小 |
您最近一年使用:0次
2017-04-14更新
|
4479次组卷
|
30卷引用:2017届浙江省高三4月普通高校招生选考科目考试化学试卷
2017届浙江省高三4月普通高校招生选考科目考试化学试卷浙江省2018版考前特训(2017年10月)学考70快练:化学反应速率及反应限度河北省邯郸市成安县第一中学2017-2018学年高二9月月考化学试题黑龙江省哈尔滨市第六中学2018届高三12月月考化学试题浙江省2017届高三新高考选考科目考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期12月月考化学试题重庆市綦江中学2018-2019学年高二上学期第三次月考化学试题(已下线)【新东方】高中化学098浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题浙江省宁波市北仑中学2019-2020学年高一上学期期中考试化学(1班)试题(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》云南省玉溪市峨山彝族自治县第一中学2019-2020学年高二下学期期中考试化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一下学期复学考试化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评浙江省宁波市慈溪市2021届高三适应性测试化学试题(已下线)小题必刷27 化学反应速率、图像及其影响因素——2021年高考化学一轮复习小题必刷(通用版本)(已下线)【浙江新东方】在线化学86高一下(已下线)专题06 化学反应速率和限度【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)浙江省绍兴市柯桥区2020-2021学年高一下学期期末教学质量调测化学试题(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)湖北省罗田第一中学2021-2022学年高二10月月考化学试题山西省太原市2021-2022学年高二上学期期末考试化学试题湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题浙江省强基联盟2021-2022学年高一下学期5月份联考化学试题 浙江省台州市书生中学等三校2022-2023学年高二上学期第一次月考化学试题浙江省金华市艾青中学2021-2022学年高一下学期期末考试化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题广东省湛江市第二十一中学2023-2024学年高二上学期期中考试化学试题
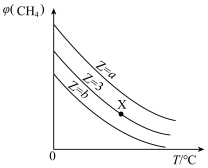
3 . 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始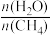 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
 CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始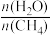 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
| A.该反应的焓变ΔH>0 |
| B.图中Z的大小为a>3>b |
C.图中X点对应的平衡混合物中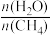 =3 =3 |
D.温度不变时,图中X点对应的平衡在加压后 (CH4)减小 (CH4)减小 |
您最近一年使用:0次
2016-12-09更新
|
5198次组卷
|
59卷引用:2016年全国普通高等学校招生统一考试化学(四川卷精编版)
2016年全国普通高等学校招生统一考试化学(四川卷精编版)(已下线)2016年全国普通高等学校招生统一考试化学(四川卷参考版)2015-2016学年河南省南阳一中高二下期末模拟化学试卷2015-2016学年吉林省松原市油田高中高一下期末化学试卷2015-2016学年青海乐都一中高二下期末化学试卷2017届河北省沧州市第一中学高三上周测化学试卷2016-2017学年浙江省嘉兴一中高二上期中化学试卷2017届河南省郑州一中高三上期中化学试卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2016-2017学年江西省师大附中高二上学期期中化学试卷2016-2017学年河南省南阳市第一中学高二下学期开学考试化学试卷河北省衡水中学2016-2017学年高一下学期三调考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第二次月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题河北省正定中学2017届高三上学期第三次月考化学试题宁夏银川一中2017-2018学年高二上学期期末考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高二上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高二化学上学期期末考试试题福建省泉州市泉港区第一中学2017-2018学年高二年上学期期末考化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题(已下线)《考前20天终极攻略》-5月25日 化学反应速率与化学平衡(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题(已下线)2019年4月13日《每日一题》三轮复习—— 周末培优甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题广东省-北京师范大学东莞石竹附属学校2019-2020学年高二10月月考化学试题广西宾阳县宾阳中学2019-2020学年高二9月月考化学试题步步为赢 高二化学寒假作业:综合检测(二)广东省广州市天河中学2019-2020学年高二上学期能力性考试(11月月考)化学试题四川省南充高级中学2019-2020学年高二3月线上月考理综化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省哈尔滨师范大学附属中学2019-2020学年高二10月月考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素山东省莱芜一中2021届高三第一次考试化学试题重庆市南开中学2020-2021学年高二上学期期中模拟测试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考黑龙江省青冈县第一中学2020-2021学年高二上学期月考(腾飞班)化学试题广东省揭阳市第三中学2020-2021学年高二上学期期中考化学试题福建省泉州市泉港区第一中学2020-2021学年高二上学期期中考试化学试题山东省东营市胜利第二中学2020-2021学年高二上学期期中考试化学试题青海省湟川中学2020-2021学年高二上学期期中考试化学试题黑龙江省密山四中2020-2021学年高二下学期期末考试化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)2.2.2 影响化学平衡的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)吉林省白城市第一中学2021-2022学年高二上学期9月阶段考试化学试题广东省广州市真光中学2020-2021学年高二上学期期中化学试题江西省宜春中学2021-2022学年高二上学期第一次月考化学试题陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题北京市第二中学2022-2023学年高二上学期10月月考化学试题黑龙江省饶河县高级中学2022-2023学年高二上学期第一次月考化学试题吉林省洮南市第一中学2022-2023学年高二上学期期中考试化学试题河南宏力学校2021-2022学年高二上学期期中考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)山东省临沂第一中学2020-2021学年高三上学期第一次检测化学试题(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
真题
4 . 对于可逆反应H2(g)+I2(g) 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是
 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是| A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B.正、逆反应速率的比值是恒定的 |
| C.反应进行的净速率是正、逆反应速率之差 |
| D.达到平衡时,正、逆反应速率相等 |
您最近一年使用:0次
2016-12-09更新
|
311次组卷
|
2卷引用:2011年普通高等学校招生全国统一考试化学(海南卷)
真题
名校
5 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
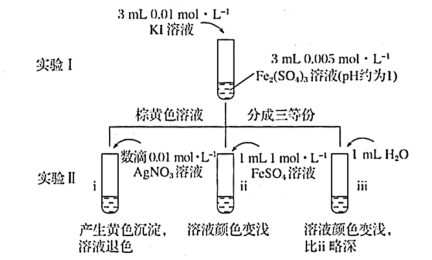
(2)iii是ii的对比试验,目的是排除有ii中
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因:
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用下图装置(a、b均为石墨电极)进行实验验证。
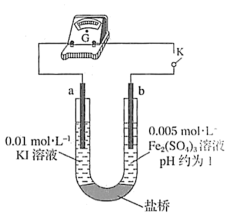
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是
②与(4)实验对比,不同的操作是
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是
您最近一年使用:0次
2016-12-09更新
|
3847次组卷
|
11卷引用:2015年全国普通高等学校招生统一考试化学(北京卷)
2015年全国普通高等学校招生统一考试化学(北京卷)2016届黑龙江省哈尔滨三中高三上学期第二次检测化学试卷北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题北京市育才学校2020-2021学年高二上学期12月考化学试题(已下线)北京市第四中学2022-2023高二上学期期中考试化学试题山西省长治市第二中学校2022-2023学年高三上学期第四次月考化学试题北京市丰台区2022-2023学年高二上学期期中考试化学(A卷)试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题北京市海淀区八一学校2021-2022学年高二上学期期中考试化学试题北京师范大学附属昌平学校2023-2024学年高二上学期12月月考化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
真题
解题方法
6 . 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是___________ .
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为__________ (填“吸热”或“放热”)反应.
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________ .若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______ (填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______ mol/(L•s)﹣1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是____________________ (用离子方程式表示).向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_________ mol•L﹣1.(NH3•H2O的电离平衡常数取Kb=2×10﹣5 mol•L﹣1)

(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是

您最近一年使用:0次
真题
名校
7 . 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是______ 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:________
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是________ (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变△H______ O(填“>”、“=”或“<”),熵变△S_______ O(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O NH4HCO2+NH3・H2O
NH4HCO2+NH3・H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)时间的变化趋势如图所示。
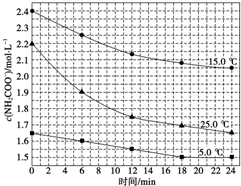
⑤计算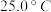 时,0-6min 氨基甲酸铵水解反应的平均速率
时,0-6min 氨基甲酸铵水解反应的平均速率______ 。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_____ 。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol・L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①可以判断该分解反应已经达到平衡的是
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是
④氨基甲酸铵分解反应的焓变△H
(2)已知:NH2COONH4+2H2O
 NH4HCO2+NH3・H2O
NH4HCO2+NH3・H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)时间的变化趋势如图所示。

⑤计算
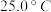 时,0-6min 氨基甲酸铵水解反应的平均速率
时,0-6min 氨基甲酸铵水解反应的平均速率⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:
您最近一年使用:0次
2016-12-09更新
|
2089次组卷
|
11卷引用:2011年普通高等学校招生全国统一考试化学卷(浙江)
2011年普通高等学校招生全国统一考试化学卷(浙江)(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷2016届河北省行唐启明中学高三上学期12月月考化学试卷2015-2016学年安徽省六安一中高二上第一阶段测化学试卷2015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2016届山西省平遥中学高三第二轮训练三化学试卷新疆和田地区第二中学2020届高三上学期12月月考化学试题(重点普通班)黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨第九中学校2020-2021学年高二上学期期中考试化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题
真题
8 . 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
(1)该反应所用的催化剂是_______ (填写化合物名称),该反应450℃时的平衡常数_______ 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是_______ 。
(3)可以用来判断该可逆反应达到平衡的是________ 。
a. b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则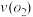 =
=_______ mol∙L-1∙min-1:若继续通入0.20mol 和0.10mol
和0.10mol ,则平衡
,则平衡_______ 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______ mol<n( )<
)<_______ mol。

(1)该反应所用的催化剂是
(2)该热化学反应方程式的意义是
(3)可以用来判断该可逆反应达到平衡的是
a.
 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化 c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol
 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则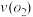 =
= 和0.10mol
和0.10mol ,则平衡
,则平衡 )<
)<
您最近一年使用:0次
真题
解题方法
9 . 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: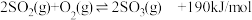
(1)该反应所用的催化剂是_______ (填写化合物名称),该反应450℃时的平衡常数_______ 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是_______ 。
(3)下列可用来判断该可逆反应达到平衡状态的是____________ 。
a.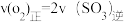 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则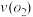 =
=_______ mol·L-1·min,若继续通入0.20mol 和0.10mol
和0.10mol ,则平衡
,则平衡_______ 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______ mol<n( )<
)<_______ mol。
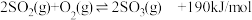
(1)该反应所用的催化剂是
(2)该热化学反应方程式的意义是
(3)下列可用来判断该可逆反应达到平衡状态的是
a.
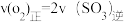 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化 c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol
 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则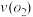 =
= 和0.10mol
和0.10mol ,则平衡
,则平衡 )<
)<
您最近一年使用:0次
真题
解题方法
10 . 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
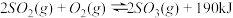
(1)该反应所用的催化剂是___ (填写化合物名称),该反应450℃时的平衡常数_____ 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是____________ .
(3)下列描述中能表明该反应已达平衡状态的是________
A.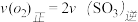 B.容器中气体的平均分子量不随时间而变化
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化D.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则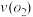 =
=______  :若继续通入0.20mol
:若继续通入0.20mol 和0.10mol
和0.10mol ,则平衡
,则平衡______ 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n( )<
)<______ mol。
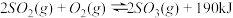
(1)该反应所用的催化剂是
(2)该热化学反应方程式的意义是
(3)下列描述中能表明该反应已达平衡状态的是
A.
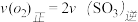 B.容器中气体的平均分子量不随时间而变化
B.容器中气体的平均分子量不随时间而变化C.容器中气体的密度不随时间而变化D.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5L的密闭容器中充入0.20 mol
 和0.10mol
和0.10mol ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含 0.18mol,则
0.18mol,则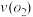 =
= :若继续通入0.20mol
:若继续通入0.20mol 和0.10mol
和0.10mol ,则平衡
,则平衡 )<
)<
您最近一年使用:0次



