解题方法
1 . 原理综合题
汽车尾气中含有 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
Ⅰ.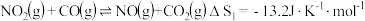
Ⅱ.
Ⅲ.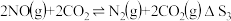
(1)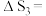
______  忽略
忽略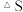 受温度的影响
受温度的影响 。
。
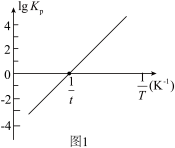
(2)反应Ⅰ的平衡常数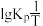 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为______  填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为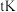 时,
时,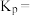
______ ,向恒容密闭容器中加入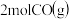 和
和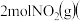 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为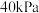 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为______ , 的平衡分压为
的平衡分压为______  。
。
(3)将等物质的量的 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
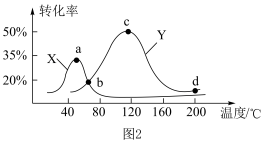
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:______ 。
(4)间接电解法可对大气污染物 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
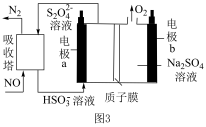
①电极 的电极反应式为
的电极反应式为______ 。
②工作时有 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为______  。
。
汽车尾气中含有
 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:Ⅰ.
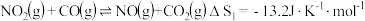
Ⅱ.

Ⅲ.
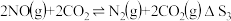
(1)
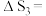
 忽略
忽略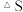 受温度的影响
受温度的影响 。
。(2)反应Ⅰ的平衡常数
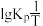 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为 填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为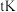 时,
时,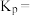
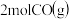 和
和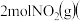 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为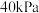 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的平衡分压为
的平衡分压为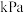 。
。
(3)将等物质的量的
 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:
(4)间接电解法可对大气污染物
 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
①电极
 的电极反应式为
的电极反应式为②工作时有
 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
2024-03-19更新
|
33次组卷
|
2卷引用:重庆市云阳盘石中学校2023-2024学年高三上学期12月月考化学试题
名校
2 . 某小组同学研究合成氨反应及氨水的性质如下:
(1)已知:N2(g)+3H2(g)=2NH3(g) ΔH =-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式________ 。
(2)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是________ 。
a.气体的密度不再发生改变 b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化 d.反应停止,正、逆反应的速率都等于零
(3)工业合成氨的反应温度选择500℃左右的原因是_______ 。
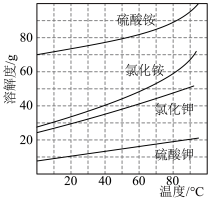
(4)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是_______ (填“温度”或“压强”),判断L1、L2的大小关系:L1______ L2(填“<”或“>”)。

(5)在70℃-80℃时,配制饱和的(NH4)2SO4和KCl溶液后混合。经过________ 、_______ 、干燥就可以得到K2SO4晶体。
(1)已知:N2(g)+3H2(g)=2NH3(g) ΔH =-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式
(2)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是
a.气体的密度不再发生改变 b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化 d.反应停止,正、逆反应的速率都等于零
(3)工业合成氨的反应温度选择500℃左右的原因是
(4)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是

(5)在70℃-80℃时,配制饱和的(NH4)2SO4和KCl溶液后混合。经过

您最近一年使用:0次
名校
3 . 在2L密闭容器中进行反应C(s)+H2O(g)  CO(g)+H2(g) ΔH>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g) ΔH>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
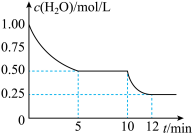
 CO(g)+H2(g) ΔH>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g) ΔH>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
| A.0~5min内氢气的反应速率大于10-12分内的反应速率 |
| B.为提高水蒸气的转化率,可向容器中再通入一定量的水蒸气 |
| C.10 min时,改变的外界条件可能是升高温度或者减小压强 |
| D.5min时该反应的K值一定小于12 min时的K值 |
您最近一年使用:0次
名校
4 . 高温下,某可逆反应达到平衡,其平衡常数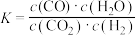 ,恒容时,升高温度,
,恒容时,升高温度, 的浓度减小,则下列说法正确的是
的浓度减小,则下列说法正确的是
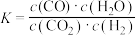 ,恒容时,升高温度,
,恒容时,升高温度, 的浓度减小,则下列说法正确的是
的浓度减小,则下列说法正确的是A.该反应的化学方程式为  |
| B.升高温度,K增大 |
| C.升高温度,逆反应速率减小 |
| D.该反应的∆H<0 |
您最近一年使用:0次
名校
解题方法
5 . 下列事实中,不能能用勒夏特列原理解释的是
| A.实验室可用浓氨水和氢氧化钠固体快速制取氨气 |
| B.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
C.对于2HI(g)  H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
您最近一年使用:0次
6 . 化学与生活、生产、社会、传统文化密切相关。下列说法错误的是
| A.“火树银花合,星桥铁锁开”中涉及化学能转化为热能和光能 |
| B.《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金。”强水为强电解质 |
C.草木灰(有效成分 )不能与 )不能与 混合使用,是因为 混合使用,是因为 与 与 发生水解生成氨气会降低肥效 发生水解生成氨气会降低肥效 |
| D.开启可乐瓶盖后,马上泛起大量泡沫,能用勒夏特列原理解释 |
您最近一年使用:0次
名校
7 . Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
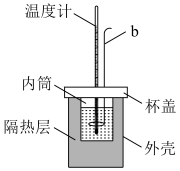
(1)图中仪器b的名称是_______ ;
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_______ ;
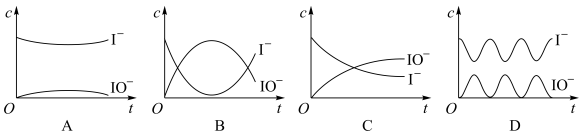
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_______ ,决定总反应速率的是第_______ 步基元反应。
(4)反应过程中I-和IO-的浓度变化趋势为_______ 。
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
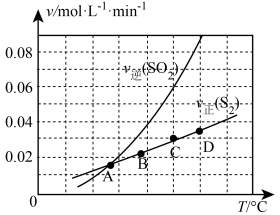
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_______ (填字母)。
(6)该反应的△H_______ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_______。

(1)图中仪器b的名称是
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为

Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)
 S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_______。
| A.降温 | B.增加C(s)的量 |
| C.减小容器体积 | D.恒压通入一定量SO2 |
您最近一年使用:0次
名校
8 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用且能够更好地保护环境,请回答下列问题:
(1)以下是N2(g)+3H2(g)⇌2NH3(g)( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:
①提高该化学反应限度的途径是_______ 。
A、降低压强 B、增大压强 C、增大温度 D、降低温度E、催化剂
②根据表中数据, 含量达到98.8%的条件是
含量达到98.8%的条件是_______ ,而实际工业生产通常选择温度400~500℃,原因是_______ ,压强选择10MPa~30MPa,原因是_______ 。
(2)在密闭容器中,充入一定量的N2、H2,在一定条件下反应,已知NH3的体积分数(纵坐标)和温度(横坐标)的变化关系如图所示,下列说法正确的是_______ 。
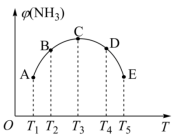
A、平衡常数K:A点<B点
B、H2的转化率C点最高
C、A、B、C、D、E五点都达到了平衡状态
(3)过渡施用氮肥将导致大气中 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
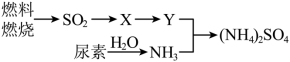
①X可能是 或
或_______ ,Y是_______ 。
②尿素 是一种常用有机氮肥,能缓慢与
是一种常用有机氮肥,能缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为_______ 。
(1)以下是N2(g)+3H2(g)⇌2NH3(g)(
 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:温度/℃ NH3含量/% 压强/MPa | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A、降低压强 B、增大压强 C、增大温度 D、降低温度E、催化剂
②根据表中数据,
 含量达到98.8%的条件是
含量达到98.8%的条件是(2)在密闭容器中,充入一定量的N2、H2,在一定条件下反应,已知NH3的体积分数(纵坐标)和温度(横坐标)的变化关系如图所示,下列说法正确的是

A、平衡常数K:A点<B点
B、H2的转化率C点最高
C、A、B、C、D、E五点都达到了平衡状态
(3)过渡施用氮肥将导致大气中
 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)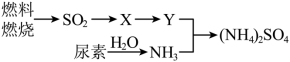
①X可能是
 或
或②尿素
 是一种常用有机氮肥,能缓慢与
是一种常用有机氮肥,能缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为
您最近一年使用:0次
名校
9 . 关于一定条件下的化学平衡CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH<0,下列说法正确的是
| A.恒温恒压,充入Ar,反应速率不变,CO的体积分数不变 |
| B.恒温恒容,充入H2,v(正)增大,CO2转化率增大 |
| C.加压,v(正),v(逆)不变,平衡不移动 |
| D.升温,v(正)不变,v(逆)增大,平衡左移,CO2转化率减小 |
您最近一年使用:0次
名校
10 . 在一定温度下的密闭容器中进行反应2A(g)+xB(g)⇌3C(g)+D(s) ΔH>0,该反应在瞬间即可达成化学平衡,平衡时测得A的浓度为0.6mol·L-1。保持温度不变,现将容器的容积压缩为原来的一半,再达到平衡时,A的浓度为1.2mol·L-1,下列叙述正确的是
| A.A的物质的量增多 | B.正反应和逆反应的活化能均较低 |
C.该反应的平衡常数表达式为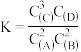 | D.平衡向逆反应方向移动 |
您最近一年使用:0次



