9-10高二下·北京·期末
名校
1 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是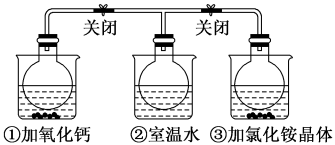
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1134次组卷
|
23卷引用:新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题
新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
2 . 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①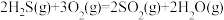
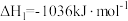
②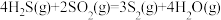
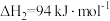
③
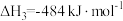
计算 热分解反应④
热分解反应④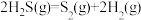 的
的
________  。
。
(2)较普遍采用的 处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解
处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的优点是
。相比克劳斯工艺,高温热分解方法的优点是________ ,缺点是________ 。
(3)在 、
、 反应条件下,将
反应条件下,将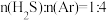 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为________ ,平衡常数
________  。
。
(4)在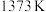 、
、 反应条件下,对于
反应条件下,对于 分别为
分别为 、
、 、
、 、
、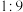 、
、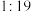 的
的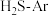 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如下图所示。
转化率随时间的变化如下图所示。 越小,
越小, 平衡转化率
平衡转化率________ ,理由是________ 。
②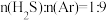 对应图中曲线
对应图中曲线________ ,计算其在 之间,
之间, 分压的平均变化率为
分压的平均变化率为________ 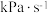 。
。
(1)已知下列反应的热化学方程式:
①
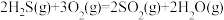
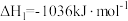
②
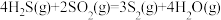
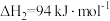
③

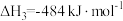
计算
 热分解反应④
热分解反应④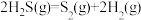 的
的
 。
。(2)较普遍采用的
 处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解
处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的优点是
。相比克劳斯工艺,高温热分解方法的优点是(3)在
 、
、 反应条件下,将
反应条件下,将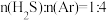 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
 。
。(4)在
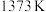 、
、 反应条件下,对于
反应条件下,对于 分别为
分别为 、
、 、
、 、
、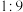 、
、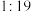 的
的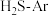 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如下图所示。
转化率随时间的变化如下图所示。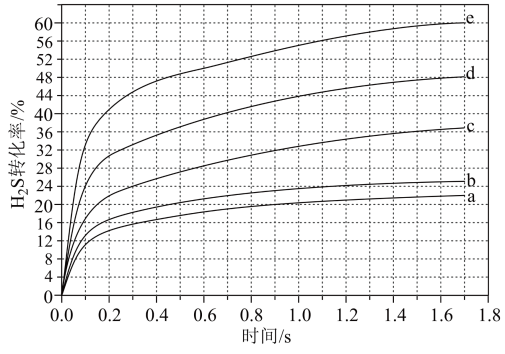
 越小,
越小, 平衡转化率
平衡转化率②
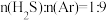 对应图中曲线
对应图中曲线 之间,
之间, 分压的平均变化率为
分压的平均变化率为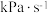 。
。
您最近一年使用:0次
2022-06-09更新
|
23133次组卷
|
24卷引用:新疆奎屯市第一高级中学2023-2024学年高二上学期9月月考化学试题
新疆奎屯市第一高级中学2023-2024学年高二上学期9月月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题天津市第四中学2023-2024学年高三上学期第二次月考化学试卷2022年高考全国乙卷化学真题(已下线)专题14化学反应原理综合-2022年高考真题+模拟题汇编(全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题16 化学反应原理综合题-备战2023年高考化学母题题源解密(全国通用)湖南师大附属颐华学校2022-2023学年高二上学期入学考试化学试题福建省福州第一中学2022-2023学年高三上学期检考前适应性考试化学试题(已下线)题型26 多反应体系中的化学平衡(已下线)T28-原理综合题(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)2023年湖南卷高考真题变式题(原理综合题)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)河北省保定市唐县第一中学2022-2023学年高三上学期11月期中化学试题江西省宜春市宜丰中学2022-2023学年高二上学期11月期中(第二次月考)化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题(已下线)大题04 化学反应原理综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
名校
解题方法
3 . 乙烯是制造塑料、合成橡胶和合成纤维等化学产品的基本原料。C2H6裂解制C2H4是化学工业的一个重要研究课题,目前裂解方法有电催化、光催化裂解、直接裂解、氧气或二氧化碳氧化乙烷裂解等。乙烷直接裂解、乙烷二氧化碳氧化裂解和乙烷氧气氧化裂解的反应如下:
(Ⅰ)C2H6(g) C2H4(g)+H2(g) △H1=+125kJ·mol-1
C2H4(g)+H2(g) △H1=+125kJ·mol-1
(Ⅱ)CO2(g)+C2H6(g) C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1
C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1
(Ⅲ)2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1
2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1
回答下列问题:
(1)已知键能:E(C—H)=416kJ·mol-1,E(H—H)=436kJ·mol-1,由此计算生成1mol碳碳π键放出的能量为_______ kJ。
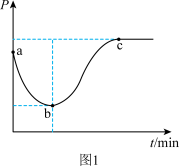
(2)在一绝热的恒容密闭容器中,通入一定量的C2H6发生反应(Ⅰ),反应过程中容器内压强(P)与时间(t)变化如图1所示,随着反应进行,a~b段压强减小的原因是_______ 。
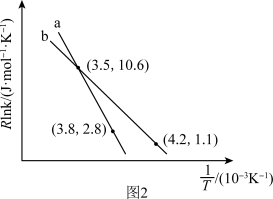
(3)反应(Ⅱ)的Arrhenius经验公式实验数据如图2中曲线a所示,已知Arrhenius经验公式Rlnk=-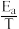 +C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=_______ kJ·mol-1。当改变外界条件时,实验数据如图中曲线b所示,则实验可能改变的外界条件是_______ 。
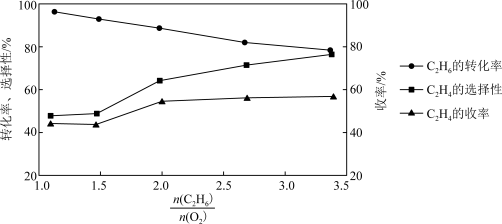
(4)乙烷氧气氧化裂解制乙烯,除发生反应(Ⅲ)之外,还发生副反应(Ⅳ):2C2H6(g)+7O2(g) 4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比
4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比 的变化关系如图所示:
的变化关系如图所示:
已知:C2H4的选择性=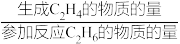 ×100%
×100%
C2H4的收率=C2H6的转化率×C2H4的选择性
①控制 =2而不采用选择性更高的
=2而不采用选择性更高的 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是_______ ; <2时,
<2时, 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是_______ 。
②一定温度和压强为5.8pMPa条件下,将C2H6和O2按物质的量之比为2∶3通入密闭弹性容器中发生反应,平衡时,C2H4选择性为60%,C2H4的收率为48%。该温度下,反应2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g)的Kp=
2C2H4(g)+2H2O(g)的Kp=_______ (用含字母p的代数式表示,带单位。已知Kp是用反应体系中气体的分压来表示的平衡常数,分压=总压×物质的量分数)。
(Ⅰ)C2H6(g)
 C2H4(g)+H2(g) △H1=+125kJ·mol-1
C2H4(g)+H2(g) △H1=+125kJ·mol-1(Ⅱ)CO2(g)+C2H6(g)
 C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1
C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1(Ⅲ)2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1
2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1回答下列问题:
(1)已知键能:E(C—H)=416kJ·mol-1,E(H—H)=436kJ·mol-1,由此计算生成1mol碳碳π键放出的能量为
(2)在一绝热的恒容密闭容器中,通入一定量的C2H6发生反应(Ⅰ),反应过程中容器内压强(P)与时间(t)变化如图1所示,随着反应进行,a~b段压强减小的原因是

(3)反应(Ⅱ)的Arrhenius经验公式实验数据如图2中曲线a所示,已知Arrhenius经验公式Rlnk=-
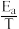 +C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
(4)乙烷氧气氧化裂解制乙烯,除发生反应(Ⅲ)之外,还发生副反应(Ⅳ):2C2H6(g)+7O2(g)
 4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比
4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比 的变化关系如图所示:
的变化关系如图所示:
已知:C2H4的选择性=
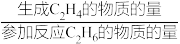 ×100%
×100%C2H4的收率=C2H6的转化率×C2H4的选择性
①控制
 =2而不采用选择性更高的
=2而不采用选择性更高的 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是 <2时,
<2时, 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是②一定温度和压强为5.8pMPa条件下,将C2H6和O2按物质的量之比为2∶3通入密闭弹性容器中发生反应,平衡时,C2H4选择性为60%,C2H4的收率为48%。该温度下,反应2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g)的Kp=
2C2H4(g)+2H2O(g)的Kp=
您最近一年使用:0次
2022-04-14更新
|
1384次组卷
|
3卷引用:新疆塔城地区第二中学2022-2023学年高二上学期11月月考化学试题
解题方法
4 . CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
①根据图表数据分析T1 ℃时,该反应在0~10 min内的平均反应速率v(NO)=_____ mol·L-1·min-1;计算该反应的平衡常数K=_______ 。
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是_____ (填字母编号)。
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率_______ (填“升高”或“降低”),∆H______ 0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式_______
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO )∶c(CO
)∶c(CO ) =
) =______ 。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_____ 。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10 -10]。(忽略溶液体积的变化)
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO
 )∶c(CO
)∶c(CO ) =
) =②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
5 . “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:
(1)电解饱和食盐水制取氯气的化学方程式是______ 。
(2)下列说法不正确 的是______ 。
A.可采用碱石灰干燥氯气
B.可通过排饱和食盐水法收集氯气
C.常温下,可通过加压使氯气液化而储存于钢瓶中
D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl 2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1______ 0。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=______ 。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=______ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为;
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1,KI=3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1,KII=1.2×1048
结合数据说明 氯化过程中加碳的理由______ 。
(5)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______ 。
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
(1)电解饱和食盐水制取氯气的化学方程式是
(2)下列说法
A.可采用碱石灰干燥氯气
B.可通过排饱和食盐水法收集氯气
C.常温下,可通过加压使氯气液化而储存于钢瓶中
D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl 2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1
②平衡常数K2的表达式为K2=
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为;
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1,KI=3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1,KII=1.2×1048
(5)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
您最近一年使用:0次
2021-01-09更新
|
9032次组卷
|
13卷引用:新疆乌鲁木齐市第八十中学2023-2024学年高三上学期11月月考化学试题
新疆乌鲁木齐市第八十中学2023-2024学年高三上学期11月月考化学试题2021年1月新高考浙江化学高考真题江西省南昌县莲塘第一中学2020-2021学年高二上学期期末检测化学试题(已下线)培优07 化学反应原理综合(提高练)-2021年高考化学大题培优练(新高考地区专用)(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题20.化学反应原理综合应用-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题(已下线)专题17 原理综合题(已下线)专题17 原理综合题
名校
解题方法
6 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
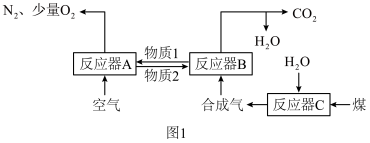
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
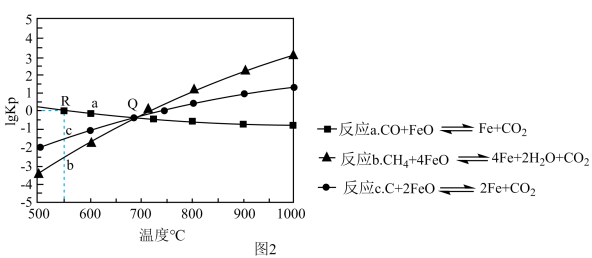
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
292次组卷
|
5卷引用:新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题
7 . 已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,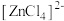 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,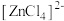 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和 中σ键数之比为3:2 中σ键数之比为3:2 |
| B.由实验①可推知△H<0 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: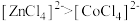 |
您最近一年使用:0次
2020-07-11更新
|
5801次组卷
|
30卷引用:新疆石河子第一中学2021-2022学年高二4月月考化学试题
新疆石河子第一中学2021-2022学年高二4月月考化学试题福建省龙岩第一中学2021-2022学年高二下学期第一次月考化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题黑龙江省牡丹江市第一高级中学2021-2022学年高二下学期4月月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期5月月考化学试题江苏省海安高级中学2023-2024学年高二上学期第一次考试化学试题山东省滨州市阳信县第一中学2023-2024学年高二上学期第三次月考化学试题2020年天津卷化学高考试题(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)四川省遂宁市2020-2021学年高二上学期期末教学水平监测化学试题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)江苏省盐城市阜宁中学2020-2021学年高二下学期期中考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)福建省三明市教研联盟2021-2022学年高二下学期期中联考化学试题(已下线)专题9 平衡移动专练天津市2023届高三上学期第一次模拟测试化学试题河北省邯郸市第一中学2022-2023学年高三上学期一轮复习(四)化学试题四川省巴中市恩阳区2022-2023学年高二下学期4月期中考试化学试题广东省广州市执信中学2023-2024学年高三上学期开学考试化学试题(已下线)第7讲 配合物与超分子广东省广州市执信中学2023-2024学年高三上学期 开学化学试卷
名校
8 . 煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述正向反应是________ 反应 (填“放热”或“吸热”);
(2)下列条件的改变能加快其反应速率的是_______ (选填序号);
①升高温度;②保持体积不变,只增加CO的质量;③保持体积不变,充入Ne使体系压强增大;④保持压强不变,充入Ne使容器的体积增大
(3)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2,发生反应CO(g)+2H2(g) ⇌CH3OH(g),CO的平衡转化率与温度,压强的关系如下图所示:

①A、B两点对应的压强大小关系是PA________ PB;(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是____________ ;
③在P1压强、T1℃时,该反应的平衡常数K=___________ ;
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正____ v逆(填 >、< 或 =)。
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)上述正向反应是
(2)下列条件的改变能加快其反应速率的是
①升高温度;②保持体积不变,只增加CO的质量;③保持体积不变,充入Ne使体系压强增大;④保持压强不变,充入Ne使容器的体积增大
(3)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2,发生反应CO(g)+2H2(g) ⇌CH3OH(g),CO的平衡转化率与温度,压强的关系如下图所示:

①A、B两点对应的压强大小关系是PA
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③在P1压强、T1℃时,该反应的平衡常数K=
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正
您最近一年使用:0次
2019-12-18更新
|
79次组卷
|
2卷引用:新疆乌鲁木齐市第六十八中学2023-2024学年高三上学期1月月考化学试题



