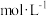名校
解题方法
1 . 25℃时,向40 mL 0.05 mol/L的 溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应
溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应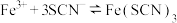 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法不正确的是
与反应时间(t)的变化如图所示。下列说法不正确的是
 溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应
溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应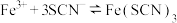 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法不正确的是
与反应时间(t)的变化如图所示。下列说法不正确的是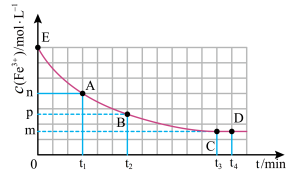
A. 时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动。 时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动。 |
| B.E点对应的坐标为(0,0.04) |
C.在25℃时该反应的平衡常数为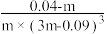 |
D. 分钟后加入少量KSCN固体,溶液红色加深,该现象可以证明 分钟后加入少量KSCN固体,溶液红色加深,该现象可以证明 与SCN-的反应是可逆反应 与SCN-的反应是可逆反应 |
您最近一年使用:0次
2023-12-12更新
|
232次组卷
|
3卷引用:北京市第十二中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 为探究浓度对化学平衡的影响,某同学进行如下实验:
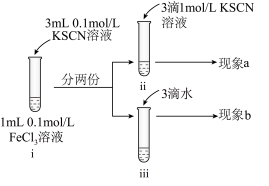
已知:i.中发生的化学反应为:
下列说法不正确 的是:

已知:i.中发生的化学反应为:

下列说法
| A.若i中加入KSCN溶液的体积改为2mL,不具有说服力,无法达到实验目的 |
| B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 |
| C.进行ii、iii对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
| D.若将ii中加入试剂更换为3滴1mol/LKCl溶液,记为现象c,则平衡逆向移动,现象c比现象b红色更浅 |
您最近一年使用:0次
名校
3 . 某同学研究浓度对化学平衡的影响,下列说法不正确的是
已知: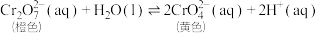 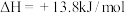 | |
| 实验步骤 | 实验现象 |
 | ⅰ.待试管b中颜色不变后与试管a比较,试管b中橙色比试管a中的浅; ⅱ.待试管c中颜色不变后与试管b比较,试管c中的颜色比试管b中的浅; ⅲ.滴加浓硫酸,试管d温度略有升高,溶液颜色与试管b中的相比,变深 |
| A.试管b中的现象说明加水后平衡正向移动 |
| B.该实验能证明减小生成物浓度,平衡正向移动 |
| C.“待试管c中溶液颜色不变”的目的是使反应达到平衡状态 |
D.试管d中的现象能说明影响平衡的主要因素是 增大 增大 |
您最近一年使用:0次
名校
4 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与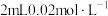 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与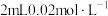 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。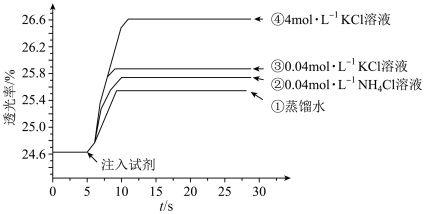
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:北京市广渠门中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 小组同学探究盐溶液对反应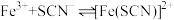 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ. (黄色)
(黄色)
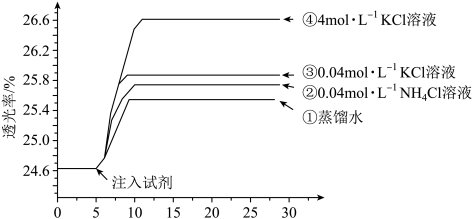
下列说法不正确的是
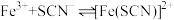 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ.
 (黄色)
(黄色)
下列说法不正确的是
A.注入试剂①后溶液透光率增大,一定是由于 平衡逆向移动引起的 平衡逆向移动引起的 |
| B.透光率③比②高,可能是阳离子种类或溶液pH导致的 |
C.透光率④比③高,可能发生了反应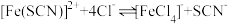 |
D.若要证明试剂③中Cl—对平衡体系有影响,还应使用与试剂③等体积的0.04mol/L的KNO3溶液进行对比实验(已知NO 对实验无影响) 对实验无影响) |
您最近一年使用:0次
2023-01-13更新
|
651次组卷
|
9卷引用:北京市第二中学2022-2023学年高二下学期3月月考化学试题
名校
6 . 某同学为探究浓度对化学平衡的影响设计了如下实验:已知:
反应i:
反应ii: (黄色)
(黄色)不正确 的是
反应i:

反应ii:
 (黄色)
(黄色)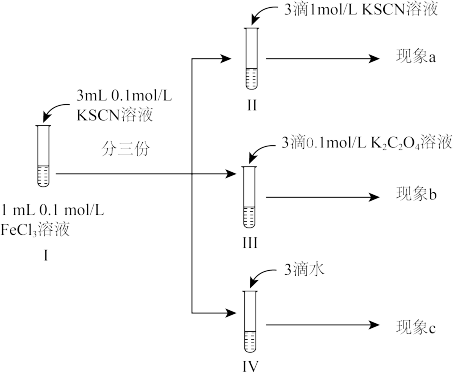
| A.观察到现象a比现象c中红色更深,即可证明增加反应物浓度,反应i平衡正向移动 |
| B.观察到现象b比现象c中红色浅,即可说明反应i平衡逆向移动,反应ⅱ平衡正向移动 |
| C.进行IV对比实验的主要目的是防止出于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
D.III中溶液一开始无 ,12小时后检出 ,12小时后检出 ,可能的原因是 ,可能的原因是 还原 还原 的速率较慢,反应ⅱ速率较快 的速率较慢,反应ⅱ速率较快 |
您最近一年使用:0次
2023-01-06更新
|
342次组卷
|
4卷引用:北京市昌平区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 . CO2资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使CO2转化为CH4。反应体系中主要反应的热化学方程式为:
反应Ⅰ:

反应Ⅱ:

(1)将反应后气体通入___________ (填试剂),可证明反应Ⅱ发生。
(2)计算

___________ (用 和
和 表示)。
表示)。
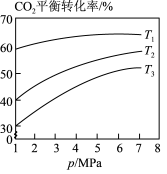
(3)相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为___________ 。
(4)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
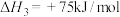
消碳反应:
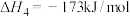
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是___________ 。
(5)向 恒容、密闭容器中通入
恒容、密闭容器中通入 和
和 ,测得有关物质的物质的量随温度变化如下图。
,测得有关物质的物质的量随温度变化如下图。
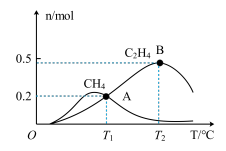
①催化剂在较低温度时主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”)。
② 时
时 的转化率为
的转化率为___________ ,反应Ⅰ的平衡常数
___________ 。
反应Ⅰ:


反应Ⅱ:


(1)将反应后气体通入
(2)计算


 和
和 表示)。
表示)。(3)相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(4)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:

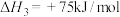
消碳反应:

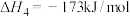
其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是
(5)向
 恒容、密闭容器中通入
恒容、密闭容器中通入 和
和 ,测得有关物质的物质的量随温度变化如下图。
,测得有关物质的物质的量随温度变化如下图。
①催化剂在较低温度时主要选择
②
 时
时 的转化率为
的转化率为
您最近一年使用:0次
名校
8 . 已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是
注:加热为微热,忽略体积变化。
| ① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
| 加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
| A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3 |
| B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响 |
C.实验③中,存在可逆反应: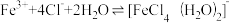 |
| D.实验④,可证明升高温度,Fe3+水解平衡正向移动 |
您最近一年使用:0次
解题方法
9 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行实验。
已知: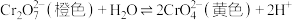
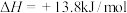 ,+6价格盐在一定条件下可被还原为
,+6价格盐在一定条件下可被还原为 ,
, 在水溶液中为绿色。
在水溶液中为绿色。
实验一:

(1)试管c和b对比,推测试管c的现象是_______ 。
(2)试管a和b对比,a中溶液橙色加深,甲认为温度也会影响平衡的移动,橙色加深不一定是 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明?
增大对平衡的影响。你认为是否需要再设计实验证明?_______ (“是”或“否”),理由是_______ 。
(3)对比试管a、b、c的实验现象,可以得到的结论是_______ 。
实验二:取试管c完成如下实验。
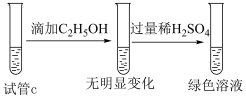
(4)试管c中溶液变为绿色时,发生的氧化还原反应的离子方程式是_______ (乙醇转化为乙酸)。
(5)由实验二中实验现象,可以得出的结论是_______ 。
(6)丙同学欲通过+6价铬盐与KI反应,验证(5)中结论,他的实验方案是_______ 。
已知:
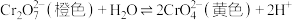
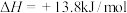 ,+6价格盐在一定条件下可被还原为
,+6价格盐在一定条件下可被还原为 ,
, 在水溶液中为绿色。
在水溶液中为绿色。实验一:

(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深,甲认为温度也会影响平衡的移动,橙色加深不一定是
 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明?
增大对平衡的影响。你认为是否需要再设计实验证明?(3)对比试管a、b、c的实验现象,可以得到的结论是
实验二:取试管c完成如下实验。

(4)试管c中溶液变为绿色时,发生的氧化还原反应的离子方程式是
(5)由实验二中实验现象,可以得出的结论是
(6)丙同学欲通过+6价铬盐与KI反应,验证(5)中结论,他的实验方案是
您最近一年使用:0次
名校
解题方法
10 . 某小组探究含 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。
资料:
i.含 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、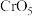 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。
ii. 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中, 不能氧化
不能氧化 价格元素。
价格元素。
实验操作及现象如下:
(1)已知 (橙色)
(橙色) (黄色)
(黄色) 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是_____ (填字母)。
A. 和
和 的浓度相同 B.
的浓度相同 B.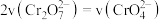 C.溶液的颜色不变
C.溶液的颜色不变
(2)已知 (橙色)
(橙色) (黄色)
(黄色) 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(4)Ⅱ中,继续滴入 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是_____ 。
(5)Ⅱ中,继续滴入 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。
①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入 溶液前增加一步操作:
溶液前增加一步操作:_____ 。然后滴入 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为_____ 色。
②乙同学通过原电池原理进一步研究碱性环境对 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,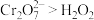 ;碱性条件下,
;碱性条件下,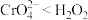
(6)此外,生产中常用 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用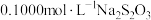 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为_____  。
。
 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。资料:
i.含
 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、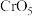 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。ii.
 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。iii.在碱性环境中,
 不能氧化
不能氧化 价格元素。
价格元素。实验操作及现象如下:
| 装置 | 步骤 | 操作 | 现象 |
2mL0.0125 K2Cr2O7溶液 | Ⅰ | 先滴入稀疏酸至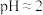 ,再滴入5滴 ,再滴入5滴 溶液,振荡 溶液,振荡 | 溶液橙色加深。滴入 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴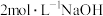 溶液,边滴,边振荡 溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
(1)已知
 (橙色)
(橙色) (黄色)
(黄色) 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是A.
 和
和 的浓度相同 B.
的浓度相同 B.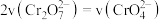 C.溶液的颜色不变
C.溶液的颜色不变(2)已知
 (橙色)
(橙色) (黄色)
(黄色) 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是
(4)Ⅱ中,继续滴入
 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是(5)Ⅱ中,继续滴入
 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入
 溶液前增加一步操作:
溶液前增加一步操作: 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为②乙同学通过原电池原理进一步研究碱性环境对
 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,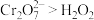 ;碱性条件下,
;碱性条件下,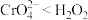
(6)此外,生产中常用
 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用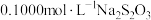 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为 。
。
您最近一年使用:0次