1 . 298K时,向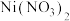 、
、 、
、 的混合液中滴加KCN溶液,混合液中lgx与
的混合液中滴加KCN溶液,混合液中lgx与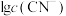 的关系如图所示,
的关系如图所示, 或
或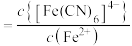 或
或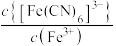 。下列叙述不正确的是
。下列叙述不正确的是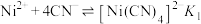 ;
;
(2) ;
;
(3)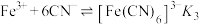 ,且
,且 。
。
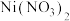 、
、 、
、 的混合液中滴加KCN溶液,混合液中lgx与
的混合液中滴加KCN溶液,混合液中lgx与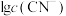 的关系如图所示,
的关系如图所示, 或
或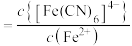 或
或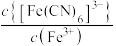 。下列叙述不正确的是
。下列叙述不正确的是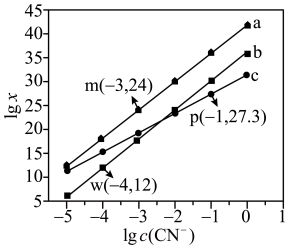
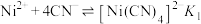 ;
;(2)
 ;
;(3)
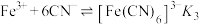 ,且
,且 。
。A.直线b代表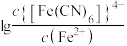 与 与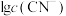 的关系 的关系 |
B.根据图像可计算平衡常数 数量级为 数量级为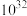 |
C. 的平衡常数 的平衡常数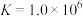 |
D.向含相同浓度的 和 和 的溶液中滴加 的溶液中滴加 溶液,先生成 溶液,先生成 |
您最近一年使用:0次
2024-05-14更新
|
91次组卷
|
2卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
解题方法
2 . 一种催化还原NO的机理如图所示,下列说法正确的是
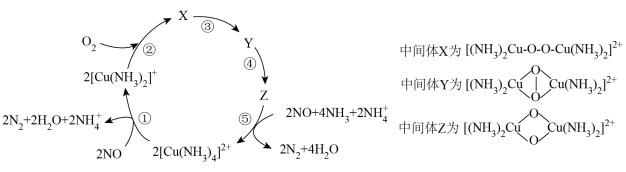

| A.中间体X和Z中O和Cu的化合价均不变 |
B.使用催化剂 ,可以提高NO的反应速率和平衡转化率 ,可以提高NO的反应速率和平衡转化率 |
| C.过程①中既有极性键的断裂,也有极性键的形成 |
D.该催化还原过程的总反应方程式为 |
您最近一年使用:0次
2024-05-14更新
|
59次组卷
|
2卷引用:2024届新疆高三下学期5月第三次适应性检测理综试卷-高中化学
名校
解题方法
3 . “碳达峰-碳中和”是我国社会发展重大战略之一
Ⅰ.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应A: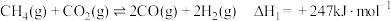
反应B:
(1)反应 的 △H=
的 △H=___________ kJ/mol。
(2)恒压、750 ℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化为CO。假设各步均转化完全,下列说法正确的是___________ (填字母序号)。

a.过程ⅰ和过程ⅱ中均未发生氧化还原反应
b.过程ii中使用的催化剂为Fe和CaCO3
c.过程ii,CaO吸收CO2可促使Fe3O4氧化CO的平衡正移
d.相比于反应A,该流程的总反应还原1 mol CO2需要吸收的能量更少
Ⅱ.工业上可用制备CH3OH:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
(3)不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2所示。
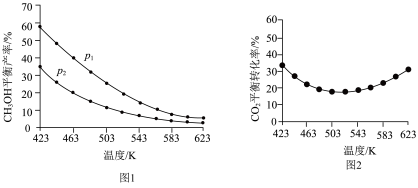
①图1中,压强p1___________ p2(填“>”、“=”或“<”)。
②图2中,压强为p2,温度高于503 K后,CO2平衡转化率随温度升高而增大的原因是___________ 。
(4)实际生产中,测得压强为p3时,相同时间 内不同温度下的CH3OH产率如图3所示。523 K时,CH3OH产率最大,可能的原因是___________ (填字母序号)。
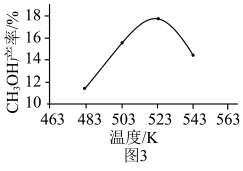
a.此条件下主反应限度最大
b.此条件下主反应速率最快
c.523 K时催化剂的活性最强
Ⅰ.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应A:
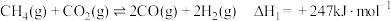
反应B:

(1)反应
 的 △H=
的 △H=(2)恒压、750 ℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化为CO。假设各步均转化完全,下列说法正确的是

a.过程ⅰ和过程ⅱ中均未发生氧化还原反应
b.过程ii中使用的催化剂为Fe和CaCO3
c.过程ii,CaO吸收CO2可促使Fe3O4氧化CO的平衡正移
d.相比于反应A,该流程的总反应还原1 mol CO2需要吸收的能量更少
Ⅱ.工业上可用制备CH3OH:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。(3)不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2所示。

①图1中,压强p1
②图2中,压强为p2,温度高于503 K后,CO2平衡转化率随温度升高而增大的原因是
(4)实际生产中,测得压强为p3时,

a.此条件下主反应限度最大
b.此条件下主反应速率最快
c.523 K时催化剂的活性最强
您最近一年使用:0次
2023-11-04更新
|
166次组卷
|
2卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
4 . 氨是一种重要的化工原料和储氢材料。回答下列问题
(1)已知:
①
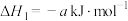 ;
;
②
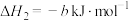 (其中,a、b均大于0)。
(其中,a、b均大于0)。
则

___________  。
。
(2)下列叙述正确的是___________(填代号)。
(3)氨在钨表面发生反应 ,速率方程为
,速率方程为 (k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时,
(k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时, 与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用
与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用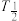 表示。
表示。

① 温度下,速率常数k=
温度下,速率常数k=___________ ;当起始浓度 时半衰期为
时半衰期为___________ min。
②温度:
___________ (填“>”“<”或“=”) 。
。
(4)工业生产中,合成氨宜选择450~500℃、20~50MPa,温度不低于450℃,压强不高于50MPa,其主要原因是___________ (从反应速率和平衡角度分析)。
(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入1mol 和3mol
和3mol (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。

①相对于乙,甲改变的条件是___________ (填代号)。
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在甲条件下,平衡时体积为0.5L,则该反应的平衡常数K为___________  (结果保留两位有效数字)。
(结果保留两位有效数字)。
(1)已知:
①

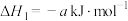 ;
;②

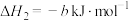 (其中,a、b均大于0)。
(其中,a、b均大于0)。则


 。
。(2)下列叙述正确的是___________(填代号)。
A.在合成氨中, |
B.在恒温恒容下1mol 和1mol 和1mol 制 制 ,当 ,当 体积分数不变时达到平衡 体积分数不变时达到平衡 |
C.在恒温恒压下合成氨,平衡后通入少量氩气, 的平衡转化率不变 的平衡转化率不变 |
| D.在恒温恒容下合成氨,平衡后通入少量氨气,逆反应速率增大且大于正反应速率 |
 ,速率方程为
,速率方程为 (k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时,
(k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时, 与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用
与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用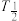 表示。
表示。
①
 温度下,速率常数k=
温度下,速率常数k= 时半衰期为
时半衰期为②温度:

 。
。(4)工业生产中,合成氨宜选择450~500℃、20~50MPa,温度不低于450℃,压强不高于50MPa,其主要原因是
(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入1mol
 和3mol
和3mol (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
①相对于乙,甲改变的条件是
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在甲条件下,平衡时体积为0.5L,则该反应的平衡常数K为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
2023-09-12更新
|
115次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
5 . 当前,我国公布了实现“碳达峰、碳中和”目标的具体时间。因此,含碳化合物的综合利用,有效缓解温室效应成为研究热点。回答下列问题:
(1)CO2可与 H2制甲醇:
在催化剂作用下,发生以下反应:
I. CO2(g)+3 H2 (g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1 = - 49 kJ·mol-1
H1 = - 49 kJ·mol-1
II. CO2(g)+ H2 (g) CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2 = + 41 kJ·mol-1
H2 = + 41 kJ·mol-1
则:III. CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)  H =
H = ___________ 。若将等物质的量的 CO 和 H2 充入恒温恒容密闭容器中进行反应III,下列事实能说明此反应已达到平衡状态的是 ___________ 。
A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和 H2 的物质的量之比为 1: 2
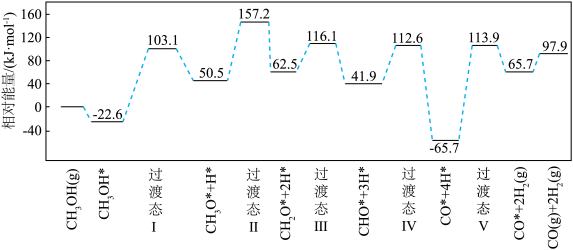
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea =___________ kJ·mol-1,写出该步骤的化学方程式:___________ 。
(3)利用 CO2和 CH4重整也是实现“碳中和”目标的重要途径: CO2 (g)+CH4 (g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)  H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
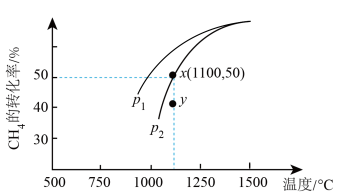
①结合图示,p1___________ p2,在p2下,y点时v正 ___________ v逆 (填“>”“<”或“=”)
②用平衡分压代替平衡浓度可以得到平衡常数 Kp,则x点对应温度下反应的平衡常数Kp =__________ (已知:气体分压 = 气体总压 X 气体的物质的量分数)。
(1)CO2可与 H2制甲醇:
在催化剂作用下,发生以下反应:
I. CO2(g)+3 H2 (g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1 = - 49 kJ·mol-1
H1 = - 49 kJ·mol-1II. CO2(g)+ H2 (g)
 CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2 = + 41 kJ·mol-1
H2 = + 41 kJ·mol-1则:III. CO (g) + 2H2(g)
 CH3OH(g)
CH3OH(g)  H =
H = A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和 H2 的物质的量之比为 1: 2
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea =

(3)利用 CO2和 CH4重整也是实现“碳中和”目标的重要途径: CO2 (g)+CH4 (g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)  H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
①结合图示,p1
②用平衡分压代替平衡浓度可以得到平衡常数 Kp,则x点对应温度下反应的平衡常数Kp =
您最近一年使用:0次
2023-07-29更新
|
87次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期1月月考化学试题
名校
6 . 丙烯是工业上合成精细化学的原料,随着天然气和页岩气的可用性不断提高,丙烷脱氢和丙烷氧化脱氢受到了人们越来越多的关注,已知,
主反应:
副反应:
(1)相关键能的数据如下表所示
则丙烷脱氢反应的热化学方程式为
________ kJ/mol,根据化学原理,可以同时提高化学反应速率并提高 转化率的措施是
转化率的措施是___________
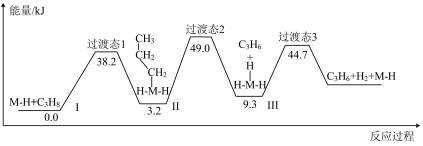
(2)用丙烷制备丙烯的机理如图所示,该反应的快慢取决于步骤___________ (填写Ⅰ、Ⅱ、Ⅲ),该反应的催化剂为___________
(3)在恒温条件下,向起始压强为120KPa的恒压容器中通入 和
和 发生反应。
发生反应。
①下列情况能表明达到平衡状态的是___________
A. 与
与 的浓度相等 B.
的浓度相等 B. 的体积分数不再改变
的体积分数不再改变
C.反应容器中压强保持不变 D.气体密度不再改变
②经过10min后反应达到平衡,测得 的平衡转化率为50%,该条件下
的平衡转化率为50%,该条件下 的选择性为80%,则主反应的平衡常数
的选择性为80%,则主反应的平衡常数
___________ KPa(以分压表示,分压=总压×物质的量分数,保留一位小数),其他条件不变时,若减少通入 的量,化学平衡将
的量,化学平衡将___________ 移动(填写“正向”、“逆向”、或“不”)。
主反应:

副反应:

(1)相关键能的数据如下表所示
| 化学键 | C-C | C=C | C-H | H-H |
键能/( ) ) | 348 | 615 | 413 | 436 |

 转化率的措施是
转化率的措施是(2)用丙烷制备丙烯的机理如图所示,该反应的快慢取决于步骤

(3)在恒温条件下,向起始压强为120KPa的恒压容器中通入
 和
和 发生反应。
发生反应。①下列情况能表明达到平衡状态的是
A.
 与
与 的浓度相等 B.
的浓度相等 B. 的体积分数不再改变
的体积分数不再改变C.反应容器中压强保持不变 D.气体密度不再改变
②经过10min后反应达到平衡,测得
 的平衡转化率为50%,该条件下
的平衡转化率为50%,该条件下 的选择性为80%,则主反应的平衡常数
的选择性为80%,则主反应的平衡常数
 的量,化学平衡将
的量,化学平衡将
您最近一年使用:0次
2023-07-12更新
|
284次组卷
|
4卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
7 . 氢能是一种很有前景的新能源,CH4—CO2催化重整是目前制取氢气且同时减缓温室效应的重要方法。
已知:① CH4—CO2催化重整的反应如下:
反应Ⅰ:CH4(g) C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25
C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25
反应Ⅱ:CO2(g) + C(s) 2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8
2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8
② 工业上可用CO2与H2反应制取甲烷、甲醇等化工产品。
回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为_______ 。该反应的平衡常数K =_______ 。
(2)在恒温恒压下,向甲、乙两个密闭容器中通入等物质的量的CH4和等物质的量的CO2,并分别加入两种不同催化剂ⅰ和ⅱ,测得相同时间内CO的百分含量随温度的变化关系如图所示,同时测得相同时间内甲烷和二氧化碳的转化率如下表所示。
① 催化剂_______ (填“ⅰ”或“ⅱ”)效果好,b点正反应速率_______ (填“>”“<”或“=”)b点逆反应速率;
② 从理论上讲,甲烷和二氧化碳的转化率应该相等,但从表格数据可知二氧化碳的转化率均大于甲烷,原因是_______ ;
③ 积碳是造成催化剂失活的主要原因,反应Ⅰ和反应Ⅱ均可能引起积碳,研究发现,如果反应Ⅰ不发生积碳过程,则反应Ⅱ也不会发生积碳过程。根据反应Ⅰ和反应Ⅱ分析,为保持催化剂的活性,应采取的措施是_______ 。
已知:① CH4—CO2催化重整的反应如下:
反应Ⅰ:CH4(g)
 C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25
C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25反应Ⅱ:CO2(g) + C(s)
 2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8
2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8② 工业上可用CO2与H2反应制取甲烷、甲醇等化工产品。
回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为
(2)在恒温恒压下,向甲、乙两个密闭容器中通入等物质的量的CH4和等物质的量的CO2,并分别加入两种不同催化剂ⅰ和ⅱ,测得相同时间内CO的百分含量随温度的变化关系如图所示,同时测得相同时间内甲烷和二氧化碳的转化率如下表所示。
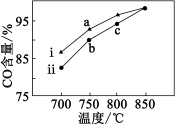 | 时间/小时 | 1 | 2 | 3 | 4 | 5 |
| 甲烷转化率/% | 65 | 71 | 80 | 87 | 92 | |
| 二氧化碳转化率/% | 66 | 73 | 83 | 89 | 94 |
② 从理论上讲,甲烷和二氧化碳的转化率应该相等,但从表格数据可知二氧化碳的转化率均大于甲烷,原因是
③ 积碳是造成催化剂失活的主要原因,反应Ⅰ和反应Ⅱ均可能引起积碳,研究发现,如果反应Ⅰ不发生积碳过程,则反应Ⅱ也不会发生积碳过程。根据反应Ⅰ和反应Ⅱ分析,为保持催化剂的活性,应采取的措施是
您最近一年使用:0次
2022-11-02更新
|
238次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三下学期2月月考化学试题
2011·广东·三模
名校
解题方法
8 . 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO 与水反应的方程式:4FeO
与水反应的方程式:4FeO +10H2O⇌4Fe(OH)3+8OH-+
+10H2O⇌4Fe(OH)3+8OH-+_____ 。K2FeO4在处理水的过程中所起的作用是___________ 和___________ 。
(2)常温下,Fe(OH)3的Ksp= 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式______________
(3)将适量K2FeO4配制成c(FeO )=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO
)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO )的变化,结果见图Ⅰ。第(1)题中的反应为FeO
)的变化,结果见图Ⅰ。第(1)题中的反应为FeO 变化的主反应,则温度对该反应的反应速率和平衡移动的影响是
变化的主反应,则温度对该反应的反应速率和平衡移动的影响是______________ ;发生反应的△H_____ 0(填“>”、“<”或“=”)。

(4)FeO 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是_____ (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO 的分布分数先增大后减小
的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO +H2O
+H2O
(1)请完成FeO
 与水反应的方程式:4FeO
与水反应的方程式:4FeO +10H2O⇌4Fe(OH)3+8OH-+
+10H2O⇌4Fe(OH)3+8OH-+(2)常温下,Fe(OH)3的Ksp= 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式
(3)将适量K2FeO4配制成c(FeO
 )=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO
)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO )的变化,结果见图Ⅰ。第(1)题中的反应为FeO
)的变化,结果见图Ⅰ。第(1)题中的反应为FeO 变化的主反应,则温度对该反应的反应速率和平衡移动的影响是
变化的主反应,则温度对该反应的反应速率和平衡移动的影响是
(4)FeO
 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO
 的分布分数先增大后减小
的分布分数先增大后减小C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO
 +H2O
+H2O
您最近一年使用:0次
2014·河北唐山·一模
名校
9 . 下列图示与对应的叙述相符合的是( )
A.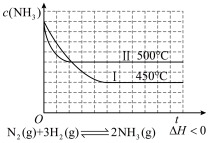 | B. |
C. | D. |
您最近一年使用:0次
2014-07-01更新
|
1036次组卷
|
3卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三上学期1月月考化学试题



