名校
解题方法
1 . 已知反应 其它条件不变时,混合物中物质C的百分含量与温度(T)、物质A的百分含量与压强(p)的关系如图。下列判断正确的是
其它条件不变时,混合物中物质C的百分含量与温度(T)、物质A的百分含量与压强(p)的关系如图。下列判断正确的是
 其它条件不变时,混合物中物质C的百分含量与温度(T)、物质A的百分含量与压强(p)的关系如图。下列判断正确的是
其它条件不变时,混合物中物质C的百分含量与温度(T)、物质A的百分含量与压强(p)的关系如图。下列判断正确的是
A.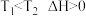 | B.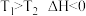 |
C. | D. |
您最近一年使用:0次
名校
2 .  催化加氢制甲醇,在减少
催化加氢制甲醇,在减少 排放的同时实现了
排放的同时实现了 的资源化,该反应可表示为
的资源化,该反应可表示为 ,保持起始反应物
,保持起始反应物 ,
,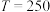 ℃时
℃时 随压强变化的曲线和
随压强变化的曲线和 Pa时
Pa时 随温度变化的曲线如图。
随温度变化的曲线如图。 表示平衡体系中甲醇的物质的量分数。
表示平衡体系中甲醇的物质的量分数。
下列说法正确的是
 催化加氢制甲醇,在减少
催化加氢制甲醇,在减少 排放的同时实现了
排放的同时实现了 的资源化,该反应可表示为
的资源化,该反应可表示为 ,保持起始反应物
,保持起始反应物 ,
,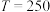 ℃时
℃时 随压强变化的曲线和
随压强变化的曲线和 Pa时
Pa时 随温度变化的曲线如图。
随温度变化的曲线如图。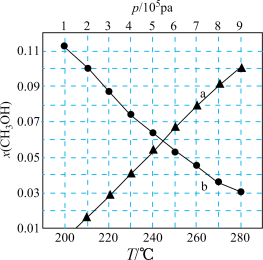
 表示平衡体系中甲醇的物质的量分数。
表示平衡体系中甲醇的物质的量分数。下列说法正确的是
| A.该反应正反应活化能大于逆反应活化能 |
| B.图中曲线变化说明高温、低压有利于提高原料利用率 |
C.当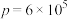 Pa、 Pa、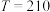 ℃时,达平衡后 ℃时,达平衡后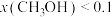 |
D.a、b曲线交点处 转化率相同,平衡常数不同 转化率相同,平衡常数不同 |
您最近一年使用:0次
3 . 二氧化碳( )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,低碳烯烃 作为基础化工原料,是 加氢转化的主要产品之一、
加氢转化的主要产品之一、
请回答:
(1)以合成 为例,其合成反应为:
为例,其合成反应为:

①已知 的燃烧热为
的燃烧热为 ;
;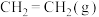 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
___________ (请用 、
、 、
、 表示)
表示)
②该反应在较低温度时能自发进行,可能原因为___________ 。
③在体积为V L的恒容密闭容器中,以 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为___________ , 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为___________ 。 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:
第一步: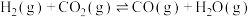

第二步: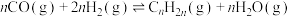

第二步的机理及可能的副反应如图: 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
①下列说法不正确的是___________ 。
A.第一步反应中,在催化剂表面, 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化
B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生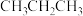 等副产品
等副产品
②在其他条件恒定的情况下,适当降低原料气的流速, 的转化率将
的转化率将___________ (填“增大”或“减小”),原因为___________ ;产物中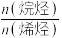 将
将___________ ,原因为___________ 。(结合反应机理中的步骤来回答)
 )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措, 加氢转化的主要产品之一、
加氢转化的主要产品之一、请回答:
(1)以合成
 为例,其合成反应为:
为例,其合成反应为:

①已知
 的燃烧热为
的燃烧热为 ;
;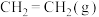 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
 、
、 、
、 表示)
表示)②该反应在较低温度时能自发进行,可能原因为
③在体积为V L的恒容密闭容器中,以
 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为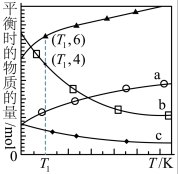
 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:第一步:
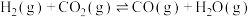

第二步:
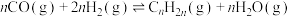

第二步的机理及可能的副反应如图:
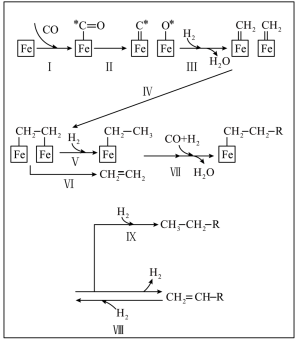
 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol①下列说法不正确的是
A.第一步反应中,在催化剂表面,
 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生
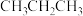 等副产品
等副产品②在其他条件恒定的情况下,适当降低原料气的流速,
 的转化率将
的转化率将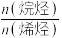 将
将
您最近一年使用:0次
名校
4 . 氨是一种重要的化工原料,主要用于化肥工业,也广汤用于硝酸、纯碱、制药等工业;实验室可以用浓氨水和CO制取氦气。工业上合成氨反应为N2(g)+3H2(g) 2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是
2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是
 2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是
2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是| A.0~10min的反应速率v(N2)=0.02mol∙L-1∙min-1 |
| B.10min时,H2的转化率为40% |
| C.10min时,反应前后气体压强之比为5∶1 |
| D.及时将体系中的NH3液化分离出来有利于加快反应速率 |
您最近一年使用:0次
解题方法
5 . 一定温度下,分别将两种亚硫酸氢盐加热分解,达平衡时的压强分别为 、
、 。
。
ⅰ.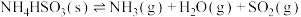
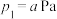
ⅱ.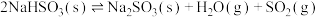
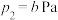
在该温度下,将一定质量的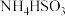 与
与 加入某密闭容器中,平衡时,三种固体均存在。下列说法
加入某密闭容器中,平衡时,三种固体均存在。下列说法不正确 的是
 、
、 。
。ⅰ.
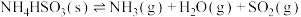
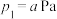
ⅱ.
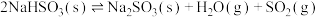
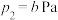
在该温度下,将一定质量的
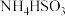 与
与 加入某密闭容器中,平衡时,三种固体均存在。下列说法
加入某密闭容器中,平衡时,三种固体均存在。下列说法A.平衡时,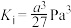 , ,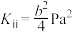 |
| B.保持恒温将容器体积压缩,再次平衡时各气体的浓度均减小 |
C.保持恒温、恒压,若再通入少量 ,再次平衡时容器内 ,再次平衡时容器内 的物质的量不变 的物质的量不变 |
D.保持恒温、恒容,若再通入少量 ,再次平衡时体系的总压强不变 ,再次平衡时体系的总压强不变 |
您最近一年使用:0次
名校
解题方法
6 . 实验探究是化学研究的重要手段。
Ⅰ.工业上利用反应:N2(g)+3H2(g) 2NH3(g) 合成氨气。在1×105Pa和25℃时,反应的ΔH=-92.4kJ·mol-1,回答下列问题:
2NH3(g) 合成氨气。在1×105Pa和25℃时,反应的ΔH=-92.4kJ·mol-1,回答下列问题:
(1)在1×105Pa和25℃时,将1mol N2和足量H2充分反应后,____ (填“吸收”或“放出”)的热量为Q,则Q____ 92.4 kJ(填“>”、“<”或“=”)
(2)合成氨反应在恒容密闭容器中进行,下列叙述能说明反应已达化学平衡状态的是_____ (填序号)。
a.2 v正(N2)=v逆(NH3) b.n(N2):n(H2):n(NH3)=1:3:2
c.容器中气体的密度不随时间而变化 d.容器中压强不变
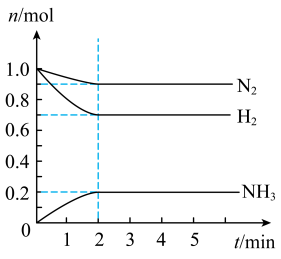
(3)某小组在实验室在2L密闭容器中进行合成氨反应,测出反应中各物质的物质的量变化如图,则反应进行到2min时用NH3表示的平均反应速率为_____ ,H2的转化率为______ 。_____ ,t2到t3反应速率降低的主要原因是 ______ 。
(5)乙图中,a为锌粒与足量稀硫酸反应产生氢气的体积随时间变化情况,其它条件不变,添加适量的下列试剂_____ (填序号),能使a变为b,其原理是_____ 。
A.CuSO4 B.HNO3 C.Na2SO4溶液 D.浓H2SO4
Ⅰ.工业上利用反应:N2(g)+3H2(g)
 2NH3(g) 合成氨气。在1×105Pa和25℃时,反应的ΔH=-92.4kJ·mol-1,回答下列问题:
2NH3(g) 合成氨气。在1×105Pa和25℃时,反应的ΔH=-92.4kJ·mol-1,回答下列问题:(1)在1×105Pa和25℃时,将1mol N2和足量H2充分反应后,
(2)合成氨反应在恒容密闭容器中进行,下列叙述能说明反应已达化学平衡状态的是
a.2 v正(N2)=v逆(NH3) b.n(N2):n(H2):n(NH3)=1:3:2
c.容器中气体的密度不随时间而变化 d.容器中压强不变
(3)某小组在实验室在2L密闭容器中进行合成氨反应,测出反应中各物质的物质的量变化如图,则反应进行到2min时用NH3表示的平均反应速率为
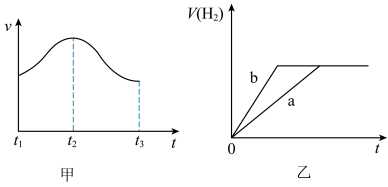
(5)乙图中,a为锌粒与足量稀硫酸反应产生氢气的体积随时间变化情况,其它条件不变,添加适量的下列试剂
A.CuSO4 B.HNO3 C.Na2SO4溶液 D.浓H2SO4
您最近一年使用:0次
7 .  是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含
是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含 、
、 、
、 、
、 、
、 、
、 )中提纯分离锂元素。
)中提纯分离锂元素。
已知:当一个反应的K大于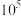 时,可以认为该反应进行完全
时,可以认为该反应进行完全
Ⅰ.沉淀法提锂
(1)向盐湖卤水中加入磷酸盐,然后用NaOH溶液调节pH,可以分步得到 、
、 、
、 、
、 沉淀。
沉淀。
①调节pH过程中, 将转化为
将转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②实验过程中若要使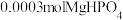 转化完全,溶液的pH至少要调节至
转化完全,溶液的pH至少要调节至___________ 。(设溶液的体积为1L)。
Ⅱ.吸附法提锂
锂锰氧化合物离子筛是一种常用的提取锂离子的无机材料,提锂机理分为氧化还原吸附及离子交换吸附。
(2)氧化还原吸附
①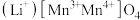 是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素___________ (填元素符号)

②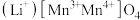 吸附锂的机理分两步进行:
吸附锂的机理分两步进行:
第一步酸性条件下脱锂,获得(□)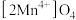 ,“□”是晶体中的空位,反应如下:
,“□”是晶体中的空位,反应如下: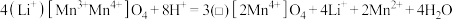
第二步取出(口)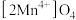 并洗净后投入碱性含锂溶液中,吸附
并洗净后投入碱性含锂溶液中,吸附 后恢复为
后恢复为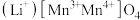 并有气体放出,请书写第二步反应的离子方程式
并有气体放出,请书写第二步反应的离子方程式___________ 。
③该吸附剂的另一优点是选择性高,吸附 而几乎不能吸附溶液中的
而几乎不能吸附溶液中的 、
、 ,其可能的原因是
,其可能的原因是___________ 。
(3)离子交换吸附
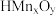 是离子交换吸附材料,其吸附交换原理为
是离子交换吸附材料,其吸附交换原理为 ,用等量的
,用等量的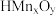 吸附相同体积溶液中的
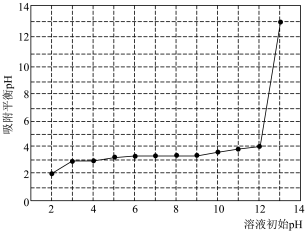
吸附相同体积溶液中的 ,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的
,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的 ,控制溶液起始pH必须大于
,控制溶液起始pH必须大于___________ 。请确定溶液起始吸附最佳的pH并说明理由___________ 。
 是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含
是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含 、
、 、
、 、
、 、
、 、
、 )中提纯分离锂元素。
)中提纯分离锂元素。已知:当一个反应的K大于
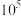 时,可以认为该反应进行完全
时,可以认为该反应进行完全Ⅰ.沉淀法提锂
(1)向盐湖卤水中加入磷酸盐,然后用NaOH溶液调节pH,可以分步得到
 、
、 、
、 、
、 沉淀。
沉淀。①调节pH过程中,
 将转化为
将转化为 ,该反应的离子方程式为
,该反应的离子方程式为②实验过程中若要使
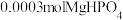 转化完全,溶液的pH至少要调节至
转化完全,溶液的pH至少要调节至Ⅱ.吸附法提锂
锂锰氧化合物离子筛是一种常用的提取锂离子的无机材料,提锂机理分为氧化还原吸附及离子交换吸附。
(2)氧化还原吸附
①
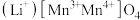 是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
②
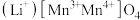 吸附锂的机理分两步进行:
吸附锂的机理分两步进行:第一步酸性条件下脱锂,获得(□)
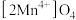 ,“□”是晶体中的空位,反应如下:
,“□”是晶体中的空位,反应如下: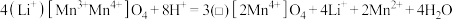
第二步取出(口)
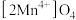 并洗净后投入碱性含锂溶液中,吸附
并洗净后投入碱性含锂溶液中,吸附 后恢复为
后恢复为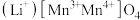 并有气体放出,请书写第二步反应的离子方程式
并有气体放出,请书写第二步反应的离子方程式③该吸附剂的另一优点是选择性高,吸附
 而几乎不能吸附溶液中的
而几乎不能吸附溶液中的 、
、 ,其可能的原因是
,其可能的原因是(3)离子交换吸附
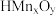 是离子交换吸附材料,其吸附交换原理为
是离子交换吸附材料,其吸附交换原理为 ,用等量的
,用等量的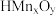 吸附相同体积溶液中的
吸附相同体积溶液中的 ,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的
,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的 ,控制溶液起始pH必须大于
,控制溶液起始pH必须大于
您最近一年使用:0次
解题方法
8 . 在催化剂作用下,以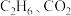 为原料合成
为原料合成 ,主要反应有:
,主要反应有:
反应1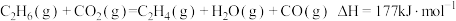
反应2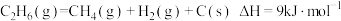
将一定量体积比为 的
的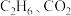 混合气体按一定流速通过催化反应管,测得
混合气体按一定流速通过催化反应管,测得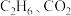 的转化率随温度变化的关系如题图所示.
的转化率随温度变化的关系如题图所示. 的选择性
的选择性
下列说法不正确 的是
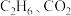 为原料合成
为原料合成 ,主要反应有:
,主要反应有:反应1
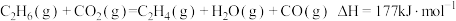
反应2
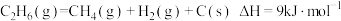
将一定量体积比为
 的
的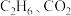 混合气体按一定流速通过催化反应管,测得
混合气体按一定流速通过催化反应管,测得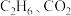 的转化率随温度变化的关系如题图所示.
的转化率随温度变化的关系如题图所示.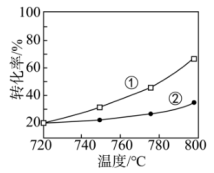
 的选择性
的选择性
下列说法
A.图中曲线①表示 转化率随温度的变化 转化率随温度的变化 |
B.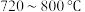 范围内,随温度的升高, 范围内,随温度的升高, 的选择性不断减小 的选择性不断减小 |
C.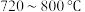 范围内,随温度的升高,出口处 范围内,随温度的升高,出口处 及 及 的量均增大 的量均增大 |
D.其他条件不变,加入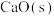 或选用高效催化剂,均能提高平衡时 或选用高效催化剂,均能提高平衡时 产率 产率 |
您最近一年使用:0次
9 . 请回答下列问题:
(1)
 ,已知该反应在T℃时,平衡常数K=9.0。
,已知该反应在T℃时,平衡常数K=9.0。
①该反应的平衡常数表达式为:K=___________ 。
②某温度下,向2L的密闭容器中充入 和
和 各1mol,5s后
各1mol,5s后 的物质的量为0.4mol,则0~5s内NO的反应速率
的物质的量为0.4mol,则0~5s内NO的反应速率___________  。
。
③下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是___________ 。
A. B.
B.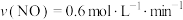
C. D.
D.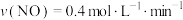
④T℃时,某时刻测得容器内 、
、 、NO的浓度分别为0.20mol/L、0.20mol/L和0.50mol/L,此时反应v正(
、NO的浓度分别为0.20mol/L、0.20mol/L和0.50mol/L,此时反应v正( )
)___________ v逆( )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
(2)研发氨燃料电池是当前科研的一个热点,如图所示:
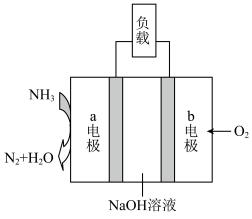
①该电池负极的电极反应式为___________ 。
②当有6mol发生转移时,消耗 的质量为
的质量为___________ 。
③若该电池用于金属表面镀银,___________ (填“a”或“b”)电极连接镀件(待镀金属)。
(1)

 ,已知该反应在T℃时,平衡常数K=9.0。
,已知该反应在T℃时,平衡常数K=9.0。①该反应的平衡常数表达式为:K=
②某温度下,向2L的密闭容器中充入
 和
和 各1mol,5s后
各1mol,5s后 的物质的量为0.4mol,则0~5s内NO的反应速率
的物质的量为0.4mol,则0~5s内NO的反应速率 。
。③下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是
A.
 B.
B.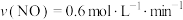
C.
 D.
D.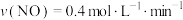
④T℃时,某时刻测得容器内
 、
、 、NO的浓度分别为0.20mol/L、0.20mol/L和0.50mol/L,此时反应v正(
、NO的浓度分别为0.20mol/L、0.20mol/L和0.50mol/L,此时反应v正( )
) )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。(2)研发氨燃料电池是当前科研的一个热点,如图所示:

①该电池负极的电极反应式为
②当有6mol发生转移时,消耗
 的质量为
的质量为③若该电池用于金属表面镀银,
您最近一年使用:0次
解题方法
10 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密团容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据表中数据分析T1℃时,该反应在0-10 min内的平均反应速率v(NO)=_______ ;写出此反应的化学平衡常数表达式K=_______ 。
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率_______ (填“升高”或“降低”)。
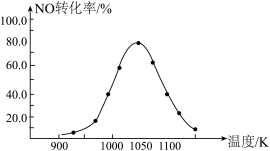
③在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率α(NO)随温度的变化如图所示。由图可知,1050K 前反应中NO的转化率随温度升高面增大,原因是_______ 。
(2)以连二硫酸根(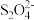 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
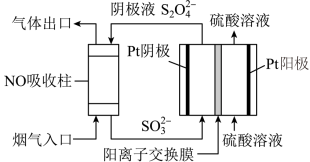
①阴极区的电极反应式为_______ 。
②NO吸收转化后的主要产物为NH3,若通电时电路中转移了1.0mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______ L。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密团容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.80 | 0.80 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 |
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
③在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率α(NO)随温度的变化如图所示。由图可知,1050K 前反应中NO的转化率随温度升高面增大,原因是

(2)以连二硫酸根(
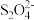 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH3,若通电时电路中转移了1.0mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为
您最近一年使用:0次



