1 . 在温度T时,某反应的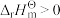 ,
,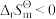 ,则下列关于该反应的
,则下列关于该反应的 说法正确的是
说法正确的是
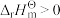 ,
,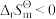 ,则下列关于该反应的
,则下列关于该反应的 说法正确的是
说法正确的是A.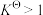 ,随温度升高而增大 ,随温度升高而增大 | B.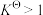 ,随温度升高而减小 ,随温度升高而减小 |
C. ,随温度升高而增大 ,随温度升高而增大 | D. ,随温度升高而减小 ,随温度升高而减小 |
您最近一年使用:0次
解题方法
2 . 2021年11月2日,第四届世界顶尖科学家碳大会——通往“双碳目标”的科技之路论坛在上海召开。我国科学家刘科提到了绿色甲醇技术,将 转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
Ⅰ.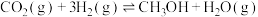

Ⅱ.

Ⅲ.

回答下列问题:
(1)已知上述反应Ⅰ、Ⅱ、Ⅲ的平衡常数K与温度T的关系为: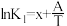 ,
,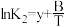 ,
,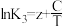 (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能
(x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能 (正)
(正) _______ 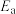 (逆),
(逆),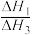 的数值范围是
的数值范围是_______ 。
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,可用 与
与 合成
合成 [
[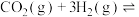
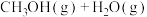 ],反应的催化剂,在发展非金属催化剂实现
],反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示: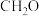 ,其中相对较少的副产物为
,其中相对较少的副产物为_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.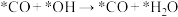 B.
B.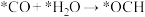
C. D.
D.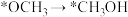
(3)向三个体积均为2 L的恒容密闭容器中分别充入1 mol 和3 mol
和3 mol  ,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中
,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中 的转化率随温度变化的数据如下表所示。(
的转化率随温度变化的数据如下表所示。( 时,
时, 的转化率为66.67%。即转化了
的转化率为66.67%。即转化了 )
)
①在温度为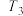 时,催化效果最好的催化剂是
时,催化效果最好的催化剂是_______ (填“催化剂a”、“催化剂b”或“催化剂c”)。
②温度为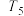 时,该反应的浓度平衡常数
时,该反应的浓度平衡常数
_______ 。
(4)当压强分别为 、
、 时,将
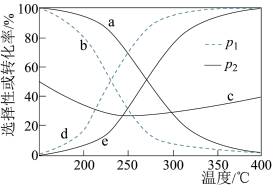
时,将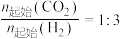 的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中
的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中 的平衡转化率和
的平衡转化率和 、
、 的选择性如下图所示。{
的选择性如下图所示。{ [或
[或 ]的选择性
]的选择性 }
}_______ (填“ ”或“CO”)的选择性,原因是
”或“CO”)的选择性,原因是_______ 。
②
_______ (填“>”或“<”) 。
。
 转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。Ⅰ.
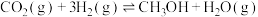

Ⅱ.


Ⅲ.


回答下列问题:
(1)已知上述反应Ⅰ、Ⅱ、Ⅲ的平衡常数K与温度T的关系为:
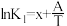 ,
,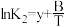 ,
,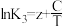 (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能
(x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能 (正)
(正) 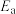 (逆),
(逆),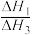 的数值范围是
的数值范围是(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,可用
 与
与 合成
合成 [
[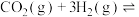
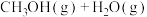 ],反应的催化剂,在发展非金属催化剂实现
],反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示: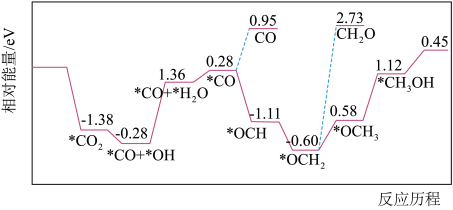
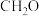 ,其中相对较少的副产物为
,其中相对较少的副产物为②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.
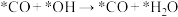 B.
B.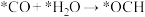
C.
 D.
D.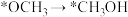
(3)向三个体积均为2 L的恒容密闭容器中分别充入1 mol
 和3 mol
和3 mol  ,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中
,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中 的转化率随温度变化的数据如下表所示。(
的转化率随温度变化的数据如下表所示。( 时,
时, 的转化率为66.67%。即转化了
的转化率为66.67%。即转化了 )
)温度 转化率 使用的催化剂 |  | 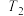 | 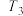 | 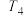 | 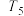 |
| 催化剂a | 65% | 77% | 80% | 80% | 66.67% |
| 催化剂b | 56% | 67% | 76% | 80% | 66.67% |
| 催化剂c | 48% | 62% | 72% | 80% | 66.67% |
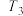 时,催化效果最好的催化剂是
时,催化效果最好的催化剂是②温度为
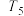 时,该反应的浓度平衡常数
时,该反应的浓度平衡常数
(4)当压强分别为
 、
、 时,将
时,将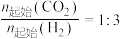 的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中
的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中 的平衡转化率和
的平衡转化率和 、
、 的选择性如下图所示。{
的选择性如下图所示。{ [或
[或 ]的选择性
]的选择性 }
}
 ”或“CO”)的选择性,原因是
”或“CO”)的选择性,原因是②

 。
。
您最近一年使用:0次
2023-05-13更新
|
319次组卷
|
2卷引用:广东省佛山市H7教育共同体2023-2024学年高二下学期学科竞赛化学试题
名校
解题方法
3 .  和
和 重整制取合成气CO和
重整制取合成气CO和 ,在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:
,在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:
反应a:

反应b:

反应c:
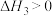
反应d: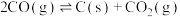
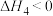
(1)重整时往反应体系中通入一定量的水蒸气,可在消除积碳的同时生成水煤气,反应为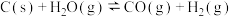 ,该反应的△H=
,该反应的△H=_____________ (写出一个代数式)。
(2)关于 和
和 重整,下列说法正确的是 (填编号)。
重整,下列说法正确的是 (填编号)。
(3)一定压强下,按照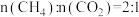 投料,
投料, 和
和 重整反应达到平衡时各组分的物质的量分数随温度的变化如图所示
重整反应达到平衡时各组分的物质的量分数随温度的变化如图所示
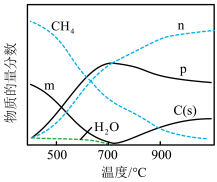
①图中曲线m、n分别表示物质_____________ 、_____________ 的变化(选填“ ”“CO”或“
”“CO”或“ ”)。
”)。
②700℃后,C(s)的物质的量分数随温度升高而增大的原因是_______________________________________ 。
③某温度下体系中不存在积碳, 和
和 的物质的量分数分别是0.50、0.04,该温度下甲烷的平衡转化率为
的物质的量分数分别是0.50、0.04,该温度下甲烷的平衡转化率为_____________ ,反应b的平衡常数K=_____________ (列出计算式)。
 和
和 重整制取合成气CO和
重整制取合成气CO和 ,在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:
,在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:反应a:


反应b:


反应c:

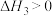
反应d:
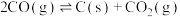
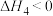
(1)重整时往反应体系中通入一定量的水蒸气,可在消除积碳的同时生成水煤气,反应为
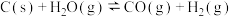 ,该反应的△H=
,该反应的△H=(2)关于
 和
和 重整,下列说法正确的是 (填编号)。
重整,下列说法正确的是 (填编号)。A. 的物质的量保持不变时,反应体系达到平衡状态 的物质的量保持不变时,反应体系达到平衡状态 |
B.恒容时通入 增大压强, 增大压强, 的平衡转化率减小 的平衡转化率减小 |
| C.加入反应c的催化剂,该反应的平衡常数K增大 |
D.达到平衡后,降低反应温度,反应d的 |
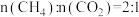 投料,
投料, 和
和 重整反应达到平衡时各组分的物质的量分数随温度的变化如图所示
重整反应达到平衡时各组分的物质的量分数随温度的变化如图所示
①图中曲线m、n分别表示物质
 ”“CO”或“
”“CO”或“ ”)。
”)。②700℃后,C(s)的物质的量分数随温度升高而增大的原因是
③某温度下体系中不存在积碳,
 和
和 的物质的量分数分别是0.50、0.04,该温度下甲烷的平衡转化率为
的物质的量分数分别是0.50、0.04,该温度下甲烷的平衡转化率为
您最近一年使用:0次
2023-04-19更新
|
1228次组卷
|
3卷引用:广东省普宁市勤建学校2022-2023学年高二下学期学科竞赛化学试题
4 . 一定温度下在体积为5L的密闭容器中发生可逆反应。
(I)若某可逆反应的化学平衡常数表达式为:K=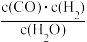
(1)写出该反应的化学方程式:___ 。
(2)能判断该反应一定达到化学平衡状态的依据是___ (填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. v正(H2O)=v逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中总的物质的量不随时间而变化
E. 消耗nmolH2的同时消耗nmolCO
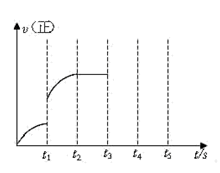
(II)若该密闭容器中加入的是2molFe(s)与1molH2O(g)(该反应△H<0),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol。
(3)t1~t2这段时间内的化学反应速率v(H2)=___ 。
(4)若继续加入2molFe(s),则平衡___ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(5)该反应的正反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是___ 。
(I)若某可逆反应的化学平衡常数表达式为:K=
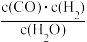
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是
A. 容器中气体的平均相对分子质量不随时间而变化
B. v正(H2O)=v逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中总的物质的量不随时间而变化
E. 消耗nmolH2的同时消耗nmolCO
(II)若该密闭容器中加入的是2molFe(s)与1molH2O(g)(该反应△H<0),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol。
(3)t1~t2这段时间内的化学反应速率v(H2)=
(4)若继续加入2molFe(s),则平衡
(5)该反应的正反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是

您最近一年使用:0次
5 . 994 K,当H2缓慢通过过量的块状固体CoO时,部分CoO被还原为固体Co。在流出的平衡气体中H2的物质的量分数为2.50%; 在同一温度,若用CO还原固体CoO时平衡气体中CO的物质的量分数为1.92%。 如果994 K时物质的量比为1:2的一氧化碳和水蒸气的混合物在一定条件下反应,问:
(1)一氧化碳的平衡转化率大约是多少___________ ?
(2)欲获得较纯的H2,请简要说明在生产工艺上应采取的措施___________ 。
(3)994 K,当H2缓慢通过过量的纳米CoO固体粉末时,部分CoO被还原为固体Co。在相同的反应时间内,与块状固体CoO相比,采用纳米固体CoO时流出的平衡气体中H2的物质的量分数将怎样变化___________ ?为什么___________ ?
(1)一氧化碳的平衡转化率大约是多少
(2)欲获得较纯的H2,请简要说明在生产工艺上应采取的措施
(3)994 K,当H2缓慢通过过量的纳米CoO固体粉末时,部分CoO被还原为固体Co。在相同的反应时间内,与块状固体CoO相比,采用纳米固体CoO时流出的平衡气体中H2的物质的量分数将怎样变化
您最近一年使用:0次
6 . 下图表示三个具有相同机理的可逆反应的产物浓度随时间的变化曲线,下列有关说法中,正确的是
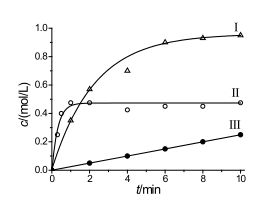
| A.达到平衡最快的是II | B.反应约5分钟后,三个反应均已达到平衡 |
| C.平衡转化率最高的是I | D.三个反应的平衡常数相同 |
您最近一年使用:0次
7 . 对于反应Ag2CO3(s) ⇌Ag2O(s) + CO2(g),其298.15K下的反应焓变为ΔH= 81.5kJ·mol-1,下列说法中 正确的是
| A.Ag2CO3的转化率随着温度升高而增大 |
| B.反应平衡常数不随其他因素而改变 |
| C.反应体系中存在Ag2CO3,Ag2O和CO2 |
| D.在敞开体系中,Ag2CO3完 全分解为Ag2O |
您最近一年使用:0次
解题方法
8 . 乙二醛(OHC-CHO)是一种重要的精细化工产品。乙二醇(HOCH2CH2OH)气相氧化法是制备乙二醛重要方法。已知:OHC-CHO(g)+2H2(g)=HOCH2CH2OH(g),△H=-78kJ·mol-l;2H2(g)+O2(g)=2H2O(g),△H=-484kJ·mol-l,平衡常数分别为K1及K2。下列说法正确的是
| A.升高温度有利于提高乙二醛产率 |
| B.增大压强有利于提高乙二醛产率 |
| C.乙二醇气相氧化的热化学方程式为:HOCH2CH2OH(g)+O2(g)=OHC-CHO(g)+2H2O(g)的△H=-406kJ·mol-l |
| D.乙二醇气相氧化反应平衡常数K=K1·K2 |
您最近一年使用:0次
9 . SO2的氧化是工业制硫酸中的一步重要反应:2SO2(g)+O2(g)=2SO3(g) △H(△H<0)。如果反应在密闭容器中进行,达到平衡后,以下说法中,正确的是
| A.升高温度,正反应速率增大,化学平衡常数增大 |
| B.增加压强,平衡会向右移动 |
| C.加入催化剂后,正逆反应速率均不变,平衡不移动 |
| D.达到平衡状态时,SO2的消耗速率与SO2的生成速率相等 |
您最近一年使用:0次



