名校
解题方法
1 . 铁及其化合物的制备与性质探究。
I.乳酸亚铁[CH3CH(OH)COO]2Fe是一种常见的补血剂,可由FeCO3与乳酸反应制得,实验室经常采用如下装置制备FeCO3(夹持装置略)。
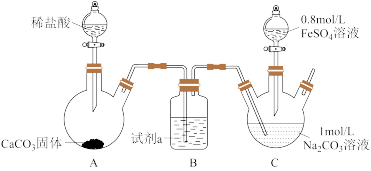
具体实验流程如下:装置C中,先通入CO2至pH约为7,滴加一定量FeSO4,将所得白色沉淀过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a为_______ 。
(2)写出整个实验过程中C中发生反应的离子方程式_______ 。
(3)某实验小组用酸性高锰酸钾标准液去测定补血剂中乳酸亚铁含量,从而计算乳酸亚铁的质量分数,经过反复多次测定乳酸亚铁的质量分数总是大于100%,其原因是_______ 。
II.无水FeCl3是一种常见的化工原料,实验室可采用下列装置制备。
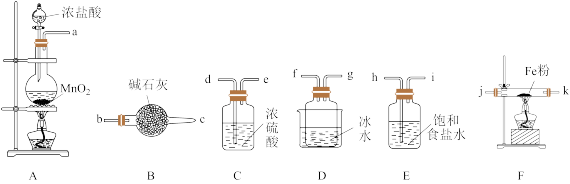
已知:①FeCl3极易水解;②FeCl3在300℃以上升华。
(4)装置的连接顺序为a→_______ →j→k→_______ (按气流方向,用小写字母表示)。
(5)将所得无水FeCl3溶于_______ 可得FeCl3溶液,FeCl3溶液是一种常用的创伤止血剂,其止血原理为_______ 。
(6)某兴趣小组在FeCl3溶液中通入SO2,观察到的主要现象为随着SO2的通入,溶液迅速由黄色变为红棕色,静置一小时后溶液变为浅绿色。通过查阅资料得知,溶液中主要有两种变化,第一种:Fe2+与SO2会生成一种络合物[Fe(SO2)6]3+(红棕色);第二种:Fe3+与SO2发生氧化还原反应。
①写出第二种情况下反应的离子方程式:_______ 。
②这两种反应平衡常数的大小关系为K1_______ K2(填“<”“>”或“=”)。
I.乳酸亚铁[CH3CH(OH)COO]2Fe是一种常见的补血剂,可由FeCO3与乳酸反应制得,实验室经常采用如下装置制备FeCO3(夹持装置略)。

具体实验流程如下:装置C中,先通入CO2至pH约为7,滴加一定量FeSO4,将所得白色沉淀过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a为
(2)写出整个实验过程中C中发生反应的离子方程式
(3)某实验小组用酸性高锰酸钾标准液去测定补血剂中乳酸亚铁含量,从而计算乳酸亚铁的质量分数,经过反复多次测定乳酸亚铁的质量分数总是大于100%,其原因是
II.无水FeCl3是一种常见的化工原料,实验室可采用下列装置制备。

已知:①FeCl3极易水解;②FeCl3在300℃以上升华。
(4)装置的连接顺序为a→
(5)将所得无水FeCl3溶于
(6)某兴趣小组在FeCl3溶液中通入SO2,观察到的主要现象为随着SO2的通入,溶液迅速由黄色变为红棕色,静置一小时后溶液变为浅绿色。通过查阅资料得知,溶液中主要有两种变化,第一种:Fe2+与SO2会生成一种络合物[Fe(SO2)6]3+(红棕色);第二种:Fe3+与SO2发生氧化还原反应。
①写出第二种情况下反应的离子方程式:
②这两种反应平衡常数的大小关系为K1
您最近一年使用:0次
名校
解题方法
2 . FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
(1)制备无水氯化铁
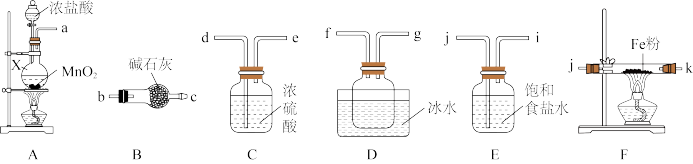
①仪器X的名称为_______ 。
②装置A中发生反应的化学方程式为_______
③装置的连接顺序为a→_______ →j,k→_______ (按气流方向,用小写字母表示)。
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为①_______
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)_______ E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)_______ K(ii)。
⑤另取5mLlmol⋅L−1FeCl3溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是_______ 。
(1)制备无水氯化铁

①仪器X的名称为
②装置A中发生反应的化学方程式为
③装置的连接顺序为a→
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为①
| 步骤 | 现象 | 结论 |
| I.取5mL1mol⋅L−1FeCl3溶液于试管中,通入SO2至饱和 | 溶液很快由黄色变为红棕色 | |
| II.用激光笔照射步骤I中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| III.将步骤I中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | |
| IV.向步骤III中溶液加入2滴K3[Fe(CN)6]溶液 | ③ | 溶液中含有Fe2+ |
⑤另取5mLlmol⋅L−1FeCl3溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是
您最近一年使用:0次
2022高三·浙江·专题练习
解题方法
3 . 验证反应Fe2++Ag+⇌Ag+Fe3+可逆并测定其K。
实验I:将0.01mol/LAg2SO4溶液与0.04mo/LFeSO4溶液(pH=1)等体积混合,得到灰黑色的沉淀和黄色的溶液。
实验II:将少量Ag粉与0.01mol/LFe2(SO4)3溶液(pH=1)混合,Ag粉完全溶解。
(1)①向实验I所得溶液中加入浓硝酸,证实灰黑色固体是Ag。现象是___________ 。
②实验II使用的是Fe2(SO4)3溶液,而不是Fe(NO3)3溶液,原因是___________ 。使用如下装置从平衡移动的角度进行证明。补全试剂、操作及现象___________ 。
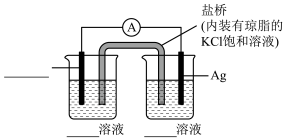
(2)取I中所得上清液VmL。用c1mol/L的KSCN溶液滴定,至溶液变为稳定浅红色时,消耗V1mL。
已知:Ag++SCN-⇌AgSCN,K=1012
Fe3++SCN-⇌FeSCN2+,K=102.3
①溶液中,Fe3+的作用是___________ 。
②反应的平衡常数是___________ 。
(3)①若取实验I所得浊液测定Ag+浓度,所得到的K___________ (填“偏大”、“无影响”、“偏小”)。
②不用实验II所得溶液进行测定并计算K的原因是___________ 。
实验I:将0.01mol/LAg2SO4溶液与0.04mo/LFeSO4溶液(pH=1)等体积混合,得到灰黑色的沉淀和黄色的溶液。
实验II:将少量Ag粉与0.01mol/LFe2(SO4)3溶液(pH=1)混合,Ag粉完全溶解。
(1)①向实验I所得溶液中加入浓硝酸,证实灰黑色固体是Ag。现象是
②实验II使用的是Fe2(SO4)3溶液,而不是Fe(NO3)3溶液,原因是

(2)取I中所得上清液VmL。用c1mol/L的KSCN溶液滴定,至溶液变为稳定浅红色时,消耗V1mL。
已知:Ag++SCN-⇌AgSCN,K=1012
Fe3++SCN-⇌FeSCN2+,K=102.3
①溶液中,Fe3+的作用是
②反应的平衡常数是
(3)①若取实验I所得浊液测定Ag+浓度,所得到的K
②不用实验II所得溶液进行测定并计算K的原因是
您最近一年使用:0次
名校
解题方法
4 . 某电镀废水中的铬元素以 和
和 的形式存在,其总铬含量的测定方法如下。
的形式存在,其总铬含量的测定方法如下。
步骤一:取 废水,加热浓缩成
废水,加热浓缩成 溶液,然后加入
溶液,然后加入 溶液将
溶液将 转化为
转化为 ;
;
步骤二:加入稍过量的 ,使
,使 在碱性条件下转化成
在碱性条件下转化成 ;
;
步骤三:加入硫酸酸化并煮沸后,加入足量的碘化钾将六价铬还原为 ,同时生成单质
,同时生成单质 ;
;
步骤四:加入指示剂用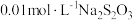 溶液滴定,滴定过程中消耗
溶液滴定,滴定过程中消耗 溶液
溶液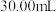 。
。
已知: ,请回答下列问题:
,请回答下列问题:
(1)“步骤三”中加硫酸酸化时存在反应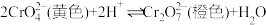 ,则该反应平衡常数的表达式为
,则该反应平衡常数的表达式为
_______ 。升高溶液的温度会导致溶液黄色加深,则该反应的
_______ 0(填“>”或“<”)。
(2)若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果_______ (填“偏高”、“偏低”或“无影响”)。
(3)“步骤四”中加入的指示剂为_______ ,盛装 溶液的滴定管,滴定前排气泡时,应选择如图中的
溶液的滴定管,滴定前排气泡时,应选择如图中的_______ (填选项字母);滴定终点时的现象为_______ 。
a. b.
b.  c.
c.  d.
d.
(4)硫代硫酸钠晶体( )不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分
)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分 ,含少量
,含少量 )及纯碱等为原料制备
)及纯碱等为原料制备 的流程如下:
的流程如下:

 溶液中
溶液中
_______  (填“>”、“<”或“=”),“反应”过程中体系
(填“>”、“<”或“=”),“反应”过程中体系 过小产品产率降低的原因是
过小产品产率降低的原因是_______ (用离子方程式表示),提纯 时,应用
时,应用_______ 洗涤。
 和
和 的形式存在,其总铬含量的测定方法如下。
的形式存在,其总铬含量的测定方法如下。步骤一:取
 废水,加热浓缩成
废水,加热浓缩成 溶液,然后加入
溶液,然后加入 溶液将
溶液将 转化为
转化为 ;
;步骤二:加入稍过量的
 ,使
,使 在碱性条件下转化成
在碱性条件下转化成 ;
;步骤三:加入硫酸酸化并煮沸后,加入足量的碘化钾将六价铬还原为
 ,同时生成单质
,同时生成单质 ;
;步骤四:加入指示剂用
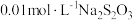 溶液滴定,滴定过程中消耗
溶液滴定,滴定过程中消耗 溶液
溶液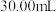 。
。已知:
 ,请回答下列问题:
,请回答下列问题:(1)“步骤三”中加硫酸酸化时存在反应
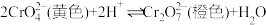 ,则该反应平衡常数的表达式为
,则该反应平衡常数的表达式为

(2)若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果
(3)“步骤四”中加入的指示剂为
 溶液的滴定管,滴定前排气泡时,应选择如图中的
溶液的滴定管,滴定前排气泡时,应选择如图中的a.
 b.
b.  c.
c.  d.
d.
(4)硫代硫酸钠晶体(
 )不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分
)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分 ,含少量
,含少量 )及纯碱等为原料制备
)及纯碱等为原料制备 的流程如下:
的流程如下:
 溶液中
溶液中
 (填“>”、“<”或“=”),“反应”过程中体系
(填“>”、“<”或“=”),“反应”过程中体系 过小产品产率降低的原因是
过小产品产率降低的原因是 时,应用
时,应用
您最近一年使用:0次
2022-01-27更新
|
274次组卷
|
2卷引用:山东省济宁市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
5 . 过氧化钠是一种重要的强氧化剂,也能作为封闭生态系统的CO2吸收剂和生氧剂,其反应原理为:2Na2O2+2CO2=2NaCO3+O2。答下列问题:
(1)上述反应中两种同周期原子的半径大小为______ (填写元素符号)。反应中破坏的化学键类型有______ 。
(2)S和O位于元素周期表同一主族,非金属性:S______ O(填“<”、“>”或“=”),用一个化学方程式说明判断的理由:______ 。
(3)过氧化钠在日常保存时常因发生反应: ,而发生变质。
,而发生变质。
①该反应的平衡常数表达式为______ 。
②向保存在恒温密闭容器中过氧化钠中通入少量O2,固体质量将______ (“增大”、“减小”或“不变”,下同),达到新平衡时容器内气体的压强将______ 。
(4)利用如图装置探究Na2O2与SO2反应的产物。实验中当通入二氧化硫气体,将带有火星的木条插入试管C中,木条复燃。有同学猜测,B中反应后的固体产物可能是亚硫酸钠和硫酸钠的混合物。
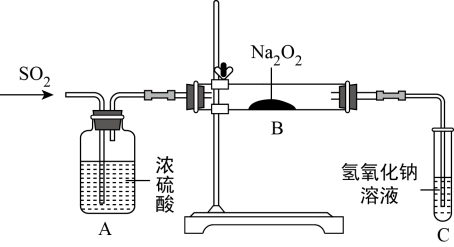
①该同学认为存在硫酸钠的原因是______ (用化学方程式解释)。
②设计一个简单的实验证明是否存在硫酸钠。简要地写出实验的步骤、现象和结论______ 。
(1)上述反应中两种同周期原子的半径大小为
(2)S和O位于元素周期表同一主族,非金属性:S
(3)过氧化钠在日常保存时常因发生反应:
 ,而发生变质。
,而发生变质。①该反应的平衡常数表达式为
②向保存在恒温密闭容器中过氧化钠中通入少量O2,固体质量将
(4)利用如图装置探究Na2O2与SO2反应的产物。实验中当通入二氧化硫气体,将带有火星的木条插入试管C中,木条复燃。有同学猜测,B中反应后的固体产物可能是亚硫酸钠和硫酸钠的混合物。

①该同学认为存在硫酸钠的原因是
②设计一个简单的实验证明是否存在硫酸钠。简要地写出实验的步骤、现象和结论
您最近一年使用:0次
2021-01-07更新
|
187次组卷
|
2卷引用:新疆维吾尔自治区喀什地区喀什市第六中学2022-2023学年高三上学期10月期中化学试题
6 . 捕集 的技术对解决全球温室效应意义重大。回答下列问题:
的技术对解决全球温室效应意义重大。回答下列问题:
(1)国际空间站处理 的一个重要方法是将
的一个重要方法是将 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为: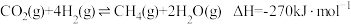 几种化学键的键能如表所示:
几种化学键的键能如表所示:
则a=______ 。
(2)将 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一,装置如图所示:
资源化利用的有效途径之一,装置如图所示:
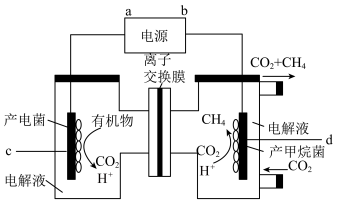
① 的移动方向为
的移动方向为______ (填“自左至右”或“自右至左”);d电极的电极反应式为______ 。
②若电源为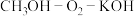 清洁燃料电池,当消耗
清洁燃料电池,当消耗 燃料
燃料 时,离子交换膜中通过
时,离子交换膜中通过______ 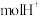 ,该清洁燃料电池中的正极反应式为
,该清洁燃料电池中的正极反应式为______ 。
(3)甲醇是一种可再生能源,由 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:
反应Ⅰ: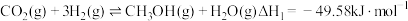
反应Ⅱ: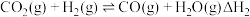
反应Ⅲ:
①反应Ⅱ的
______  。
。
②若反应Ⅱ在一恒温恒容密闭容器中进行,下面能说明反应已达到平衡状态的是______ 。
a.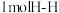 断裂的同时有
断裂的同时有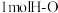 断裂
断裂
b.气体密度不变
c.平衡常数不变
d.容器内 保持不变
保持不变
 的技术对解决全球温室效应意义重大。回答下列问题:
的技术对解决全球温室效应意义重大。回答下列问题:(1)国际空间站处理
 的一个重要方法是将
的一个重要方法是将 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为: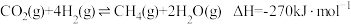 几种化学键的键能如表所示:
几种化学键的键能如表所示:化学键 |
|
|
|
|
键能/ | 413 | 436 | a | 745 |
(2)将
 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一,装置如图所示:
资源化利用的有效途径之一,装置如图所示:
①
 的移动方向为
的移动方向为②若电源为
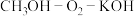 清洁燃料电池,当消耗
清洁燃料电池,当消耗 燃料
燃料 时,离子交换膜中通过
时,离子交换膜中通过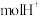 ,该清洁燃料电池中的正极反应式为
,该清洁燃料电池中的正极反应式为(3)甲醇是一种可再生能源,由
 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:反应Ⅰ:
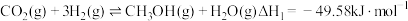
反应Ⅱ:
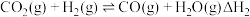
反应Ⅲ:

①反应Ⅱ的

 。
。②若反应Ⅱ在一恒温恒容密闭容器中进行,下面能说明反应已达到平衡状态的是
a.
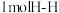 断裂的同时有
断裂的同时有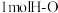 断裂
断裂b.气体密度不变
c.平衡常数不变
d.容器内
 保持不变
保持不变
您最近一年使用:0次
7 . 金属锂 的化学性质与镁相似,在加热的条件下锂能与氮气反应生成氮化锂
的化学性质与镁相似,在加热的条件下锂能与氮气反应生成氮化锂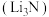 。某课题组设计了下图实验装置制备氮化锂(部分夹持装置省略)。
。某课题组设计了下图实验装置制备氮化锂(部分夹持装置省略)。
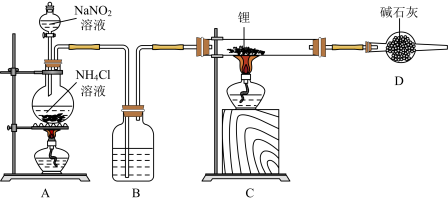
已知:①实验室用 溶液和
溶液和 溶液共热制备
溶液共热制备 。②
。②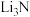 遇水剧烈反应。
遇水剧烈反应。
回答下列问题:
(1)实验室将锂保存在_______ (填“煤油”“石蜡”或“水”)中;装置B中盛装的试剂是_______ ;装置D的作用是_______ 。
(2)本实验的步骤有:①装药品;②点燃A处酒精灯;③检查装置气密性;④点燃C处酒精灯。则正确的操作先后顺序为_______ (填序号)。
(3)氮化锂是一种非常有前途的储氢材料,其储氢原理可表示为: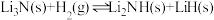 ;
;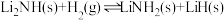 。
。
①下列有关储氢原理的说法正确的是_______ (填标号)。
A.此法储氢和钢瓶储氢的原理相同
B.储氢过程中两反应的平衡常数相同
C.若两反应中生成等量的 ,则转移电子数之比为
,则转移电子数之比为
D.反应中涉及的3种单核离子的半径大小顺序为
② (2氨基锂)是
(2氨基锂)是_______ (填“氧化产物”或“还原产物”)。
③氮化锂储存氢气最多可达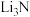 质量的
质量的_______  (精确到0.1)。
(精确到0.1)。
 的化学性质与镁相似,在加热的条件下锂能与氮气反应生成氮化锂
的化学性质与镁相似,在加热的条件下锂能与氮气反应生成氮化锂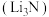 。某课题组设计了下图实验装置制备氮化锂(部分夹持装置省略)。
。某课题组设计了下图实验装置制备氮化锂(部分夹持装置省略)。
已知:①实验室用
 溶液和
溶液和 溶液共热制备
溶液共热制备 。②
。②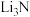 遇水剧烈反应。
遇水剧烈反应。回答下列问题:
(1)实验室将锂保存在
(2)本实验的步骤有:①装药品;②点燃A处酒精灯;③检查装置气密性;④点燃C处酒精灯。则正确的操作先后顺序为
(3)氮化锂是一种非常有前途的储氢材料,其储氢原理可表示为:
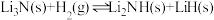 ;
;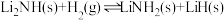 。
。①下列有关储氢原理的说法正确的是
A.此法储氢和钢瓶储氢的原理相同
B.储氢过程中两反应的平衡常数相同
C.若两反应中生成等量的
 ,则转移电子数之比为
,则转移电子数之比为
D.反应中涉及的3种单核离子的半径大小顺序为

②
 (2氨基锂)是
(2氨基锂)是③氮化锂储存氢气最多可达
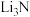 质量的
质量的 (精确到0.1)。
(精确到0.1)。
您最近一年使用:0次
8 . 用如图装置探究NH3和CuSO4溶液的反应。
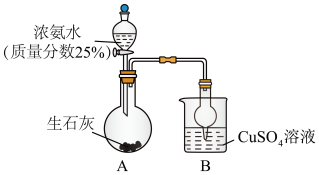
(1)上述制备NH3的实验中,烧瓶中反应涉及到多个平衡的移动:NH3+H2O NH3•H2O、
NH3•H2O、______ 、______ (列举其中的两个平衡,可写化学用语也可文字表述)。
(2)上述实验B装置可以改成什么装置,达到同样的目的。画出简图,标出所盛试剂______ 。
(3)NH3通入CuSO4溶液中,产生蓝色沉淀,写出该反应的离子方程式:______ 。
继续通氨气至过量,沉淀消失得到深蓝色[Cu(NH3)4]2+溶液。发生如下反应: (铜氨溶液)+2H2O+Q(Q>0)。
(铜氨溶液)+2H2O+Q(Q>0)。
(4)该反应平衡常数的表达式:K=______ 。
(5)t1时改变条件,一段时间后达到新平衡,此时反应K增大。在图中画出该过程中v正的变化______ 。

(6)向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:______ 。
(7)在绝热密闭容器中,加入NH (aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如图所示,v正先增大后减小的原因
(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如图所示,v正先增大后减小的原因______ 。


(1)上述制备NH3的实验中,烧瓶中反应涉及到多个平衡的移动:NH3+H2O
 NH3•H2O、
NH3•H2O、(2)上述实验B装置可以改成什么装置,达到同样的目的。画出简图,标出所盛试剂
(3)NH3通入CuSO4溶液中,产生蓝色沉淀,写出该反应的离子方程式:
继续通氨气至过量,沉淀消失得到深蓝色[Cu(NH3)4]2+溶液。发生如下反应:
 (铜氨溶液)+2H2O+Q(Q>0)。
(铜氨溶液)+2H2O+Q(Q>0)。(4)该反应平衡常数的表达式:K=
(5)t1时改变条件,一段时间后达到新平衡,此时反应K增大。在图中画出该过程中v正的变化

(6)向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:
(7)在绝热密闭容器中,加入NH
 (aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如图所示,v正先增大后减小的原因
(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如图所示,v正先增大后减小的原因
您最近一年使用:0次
名校
解题方法
9 . 近年碳中和理念成为热门,通过“ →合成气→高附加值产品”的工艺路线,可有效实现
→合成气→高附加值产品”的工艺路线,可有效实现 的资源化利用。请回答下列问题:
的资源化利用。请回答下列问题:
(1) 加氢制合成气(CO、
加氢制合成气(CO、 )时发生下列反应:
)时发生下列反应:
已知:①

②
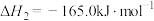
则

_______ 
(2) 经催化加氢可合成烯烃:
经催化加氢可合成烯烃:
 。在0.1MPa时,按
。在0.1MPa时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是_______ (填字母)。
A.容器内各物质的浓度不随时间变化 B.
C.容器内压强不随时间变化 D.混合气体的密度不再改变
②该反应的
_______ 0(填“>”或“<”)。
③曲线c表示的物质为_______ (用化学式表示)。
④要提高 的转化率并同时提高反应速率,可以采取什么措施
的转化率并同时提高反应速率,可以采取什么措施_______ (写出2种)。
(3)由 与
与 反应合成甲醇:
反应合成甲醇:
 。某温度下将1mol
。某温度下将1mol 和3mol
和3mol 充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数
_______  平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为_______ 。当阴极只生成HCOOH时,每转移2mol电子,阴极室溶液质量增加_______ g。

 →合成气→高附加值产品”的工艺路线,可有效实现
→合成气→高附加值产品”的工艺路线,可有效实现 的资源化利用。请回答下列问题:
的资源化利用。请回答下列问题:(1)
 加氢制合成气(CO、
加氢制合成气(CO、 )时发生下列反应:
)时发生下列反应:已知:①


②

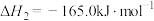
则



(2)
 经催化加氢可合成烯烃:
经催化加氢可合成烯烃:
 。在0.1MPa时,按
。在0.1MPa时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.

C.容器内压强不随时间变化 D.混合气体的密度不再改变
②该反应的

③曲线c表示的物质为
④要提高
 的转化率并同时提高反应速率,可以采取什么措施
的转化率并同时提高反应速率,可以采取什么措施(3)由
 与
与 反应合成甲醇:
反应合成甲醇:
 。某温度下将1mol
。某温度下将1mol 和3mol
和3mol 充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
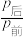 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |

 平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)电催化
 制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
您最近一年使用:0次
名校
10 . 2021年碳中和理念成为热门,CCUS(CarbonCapture,UtilizaionandStorage)碳捕获、利用与封存技术能实现二氧化碳资源化,产生经济效益。
Ⅰ.回答下列问题
(1)捕获的高浓度 能与
能与 制备合成气(CO、
制备合成气(CO、 ),科学家提出制备“合成气”反应历程分两步进行,能量变化如图所示:
),科学家提出制备“合成气”反应历程分两步进行,能量变化如图所示:

反应①:
反应②:
结合图象写出 与
与 制备“合成气”的热化学方程式:
制备“合成气”的热化学方程式:_______ 。决定该反应快慢的是分步反应中的反应_______ (填序号)
(2)“合成气”在催化剂作用下发生反应制备甲醇: ,某温度下在一恒压容器中分别充入1.2molCO和1mol
,某温度下在一恒压容器中分别充入1.2molCO和1mol ,达到平衡时容器体积为2L,且含有0.4mol
,达到平衡时容器体积为2L,且含有0.4mol ,反应的平衡常数
,反应的平衡常数
_______ ,此时向容器中再通入0.35molCO气体,则此平衡将_______ (填“正向”“不”或“逆向”)移动。
Ⅱ.二氧化碳可合成低碳烯烃
(3)
 ,在恒容密闭容器中,反应温度、投料比[
,在恒容密闭容器中,反应温度、投料比[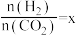 ]对
]对 平衡转化率的影响如图所示。a
平衡转化率的影响如图所示。a_______ 3(填“>”“<”或“=”);M、N两点的反应速率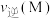
_______ 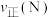 (填“>”“<”或“=”);M、N两点的反应平衡常数
(填“>”“<”或“=”);M、N两点的反应平衡常数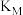
_______  (填“>”“<”或“=”)
(填“>”“<”或“=”)

(4)用如图装置模拟科学研究在碱性环境中电催化还原 制乙烯(X、Y均为新型电极材料,可减少
制乙烯(X、Y均为新型电极材料,可减少 和碱发生副反应),X极上的电极反应式为
和碱发生副反应),X极上的电极反应式为_______ 。

Ⅰ.回答下列问题
(1)捕获的高浓度
 能与
能与 制备合成气(CO、
制备合成气(CO、 ),科学家提出制备“合成气”反应历程分两步进行,能量变化如图所示:
),科学家提出制备“合成气”反应历程分两步进行,能量变化如图所示:
反应①:

反应②:

结合图象写出
 与
与 制备“合成气”的热化学方程式:
制备“合成气”的热化学方程式:(2)“合成气”在催化剂作用下发生反应制备甲醇:
 ,某温度下在一恒压容器中分别充入1.2molCO和1mol
,某温度下在一恒压容器中分别充入1.2molCO和1mol ,达到平衡时容器体积为2L,且含有0.4mol
,达到平衡时容器体积为2L,且含有0.4mol ,反应的平衡常数
,反应的平衡常数
Ⅱ.二氧化碳可合成低碳烯烃
(3)

 ,在恒容密闭容器中,反应温度、投料比[
,在恒容密闭容器中,反应温度、投料比[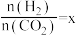 ]对
]对 平衡转化率的影响如图所示。a
平衡转化率的影响如图所示。a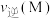
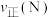 (填“>”“<”或“=”);M、N两点的反应平衡常数
(填“>”“<”或“=”);M、N两点的反应平衡常数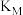
 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)用如图装置模拟科学研究在碱性环境中电催化还原
 制乙烯(X、Y均为新型电极材料,可减少
制乙烯(X、Y均为新型电极材料,可减少 和碱发生副反应),X极上的电极反应式为
和碱发生副反应),X极上的电极反应式为
您最近一年使用:0次
2022-05-27更新
|
247次组卷
|
3卷引用:湖北省鄂东南三校2022届高三下学期5月联考化学试题







