2024高三·全国·专题练习
1 . 研发CO2、NO利用技术,降低空气中CO2、NO含量成为研究热点。
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)ΔH1=-156.9 kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1 kJ·mol-1
已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-395.6 kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=___________ 。
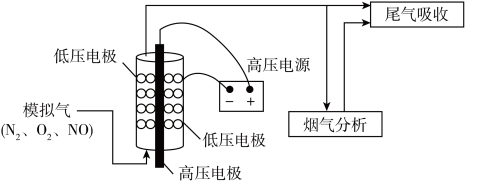
(2)利用电化学方法通过微生物电催化可将CO2有效地转化为H2C2O4,装置如图所示,阴极的电极反应式为___________ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因___________ 。___________ 。___________ 。
② 其他条件相同,等离子体的电功率与NO转化率的关系如图所示,当电功率大于30 W时,NO转化率下降的原因可能是___________ 。
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)ΔH1=-156.9 kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1 kJ·mol-1
已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-395.6 kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=
(2)利用电化学方法通过微生物电催化可将CO2有效地转化为H2C2O4,装置如图所示,阴极的电极反应式为

② 其他条件相同,等离子体的电功率与NO转化率的关系如图所示,当电功率大于30 W时,NO转化率下降的原因可能是

您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 工业以软锰矿(主要成分是 ,含有
,含有 、
、 等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(
等少量杂质)为主要原料制备高性能的磁性材料碳酸锰( )。其工业流程如下:
)。其工业流程如下: 生成,温度对“浸锰”反应的影响如图所示:
生成,温度对“浸锰”反应的影响如图所示: 的生成,“浸锰”的适宜温度是
的生成,“浸锰”的适宜温度是___________ 。
 ,含有
,含有 、
、 等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(
等少量杂质)为主要原料制备高性能的磁性材料碳酸锰( )。其工业流程如下:
)。其工业流程如下: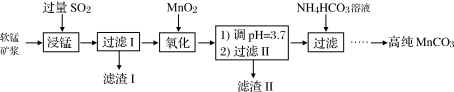
 生成,温度对“浸锰”反应的影响如图所示:
生成,温度对“浸锰”反应的影响如图所示: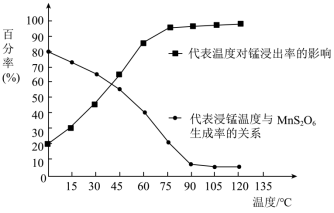
 的生成,“浸锰”的适宜温度是
的生成,“浸锰”的适宜温度是
您最近一年使用:0次
名校
解题方法
3 . 合成氨工艺是人工化肥的生产支柱,是人类生存发展的“食”之基础。
回答下列问题:
Ⅰ.化学键键能如表
(1)估算 的△H=
的△H=_______  。已知该反应的△S=-198.9J/(mol·K),理论上该反应在温度为298K下
。已知该反应的△S=-198.9J/(mol·K),理论上该反应在温度为298K下_______ (填“能”或“不能”)自发进行。
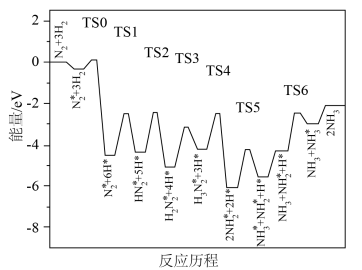
Ⅱ.科学家结合实验与计算机模拟结果,研究了合成氨的反应历程,如图所示,其中吸附在催化剂表面的物种用*表示,TS表示过渡态。_______ 个基元反应。发生N—N键断裂的反应方程式为______________ 。
(3)H—H键断裂应该吸收热量,但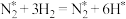 反应的
反应的 ,主要原因为
,主要原因为______________ 。
(4)在实际工业生产中,合成氨一般采用的温度为400~500℃,主要原因为______________ 。
(5)温度为500℃、压强为20MPa,原料气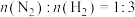 ,反应
,反应 ,反应平衡时,氨气的体积分数为20%,则氮气的转化率约为
,反应平衡时,氨气的体积分数为20%,则氮气的转化率约为_______ %(计算结果保留三位有效数字)。该条件下,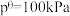 ,
, 的标准平衡常数
的标准平衡常数 为
为_______ (用最简分数形式表示)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),
gG(g)+hH(g),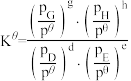 ,其中
,其中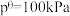 ,pG、pH、pD、pE为各组分的平衡分压]。
,pG、pH、pD、pE为各组分的平衡分压]。
回答下列问题:
Ⅰ.化学键键能如表
| 化学键 | N≡N | H—H | N—H |
键能( ) ) | 946 | 436 | 390.8 |
(1)估算
 的△H=
的△H= 。已知该反应的△S=-198.9J/(mol·K),理论上该反应在温度为298K下
。已知该反应的△S=-198.9J/(mol·K),理论上该反应在温度为298K下Ⅱ.科学家结合实验与计算机模拟结果,研究了合成氨的反应历程,如图所示,其中吸附在催化剂表面的物种用*表示,TS表示过渡态。
(3)H—H键断裂应该吸收热量,但
 反应的
反应的 ,主要原因为
,主要原因为(4)在实际工业生产中,合成氨一般采用的温度为400~500℃,主要原因为
(5)温度为500℃、压强为20MPa,原料气
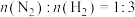 ,反应
,反应 ,反应平衡时,氨气的体积分数为20%,则氮气的转化率约为
,反应平衡时,氨气的体积分数为20%,则氮气的转化率约为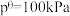 ,
, 的标准平衡常数
的标准平衡常数 为
为 gG(g)+hH(g),
gG(g)+hH(g),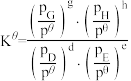 ,其中
,其中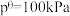 ,pG、pH、pD、pE为各组分的平衡分压]。
,pG、pH、pD、pE为各组分的平衡分压]。
您最近一年使用:0次
4 . 对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。反应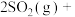
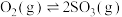
 在催化剂作用下原料的总转化率与最适宜温度(曲线Ⅰ)、原料的总平衡转化率与温度(曲线Ⅱ)的关系曲线示意图最合理的是
在催化剂作用下原料的总转化率与最适宜温度(曲线Ⅰ)、原料的总平衡转化率与温度(曲线Ⅱ)的关系曲线示意图最合理的是
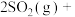
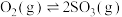
 在催化剂作用下原料的总转化率与最适宜温度(曲线Ⅰ)、原料的总平衡转化率与温度(曲线Ⅱ)的关系曲线示意图最合理的是
在催化剂作用下原料的总转化率与最适宜温度(曲线Ⅰ)、原料的总平衡转化率与温度(曲线Ⅱ)的关系曲线示意图最合理的是A.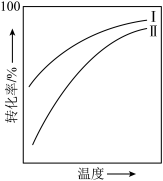 | B.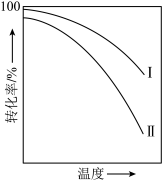 |
C. | D.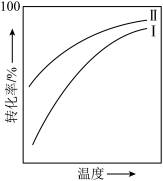 |
您最近一年使用:0次
名校
解题方法
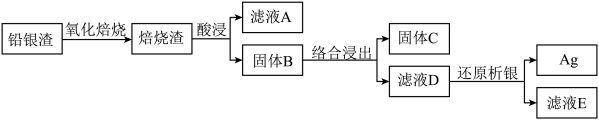
5 . 从铅银渣(含Pb、Ag、Cu等金属元素)中提取银的流程如下: 形成[Ag(SO3)2]3−。
形成[Ag(SO3)2]3−。
(1)“酸浸”时,使用H2SO4、NaCl和NaNO3的混合液作为浸出剂。
①加入NaNO3的作用___________ 。
②固体B含有___________ 。
(2)用氨水和水合肼(N2H4·H2O)进行“络合浸出”和“还原析银”。
①氨水“络合浸出”的化学方程式是___________ 。
②将水合肼“还原析银”反应的离子方程式补充完整:___________ 。
□ ___________+ N2H4·H2O =N2↑ + H2O + □ ___________ + □ ___________ + □ NH3↑
(3)用Na2SO3和甲醛进行“络合浸出”和“还原析银”。
①亚硫酸钠“络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示,解释银浸出率随溶液pH增大先升高后降低的原因___________ ;分析浸出时间超过4 h,银浸出率降低的原因___________ 。___________ 。
 形成[Ag(SO3)2]3−。
形成[Ag(SO3)2]3−。(1)“酸浸”时,使用H2SO4、NaCl和NaNO3的混合液作为浸出剂。
①加入NaNO3的作用
②固体B含有
(2)用氨水和水合肼(N2H4·H2O)进行“络合浸出”和“还原析银”。
①氨水“络合浸出”的化学方程式是
②将水合肼“还原析银”反应的离子方程式补充完整:
□ ___________+ N2H4·H2O =N2↑ + H2O + □ ___________ + □ ___________ + □ NH3↑
(3)用Na2SO3和甲醛进行“络合浸出”和“还原析银”。
①亚硫酸钠“络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示,解释银浸出率随溶液pH增大先升高后降低的原因

您最近一年使用:0次
2024-04-01更新
|
508次组卷
|
5卷引用:北京市石景山区2024届高三期中考试(一模)化学试卷
北京市石景山区2024届高三期中考试(一模)化学试卷(已下线)提升练07 工艺流程综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)北京市西城区2024届高三下学期第三次模拟测试化学试题北京市第一六六中学2023-2024学年高三下学期高考模拟测试(三模)化学试题
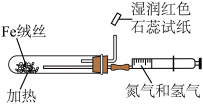
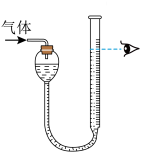
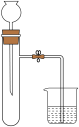
6 . 化学是一门以实验为基础的学科。下列实验能达到实验目的的是
| 选项 | A | B |
| 实验 |
|
|
| 实验目的 | 模拟工业制备 并检验 并检验 | 该装置可实现随关随停的操作 |
| 选项 | C | D |
| 实验 |
|
|
| 实验目的 | 用量气管准确测量气体体积 | 用手捂热试管检查该装置的气密性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
23-24高二·全国·假期作业
7 . 合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
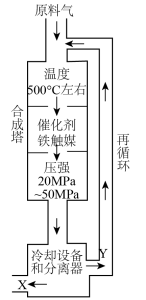
(1)图中条件选定的主要原因是_______ (填字母编号)。
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的
_______ (用p表示,气体分压=总压×物质的量分数)。
(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
而实际流程从合成塔出来的混合气体中含有氨约为15%,这表明_______ 。
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是_______ 。

(1)图中条件选定的主要原因是
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的

(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
| 压强 | 20MPa | 60MPa |
| 500℃ | 19.1 | 42.2 |
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是
您最近一年使用:0次
名校
解题方法
8 .  可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。
请回答下列问题:
(1)灼烧。灼烧 制
制 时,可使用的实验装置有
时,可使用的实验装置有___________ (填字母)。 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。
①写出制备 时发生反应的化学方程式:
时发生反应的化学方程式:___________ 。
②“转化”阶段有大量热量放出,为了提高 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为___________ 。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。 溶液的作用是
溶液的作用是___________ (用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是___________ 、___________ 。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为___________  (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。请回答下列问题:
(1)灼烧。灼烧
 制
制 时,可使用的实验装置有
时,可使用的实验装置有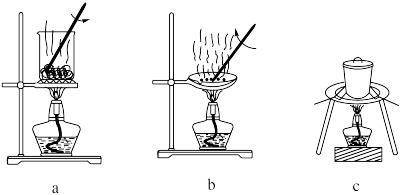
 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。①写出制备
 时发生反应的化学方程式:
时发生反应的化学方程式:②“转化”阶段有大量热量放出,为了提高
 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为(3)测定。某研究小组拟用下图装置测定样品(含
 杂质)中
杂质)中 的含量。
的含量。
 溶液的作用是
溶液的作用是②为了减小实验误差,在每次读数前需要进行的操作是
③该小组记录的实验数据如下:样品的质量为
 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为 (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数
您最近一年使用:0次
2023-10-06更新
|
806次组卷
|
6卷引用:皖豫名校联盟2024届高三上学期第一次考试化学试题
名校
解题方法
9 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为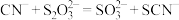 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
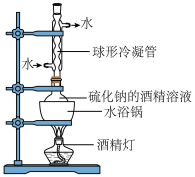
将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是___________ 。
(3)利用下图装置制备 。
。
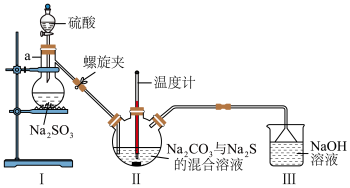
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置Ⅲ的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
(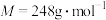 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为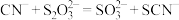 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是
(3)利用下图装置制备
 。
。
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置Ⅲ的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
(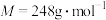 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
10 . 以铁触媒为催化剂。在400~500℃和10~30MPa的条件下进行合成氨反应: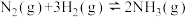
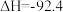 kJ⋅mol-1。下列说法正确的是
kJ⋅mol-1。下列说法正确的是
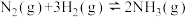
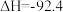 kJ⋅mol-1。下列说法正确的是
kJ⋅mol-1。下列说法正确的是| A.400~500℃温度范围内,铁触媒活性较高 |
| B.该反应在任意条件下均能自发进行 |
C. kJ·mol-1(E表示键能) kJ·mol-1(E表示键能) |
| D.其他条件一定,增大压强能增大反应的平衡常数 |
您最近一年使用:0次