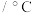1 . 我国科学家研发出一种新型双温催化剂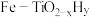 ,该催化剂催化
,该催化剂催化 和
和 合成
合成 (反应体系温度为495℃)的原理如图所示,下列分析错误的是
(反应体系温度为495℃)的原理如图所示,下列分析错误的是
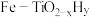 ,该催化剂催化
,该催化剂催化 和
和 合成
合成 (反应体系温度为495℃)的原理如图所示,下列分析错误的是
(反应体系温度为495℃)的原理如图所示,下列分析错误的是
A.“热 ”上的变化属于焓增、熵增的变化 ”上的变化属于焓增、熵增的变化 |
B.“热 ”有利于 ”有利于 快速转化为N 快速转化为N |
C.“冷 ”低于体系温度,有利于提高合成氨反应速率 ”低于体系温度,有利于提高合成氨反应速率 |
| D.该催化剂能较好地解决传统合成氨工艺中存在的反应速率和平衡产率的矛盾 |
您最近一年使用:0次
2 . 硫酸工业中,在接触室中催化氧化 的反应为
的反应为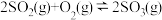 。
。
(1)上述反应在 的催化作用下分两步进行,能量变化如图:
的催化作用下分两步进行,能量变化如图:_______________ ;通入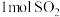 、
、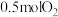 充分反应,放出热量
充分反应,放出热量__________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)为了使 尽可能多地转化为
尽可能多地转化为 ,理论上应选择的条件是
,理论上应选择的条件是___________ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
但实际生产中选择常压,其原因是__________________ 。
(3)接触室中,原料气[投料比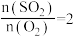 ]依次通过催化剂层、热交换器,
]依次通过催化剂层、热交换器, 转化率随温度变化如图所示:
转化率随温度变化如图所示:__________________ 。
②平衡时的压强为p, 的转化率为
的转化率为 ,则
,则
__________ (用 、p表示)。
、p表示)。
(4)催化分解 可获取硫酸工业的重要原料。负载有
可获取硫酸工业的重要原料。负载有 、
、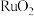 的
的 催化剂在光照时可产生电子和具有强氧化性的电子空穴
催化剂在光照时可产生电子和具有强氧化性的电子空穴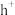 ,催化过程的示意图如图:
,催化过程的示意图如图: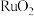 表面发生的反应式为
表面发生的反应式为__________________ ;若产生 电子空穴
电子空穴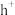 ,则产生标准状况下
,则产生标准状况下__________ 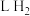 。
。
 的反应为
的反应为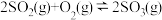 。
。(1)上述反应在
 的催化作用下分两步进行,能量变化如图:
的催化作用下分两步进行,能量变化如图: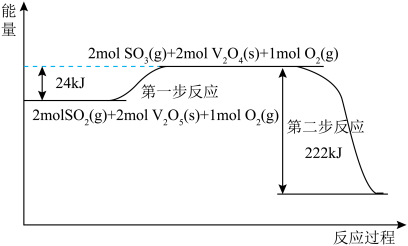
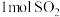 、
、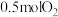 充分反应,放出热量
充分反应,放出热量 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)为了使
 尽可能多地转化为
尽可能多地转化为 ,理论上应选择的条件是
,理论上应选择的条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
但实际生产中选择常压,其原因是
(3)接触室中,原料气[投料比
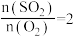 ]依次通过催化剂层、热交换器,
]依次通过催化剂层、热交换器, 转化率随温度变化如图所示:
转化率随温度变化如图所示:
②平衡时的压强为p,
 的转化率为
的转化率为 ,则
,则
 、p表示)。
、p表示)。(4)催化分解
 可获取硫酸工业的重要原料。负载有
可获取硫酸工业的重要原料。负载有 、
、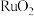 的
的 催化剂在光照时可产生电子和具有强氧化性的电子空穴
催化剂在光照时可产生电子和具有强氧化性的电子空穴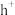 ,催化过程的示意图如图:
,催化过程的示意图如图:
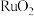 表面发生的反应式为
表面发生的反应式为 电子空穴
电子空穴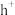 ,则产生标准状况下
,则产生标准状况下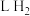 。
。
您最近一年使用:0次
解题方法
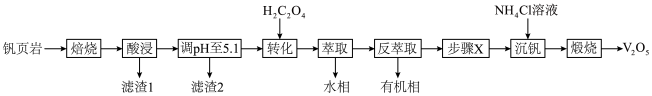
3 . V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为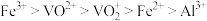 ;
;
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到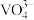 ,
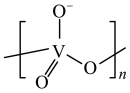
,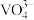 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为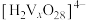 ,其中
,其中
________ 。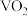 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为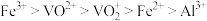 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是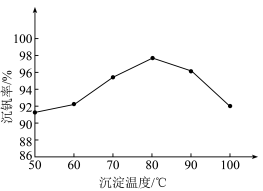
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到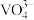 ,
,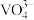 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为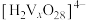 ,其中
,其中
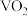 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是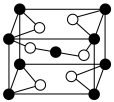
您最近一年使用:0次
4 . 环戊二烯是一种重要的有机合成原料,用其制备环戊烯涉及的反应如下:
(1)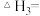
______ (用含“ ”和“
”和“ ”的式子表示),该反应在
”的式子表示),该反应在______ (填“高温”或“低温”)条件下能自发进行。
(2)下列操作中,能提高环戊二烯平衡转化率的是______ (填标号)。
A.增加环戊二烯的用量 B.恒温恒压下通入惰性气体 C.移除环戊烯
(3)保持其他条件不变,在相同时间内,环戊二烯转化率及环戊烯、环戊烷的选择性与温度的关系如下图所示:______ (填标号)。
A.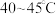 B.
B.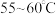 C.
C.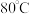 左右
左右
②随着温度的升高,环戊二烯转化率升高而环戊烯选择性降低,其原因是______ 。
(4)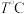 ,向恒容密闭容器中加入
,向恒容密闭容器中加入 环戊二烯
环戊二烯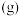 和
和
 ,反应达到平衡时,环戊二烯的转化率为
,反应达到平衡时,环戊二烯的转化率为 ,环戊烷物质的量为
,环戊烷物质的量为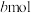 ,则用气体物质的量分数
,则用气体物质的量分数 表示的主反应的平衡常数
表示的主反应的平衡常数
______ (用含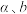 的计算式表示)。
的计算式表示)。
(5)用环戊二烯制备的二茂铁 可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为
可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则一个晶胞中含
,则一个晶胞中含 的数目为
的数目为______ 。
主反应: ;
;
副反应1: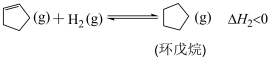 。
。
副反应2:
(1)
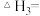
 ”和“
”和“ ”的式子表示),该反应在
”的式子表示),该反应在(2)下列操作中,能提高环戊二烯平衡转化率的是
A.增加环戊二烯的用量 B.恒温恒压下通入惰性气体 C.移除环戊烯
(3)保持其他条件不变,在相同时间内,环戊二烯转化率及环戊烯、环戊烷的选择性与温度的关系如下图所示:
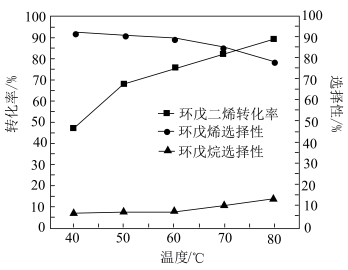
A.
 B.
B.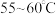 C.
C.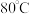 左右
左右②随着温度的升高,环戊二烯转化率升高而环戊烯选择性降低,其原因是
(4)
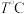 ,向恒容密闭容器中加入
,向恒容密闭容器中加入 环戊二烯
环戊二烯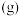 和
和
 ,反应达到平衡时,环戊二烯的转化率为
,反应达到平衡时,环戊二烯的转化率为 ,环戊烷物质的量为
,环戊烷物质的量为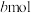 ,则用气体物质的量分数
,则用气体物质的量分数 表示的主反应的平衡常数
表示的主反应的平衡常数
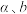 的计算式表示)。
的计算式表示)。(5)用环戊二烯制备的二茂铁
 可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为
可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则一个晶胞中含
,则一个晶胞中含 的数目为
的数目为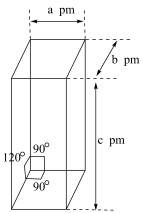
您最近一年使用:0次
5 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在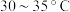 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸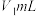 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择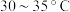 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
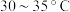 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸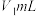 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
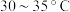 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
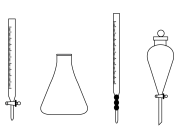
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
解题方法
6 . 选择性催化还原(SCR)脱硝技术可用于减少工业生产中氮氧化物( )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:
Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
(1)反应

___________ ,副反应化学方程式为___________ 。
(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图:___________ ,应选择的最佳催化剂为___________ ,选用合适的催化剂还能抑制催化剂表面出现铵盐结晶现象,结晶会导致___________ 。
Ⅱ.H2―SCR技术
主反应: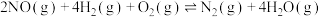
副反应:
(3)恒温下,向容积为1L的容器中充入2mol NO、4mol 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的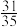 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为___________ ,主反应的
___________ (列出计算式即可)。
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:___________ ,随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是___________ 。
 )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
| 反应方程式 | 反应热 | |
| 吸附过程 | 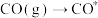 |  |
 |  | |
| 解离过程 |  |  |
| 缔结过程 | 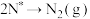 |  |
 |  | |
 | 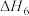 |
(1)反应


(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图: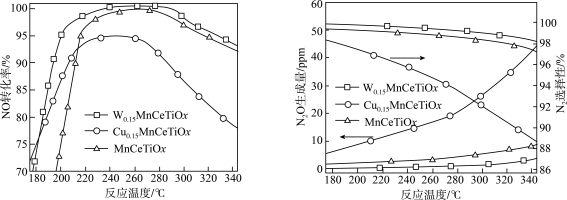
Ⅱ.H2―SCR技术
主反应:
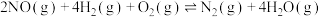
副反应:

(3)恒温下,向容积为1L的容器中充入2mol NO、4mol
 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的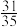 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的
 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
您最近一年使用:0次
名校
7 . 我国力争在2060年前实现碳中和。研究二氧化碳的回收对这一宏伟目标的实现具有现实意义。
Ⅰ.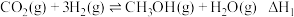
Ⅱ.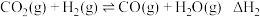
回答下列问题:
(1)298K时,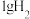 燃烧生成
燃烧生成 放热121kJ,
放热121kJ,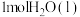 蒸发吸热44kJ表示
蒸发吸热44kJ表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ ;
(2)同一容器中,反应Ⅰ、Ⅱ的lnK(K为化学平衡常数)随 的变化如图,下列说法正确的是_______;
的变化如图,下列说法正确的是_______;
(3)在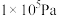 ,将
,将 和
和 按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。 的选择性
的选择性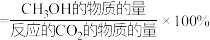
①在上述条件下合成甲醇的工业条件是_______ ;
A.210℃ B.230℃ C.催化CZT D.催化剂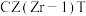
②在230℃以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是_______ ;
③若为恒温体系,达平衡时,二氧化碳、甲醇、一氧化碳的体积分数相同,反应Ⅱ的平衡常数
_______ ;
(4)2020年,我国学者利用电化学装置常温下将 高效转化为
高效转化为 ,其中隔膜为阴离子交换膜,其原理如图所示:
,其中隔膜为阴离子交换膜,其原理如图所示:_______ 。
②当有 参与反应时,阴极溶液质量的变化为
参与反应时,阴极溶液质量的变化为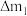 ,阳极溶液质量的变化为
,阳极溶液质量的变化为 ,则溶液质量变化绝对值之差
,则溶液质量变化绝对值之差
_______ g。
Ⅰ.
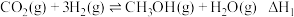
Ⅱ.
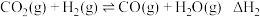
回答下列问题:
(1)298K时,
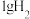 燃烧生成
燃烧生成 放热121kJ,
放热121kJ,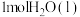 蒸发吸热44kJ表示
蒸发吸热44kJ表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)同一容器中,反应Ⅰ、Ⅱ的lnK(K为化学平衡常数)随
 的变化如图,下列说法正确的是_______;
的变化如图,下列说法正确的是_______;
A.反应Ⅲ 的活化能 的活化能 |
| B.当容器内的压强不再变化时说明两个反应均达到平衡 |
| C.当反应体系内气体的平均相对分子质量不变化时说明两个反应均达到平衡 |
| D.恒温恒容下充入氦气,反应Ⅰ的平衡向正反应方向移动 |
(3)在
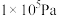 ,将
,将 和
和 按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。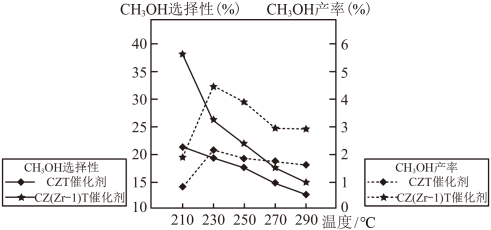
 的选择性
的选择性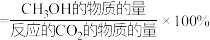
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化CZT D.催化剂
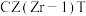
②在230℃以上,升高温度
 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是③若为恒温体系,达平衡时,二氧化碳、甲醇、一氧化碳的体积分数相同,反应Ⅱ的平衡常数

(4)2020年,我国学者利用电化学装置常温下将
 高效转化为
高效转化为 ,其中隔膜为阴离子交换膜,其原理如图所示:
,其中隔膜为阴离子交换膜,其原理如图所示: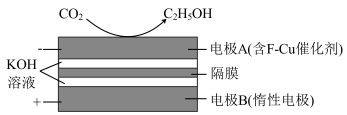
②当有
 参与反应时,阴极溶液质量的变化为
参与反应时,阴极溶液质量的变化为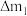 ,阳极溶液质量的变化为
,阳极溶液质量的变化为 ,则溶液质量变化绝对值之差
,则溶液质量变化绝对值之差
您最近一年使用:0次
解题方法
8 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1) 转化为
转化为 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
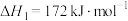 ,
,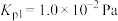
(ⅱ)碳氯化:
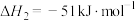 ,
,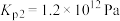
①反应 的
的 为
为________  。
。
②运用以上数据分析,你认为以上两种方法更优越的是__________ ,理由_________________ 。
(2)在压强为170kPa恒压作用下,将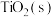 、
、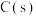 、
、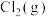 以物质的量之比为
以物质的量之比为 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数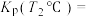
________  (分压
(分压 物质的量分数
物质的量分数 总压)。
总压)。
②图中显示,在T1℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
(1)
 转化为
转化为 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
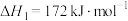 ,
,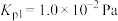
(ⅱ)碳氯化:

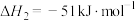 ,
,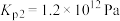
①反应
 的
的 为
为 。
。②运用以上数据分析,你认为以上两种方法更优越的是
(2)在压强为170kPa恒压作用下,将
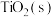 、
、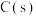 、
、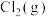 以物质的量之比为
以物质的量之比为 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。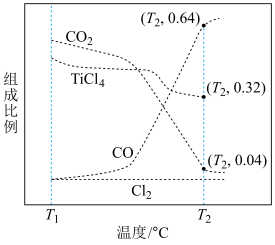
 的平衡常数
的平衡常数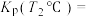
 (分压
(分压 物质的量分数
物质的量分数 总压)。
总压)。②图中显示,在T1℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
9 . 工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是___________ ,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是___________ 。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是___________。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因___________ 。
(1)N2分子通常条件下非常稳定,其本质原因是
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
A. | B. | C.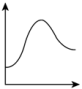 | D.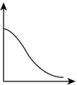 |
您最近一年使用:0次
解题方法
10 . 乙醇水蒸气重整制 的热化学方程式为
的热化学方程式为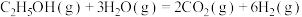
 ,其化学过程可以表述为一系列基元反应,结合反应间联系进一步整理可以得到如下的四个主反应:
,其化学过程可以表述为一系列基元反应,结合反应间联系进一步整理可以得到如下的四个主反应:
反应 :
: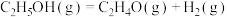
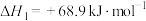
反应 :
: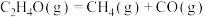
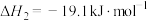
反应 :
: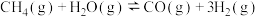
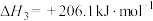
反应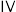 :
: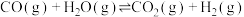
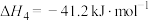
(1)根据题干,
___________  ,平衡时CO的选择性随温度的变化应是图中曲线
,平衡时CO的选择性随温度的变化应是图中曲线___________ (填图中曲线编号)[已知:CO的选择性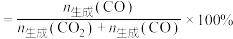 ],理由是
],理由是___________ 。___________ ,原因是___________ 。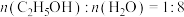 投料,初始压强为p kPa,充分反应后,将混合气体干燥处理,测得
投料,初始压强为p kPa,充分反应后,将混合气体干燥处理,测得 占混合气体(干燥后)总体积的50%,
占混合气体(干燥后)总体积的50%, 占10%,则反应Ⅲ的平衡常数
占10%,则反应Ⅲ的平衡常数
___________ [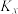 为用摩尔分数表示的平衡常数,
为用摩尔分数表示的平衡常数,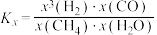 ,x表示该物质占气体的物质的量分数],到达平衡时体系中CO的分压为
,x表示该物质占气体的物质的量分数],到达平衡时体系中CO的分压为___________ kPa, 的产率
的产率___________ (保留2位有效数字)。
 的热化学方程式为
的热化学方程式为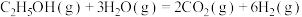
 ,其化学过程可以表述为一系列基元反应,结合反应间联系进一步整理可以得到如下的四个主反应:
,其化学过程可以表述为一系列基元反应,结合反应间联系进一步整理可以得到如下的四个主反应:反应
 :
: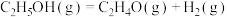
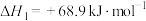
反应
 :
: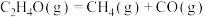
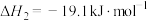
反应
 :
: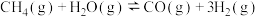
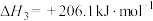
反应
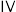 :
: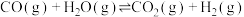
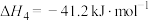
(1)根据题干,

 ,平衡时CO的选择性随温度的变化应是图中曲线
,平衡时CO的选择性随温度的变化应是图中曲线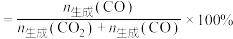 ],理由是
],理由是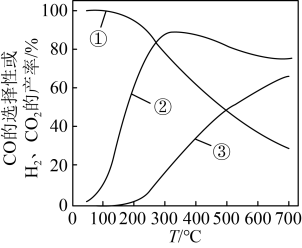
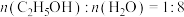 投料,初始压强为p kPa,充分反应后,将混合气体干燥处理,测得
投料,初始压强为p kPa,充分反应后,将混合气体干燥处理,测得 占混合气体(干燥后)总体积的50%,
占混合气体(干燥后)总体积的50%, 占10%,则反应Ⅲ的平衡常数
占10%,则反应Ⅲ的平衡常数
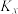 为用摩尔分数表示的平衡常数,
为用摩尔分数表示的平衡常数,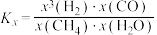 ,x表示该物质占气体的物质的量分数],到达平衡时体系中CO的分压为
,x表示该物质占气体的物质的量分数],到达平衡时体系中CO的分压为 的产率
的产率
您最近一年使用:0次