解题方法
1 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1) 转化为
转化为 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
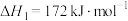 ,
,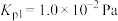
(ⅱ)碳氯化:
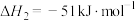 ,
,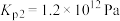
①反应 的
的 为
为________  。
。
②运用以上数据分析,你认为以上两种方法更优越的是__________ ,理由_________________ 。
(2)在压强为170kPa恒压作用下,将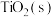 、
、 、
、 以物质的量之比为
以物质的量之比为 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数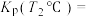
________  (分压
(分压 物质的量分数
物质的量分数 总压)。
总压)。
②图中显示,在T1℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
(1)
 转化为
转化为 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
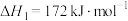 ,
,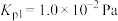
(ⅱ)碳氯化:

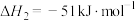 ,
,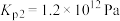
①反应
 的
的 为
为 。
。②运用以上数据分析,你认为以上两种方法更优越的是
(2)在压强为170kPa恒压作用下,将
 、
、 、
、 以物质的量之比为
以物质的量之比为 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。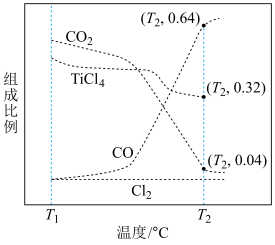
 的平衡常数
的平衡常数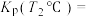
 (分压
(分压 物质的量分数
物质的量分数 总压)。
总压)。②图中显示,在T1℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
2 . 工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是___________ ,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是___________ 。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是___________。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因___________ 。
(1)N2分子通常条件下非常稳定,其本质原因是
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
A. | B. | C.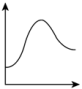 | D.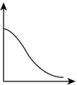 |
您最近一年使用:0次
3 . 如图所示的是以黄铁矿( )为主要原料接触法制硫酸工业的流程示意图(A.沸腾炉 B.接触室 C.吸收塔)
)为主要原料接触法制硫酸工业的流程示意图(A.沸腾炉 B.接触室 C.吸收塔) 接触氧化的反应,下图中的甲、乙、丙分别表示在不同条件下,
接触氧化的反应,下图中的甲、乙、丙分别表示在不同条件下, 在反应混合物中的体积分数(Y)与时间(X)的关系,请按要求填写:
在反应混合物中的体积分数(Y)与时间(X)的关系,请按要求填写:______ 表示有催化剂的情况;
②若乙图两条曲线分别表示不同压强的情况,则______ 表示压强较大的情况;
③若丙图两条曲线分别表示600℃和400℃的情况,则______ 表示600℃的情况。
(2)在生产中常使用过量的空气是为了______ 。
(3)接触法制硫酸的沸腾炉处产生的炉气必须经过净化处理,目的是为了______ 。
(4)从⑤处排出的气体是______(填序号)
(5)在B设备中加热到400℃~500℃是由于①加快反应速率,②______ 。
(6)对从进口⑧喷进的液体的叙述最准确的是______ (填序号)。
A.水 B.98.3%的浓硫酸 C.稀硫酸
(7)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理得到较高浓度的 和铵盐,
和铵盐, 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的 ,请写出
,请写出 吸收
吸收 的离子方程式:
的离子方程式:______ 。
 )为主要原料接触法制硫酸工业的流程示意图(A.沸腾炉 B.接触室 C.吸收塔)
)为主要原料接触法制硫酸工业的流程示意图(A.沸腾炉 B.接触室 C.吸收塔)
 接触氧化的反应,下图中的甲、乙、丙分别表示在不同条件下,
接触氧化的反应,下图中的甲、乙、丙分别表示在不同条件下, 在反应混合物中的体积分数(Y)与时间(X)的关系,请按要求填写:
在反应混合物中的体积分数(Y)与时间(X)的关系,请按要求填写: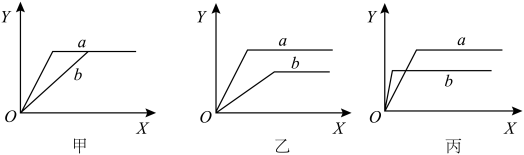
②若乙图两条曲线分别表示不同压强的情况,则
③若丙图两条曲线分别表示600℃和400℃的情况,则
(2)在生产中常使用过量的空气是为了
(3)接触法制硫酸的沸腾炉处产生的炉气必须经过净化处理,目的是为了
(4)从⑤处排出的气体是______(填序号)
A. 、 、 | B. 、 、 | C. 、 、 | D.水蒸气 |
(5)在B设备中加热到400℃~500℃是由于①加快反应速率,②
(6)对从进口⑧喷进的液体的叙述最准确的是
A.水 B.98.3%的浓硫酸 C.稀硫酸
(7)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理得到较高浓度的
 和铵盐,
和铵盐, 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的 ,请写出
,请写出 吸收
吸收 的离子方程式:
的离子方程式:
您最近一年使用:0次
4 . 利用向制取生物柴油的副产物甘油( )中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得
)中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得 、CO、
、CO、 、
、 等组成气体,通过调整反应的组成和条件可提高
等组成气体,通过调整反应的组成和条件可提高 产率。请回答:
产率。请回答:
(1)制氢的几个主要反应如下
反应1: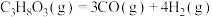
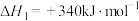
反应2:
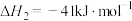
反应3:
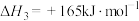
反应4: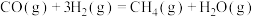

(1)计算
______ ,并判断该反应的自发性______ 。
(2)①温度控制不当,气相产物之间会发生积碳副反应从而影响氢气产率,反应如下:
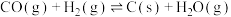
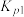 ,
,
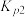 ;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压),
;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压), ,则平衡常数
,则平衡常数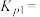
______ 。
②生产过程中,为减小积碳对氢气产率及催化剂的影响,下列措施合适的是______ (填序号)。
A.减小压强 B.通入过量的氧气 C.通入适量的水蒸气 D.选择合适的催化剂
③上述各反应达到平衡时,体系中各物质的物质的量分数受温度的影响如图,请结合图像解释,在图示温度范围内随着温度升高 的摩尔分数先迅速上升后缓慢下降的原因是
的摩尔分数先迅速上升后缓慢下降的原因是______ 。______ (表示在催化剂表面吸附态)(填序号)
A.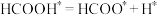
B.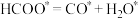
C.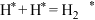
 )中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得
)中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得 、CO、
、CO、 、
、 等组成气体,通过调整反应的组成和条件可提高
等组成气体,通过调整反应的组成和条件可提高 产率。请回答:
产率。请回答:(1)制氢的几个主要反应如下
反应1:
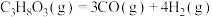
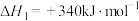
反应2:

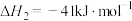
反应3:

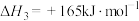
反应4:
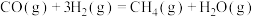

(1)计算

(2)①温度控制不当,气相产物之间会发生积碳副反应从而影响氢气产率,反应如下:
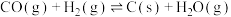
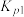 ,
,
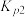 ;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压),
;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压), ,则平衡常数
,则平衡常数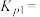
②生产过程中,为减小积碳对氢气产率及催化剂的影响,下列措施合适的是
A.减小压强 B.通入过量的氧气 C.通入适量的水蒸气 D.选择合适的催化剂
③上述各反应达到平衡时,体系中各物质的物质的量分数受温度的影响如图,请结合图像解释,在图示温度范围内随着温度升高
 的摩尔分数先迅速上升后缓慢下降的原因是
的摩尔分数先迅速上升后缓慢下降的原因是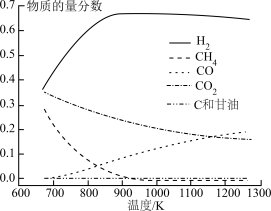
A.
B.
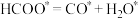
C.
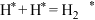
您最近一年使用:0次
名校
解题方法
5 . 有关工业固氮的说法正确的是
| A.使用铁催化剂可提高反应物的转化率 |
B.循环使用 、 、 可提高 可提高 的产率 的产率 |
C.温度控制在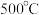 左右有利于反应向正方向进行 左右有利于反应向正方向进行 |
| D.增大压强有利于加快反应速率,所以压强越大越好 |
您最近一年使用:0次
名校
解题方法
6 . 有效去除大气中的NOx和水体中的氮是环境保护的重要课题。
(1)已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=________ 。
(2)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。________ 。
(3)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH 和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH
和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH ),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
①生成磷酸铵镁沉淀的离子反应方程式为________ 。
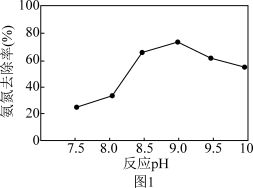
②测得反应pH对氨氮去除率的影响如下图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是________ 。
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如下图2所示, 转化为N2或
转化为N2或 的过程可描述为
的过程可描述为________ 。 去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是
去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是________ 。
(1)已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=
(2)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。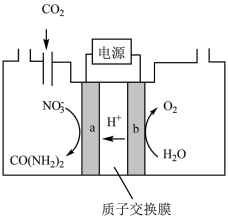
(3)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH
 和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH
和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH ),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。①生成磷酸铵镁沉淀的离子反应方程式为
②测得反应pH对氨氮去除率的影响如下图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如下图2所示,
 转化为N2或
转化为N2或 的过程可描述为
的过程可描述为 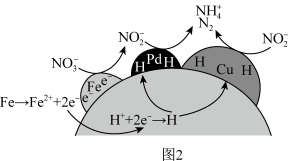
 去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是
去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是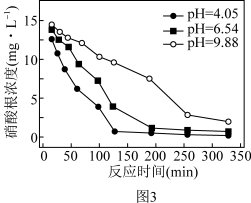
您最近一年使用:0次
名校
7 . NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速通过装有催化剂的反应管,
的混合气体以一定流速通过装有催化剂的反应管, 的转化率、生成
的转化率、生成 的选择性
的选择性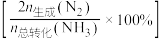 与温度的关系如图所示。下列说法正确的是
与温度的关系如图所示。下列说法正确的是
 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速通过装有催化剂的反应管,
的混合气体以一定流速通过装有催化剂的反应管, 的转化率、生成
的转化率、生成 的选择性
的选择性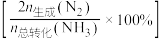 与温度的关系如图所示。下列说法正确的是
与温度的关系如图所示。下列说法正确的是
A.其他条件不变,升高温度, 的平衡转化率增大 的平衡转化率增大 |
B.其他条件不变,在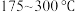 范围,随温度的升高,出口处 范围,随温度的升高,出口处 浓度不断增大 浓度不断增大 |
C.催化氧化除去尾气中的 应选择反应温度高于 应选择反应温度高于 |
D.高效除去尾气中的 ,需研发低温下 ,需研发低温下 转化率高和生成 转化率高和生成 选择性高的催化剂 选择性高的催化剂 |
您最近一年使用:0次
名校
解题方法
8 . 在 气氛中乙苯催化脱氢制苯乙烯的反应历程如下图。
气氛中乙苯催化脱氢制苯乙烯的反应历程如下图。_______________ 。
(2)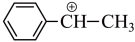 中
中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子数之比为
杂化的碳原子数之比为__________ 。
(3)催化剂表面酸碱性对乙苯脱氢反应性能影响较大。根据反应历程分析,催化剂表面碱性太强,会降低乙苯转化率的原因是__________________ 。
 气氛中乙苯催化脱氢制苯乙烯的反应历程如下图。
气氛中乙苯催化脱氢制苯乙烯的反应历程如下图。
(2)
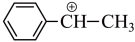 中
中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子数之比为
杂化的碳原子数之比为(3)催化剂表面酸碱性对乙苯脱氢反应性能影响较大。根据反应历程分析,催化剂表面碱性太强,会降低乙苯转化率的原因是
您最近一年使用:0次
名校
解题方法
9 . 通常在乙苯蒸汽中掺混水蒸气,控制温度600℃,并保持总压为常压。不同温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除 以外的产物中苯乙烯的物质的量分数)如图:
以外的产物中苯乙烯的物质的量分数)如图:
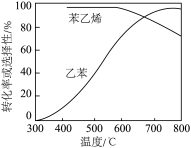
(1)掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实_____ 。
(2)控制反应温度为600℃的理由是_____ 。
(3)某机构用 代替水蒸气开发了乙苯-二氧化碳催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有
代替水蒸气开发了乙苯-二氧化碳催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_____
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用
 以外的产物中苯乙烯的物质的量分数)如图:
以外的产物中苯乙烯的物质的量分数)如图:
(1)掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实
(2)控制反应温度为600℃的理由是
(3)某机构用
 代替水蒸气开发了乙苯-二氧化碳催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有
代替水蒸气开发了乙苯-二氧化碳催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用
您最近一年使用:0次
10 . 历史上诺贝尔化学奖曾经3次颁给研究合成氨的化学家。合成氨的原理为  。回答下列问题。
。回答下列问题。
(1)t℃时,向填充有催化剂、体积为2L 的刚性容器中充入一定量的 和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
5~15min内 N2的平均反应速率  =
=___________ 
下列情况能说明反应达到平衡状态的是________ (填标号)。
A.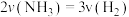 B. 混合气体的相对分子质量不再变化
B. 混合气体的相对分子质量不再变化
C. N2体积分数不再变化 D. 混合气体的密度保持不变
(2)如表列出了在不同温度和压强下,反应达到平衡时) 的百分含量
的百分含量  。
。
①从表中数据得出,最优的条件是___________ 。
②工业上通常选择在400~500℃和10~30MPa条件下合成氨, 原因是___________ 。
 。回答下列问题。
。回答下列问题。(1)t℃时,向填充有催化剂、体积为2L 的刚性容器中充入一定量的
 和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L⁻¹ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 =
=
下列情况能说明反应达到平衡状态的是
A.
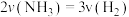 B. 混合气体的相对分子质量不再变化
B. 混合气体的相对分子质量不再变化C. N2体积分数不再变化 D. 混合气体的密度保持不变
(2)如表列出了在不同温度和压强下,反应达到平衡时)
 的百分含量
的百分含量  。
。压强/MPa 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.5 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
②工业上通常选择在400~500℃和10~30MPa条件下合成氨, 原因是
您最近一年使用:0次



