1 .  既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
(1)甲烷在高温条件下可分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是___________ 。
(2)以 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入
为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入 的电极为
的电极为___________ (填“正极”或“负极”),通入 的电极反应式为
的电极反应式为___________ (质子交换膜只允许 通过)。
通过)。

(3)在一定温度和催化剂作用下, 与
与 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。
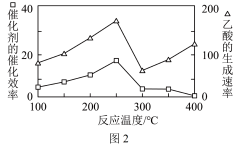
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在___________ 左右。
② 与
与 可直接转化成乙酸的原子利用率为
可直接转化成乙酸的原子利用率为___________ 。
(4)碳正离子[例如: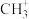 、
、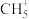 、
、 等]是有机反应中间体,
等]是有机反应中间体,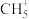 碳正离子是由
碳正离子是由 在“超强酸”中获得一个
在“超强酸”中获得一个 而得到,而
而得到,而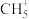 失去
失去 可得
可得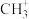 。
。 去掉
去掉 后生成电中性有机分子,该分子的结构简式为
后生成电中性有机分子,该分子的结构简式为___________ 。
(5) 与
与 在光照条件下可发生反应。
在光照条件下可发生反应。
①实验室中用如图3所示的装置进行实验。

在光照条件下反应一段时间后,可观察到试管中的现象为___________ 。
② 与
与 生成
生成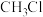 的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
的反应过程,中间态物质的能量关系见图4。有关说法不正确的是___________ (填字母)。
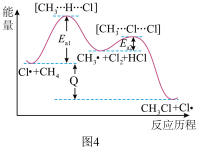
A.Cl是 在光照下化学键断裂生成的,该过程可表示为
在光照下化学键断裂生成的,该过程可表示为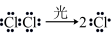
B.反应过程一定无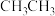 生成
生成
C.图示 到
到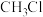 的反应过程放出热量
的反应过程放出热量
D. 转化为
转化为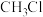 ,
, 键发生了断裂
键发生了断裂
 既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:(1)甲烷在高温条件下可分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(2)以
 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入
为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入 的电极为
的电极为 的电极反应式为
的电极反应式为 通过)。
通过)。
(3)在一定温度和催化剂作用下,
 与
与 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在

②
 与
与 可直接转化成乙酸的原子利用率为
可直接转化成乙酸的原子利用率为(4)碳正离子[例如:
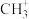 、
、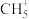 、
、 等]是有机反应中间体,
等]是有机反应中间体,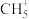 碳正离子是由
碳正离子是由 在“超强酸”中获得一个
在“超强酸”中获得一个 而得到,而
而得到,而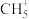 失去
失去 可得
可得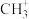 。
。 去掉
去掉 后生成电中性有机分子,该分子的结构简式为
后生成电中性有机分子,该分子的结构简式为(5)
 与
与 在光照条件下可发生反应。
在光照条件下可发生反应。①实验室中用如图3所示的装置进行实验。

在光照条件下反应一段时间后,可观察到试管中的现象为
②
 与
与 生成
生成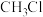 的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
A.Cl是
 在光照下化学键断裂生成的,该过程可表示为
在光照下化学键断裂生成的,该过程可表示为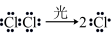
B.反应过程一定无
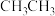 生成
生成C.图示
 到
到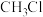 的反应过程放出热量
的反应过程放出热量D.
 转化为
转化为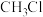 ,
, 键发生了断裂
键发生了断裂
您最近一年使用:0次
2 . 现代工业的发展导致CO2大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,现已开发出多项将CO2回收利用的技术。某科研小组提出CO2催化加氢合成乙烯。回答下列问题:
(1)已知:H2(g)、C2H4(g)的燃烧热(∆H)分别为-285.8 kJ·mol-1、-1411 kJ·mol-1,
H2O(g)=H2O(l) ∆H=-44 kJ·mol-1。
则2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ∆H=
C2H4(g)+4H2O(g) ∆H=__ kJ·mol-1。
(2)某科研小组利用含铁复合催化剂催化合成乙烯,其反应机理如图:
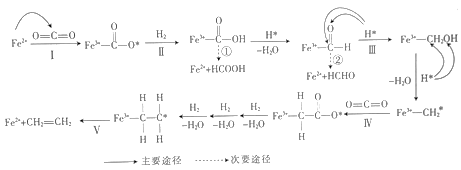
在上述反应途径中,生成的副产物主要有__ (填化学式),写出反应Ⅱ的化学方程式:__ 。
(3)在使用不同催化剂的作用下可发生CO2(g)+4H2(g) CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表:
CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表:
①分析表中数据可知:催化剂___ (填标号)的催化性能更好。
②调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如表:
分析表中数据可知:相同温度时,随着气体流速增大,CO2的转化率__ (填“增大”或“减小”),其可能的原因是__ 。
③在上述实验条件中,反应肯定达到化学平衡状态的温度是__ ℃。
(4)在温度为T ℃时,将2 mol CO2和6 mol H2通入压强为p的恒容密闭容器内,使用含铁复合催化剂发生反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=
C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=___ (列出计算式即可)。
(1)已知:H2(g)、C2H4(g)的燃烧热(∆H)分别为-285.8 kJ·mol-1、-1411 kJ·mol-1,
H2O(g)=H2O(l) ∆H=-44 kJ·mol-1。
则2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ∆H=
C2H4(g)+4H2O(g) ∆H=(2)某科研小组利用含铁复合催化剂催化合成乙烯,其反应机理如图:

在上述反应途径中,生成的副产物主要有
(3)在使用不同催化剂的作用下可发生CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表:
CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表: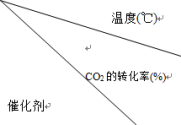 | 180 | 200 | 220 | 280 | 300 | 320 | 340 | 360 |
| a | 5.0 | 15.3 | 33.5 | 64.8 | 80.1 | 82.7 | 95.6 | 91.1 |
| b | 0.5 | 1.2 | 3.8 | 24.5 | 36.8 | 51.6 | 61.1 | 60.0 |
②调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如表:
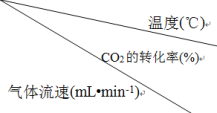 | 180 | 200 | 220 | 280 | 300 | 320 | 340 | 360 |
| 10 | 8.0 | 20.3 | 38.5 | 78.8 | 89.2 | 95.8 | 98.8 | 98.0 |
| 20 | 3.0 | 13.3 | 30.5 | 60.8 | 78.1 | 81.7 | 91.6 | 90.0 |
| 30 | 1.2 | 10.4 | 25.5 | 58.8 | 72.2 | 74.8 | 76.2 | 75.3 |
| 40 | 1.0 | 8.9 | 24.3 | 55.6 | 70.1 | 73.9 | 74.1 | 73.6 |
③在上述实验条件中,反应肯定达到化学平衡状态的温度是
(4)在温度为T ℃时,将2 mol CO2和6 mol H2通入压强为p的恒容密闭容器内,使用含铁复合催化剂发生反应2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=
C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=
您最近一年使用:0次
3 . 氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
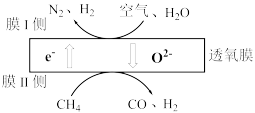
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________ ,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) ⇌CH3OH(g) △H1
已知CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) ⇌CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
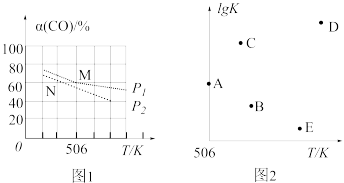
①压强p1_____ (填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______ (用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
由表中数据可知,m=_______ ,n=_______ 。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) ⇌N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) ⇌2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为

(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) ⇌CH3OH(g) △H1
已知CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) ⇌CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。

①压强p1
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是
(4)H2还原NO的反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
| 编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
| 1 | 0.10 | 0.10 | 0.414 |
| 2 | 0.10 | 0.20 | 1.656 |
| 3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) ⇌N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) ⇌2H2O(l)(快反应)。下列说法正确的是
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
您最近一年使用:0次
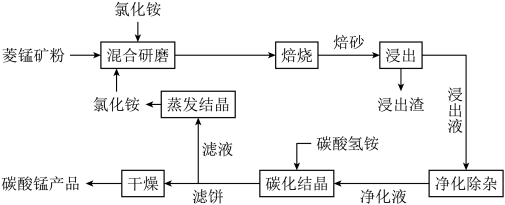
4 . 碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
③常温下,Ksp(CaF2)=1.46×10−10,Ksp(MgF2)=7.42×10−11;Ka(HF)=1.00×10−4
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
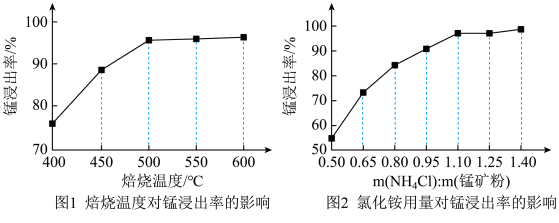
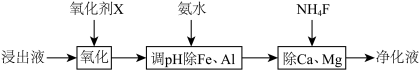
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中, =
=______ 若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________

已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“混合研磨”的作用为
(2)“焙烧”时发生的主要反应的化学方程式为
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是

(4)净化除杂流程如下

①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,
 =
=(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是
您最近一年使用:0次
5 . 在下列平衡 (黄色)
(黄色) (橙红色)
(橙红色) 中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入
中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入
 (黄色)
(黄色) (橙红色)
(橙红色) 中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入
中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入A.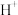 | B. | C. | D. |
您最近一年使用:0次
2019-01-16更新
|
303次组卷
|
17卷引用:甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题
甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题2015-2016学年河北省唐山市高二上学期期末考试化学试卷甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题天津市红桥区2020 届高三期末质量检测化学试题福建省莆田第十五中学2019-2020学年高二上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题天津市红桥区2019-2020学年高三上学期期末考试化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(A卷)试题(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年河北省涿州二中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷2014-2015学年广东省深圳市明珠学校高二上学期期中化学试卷广东省阳东广雅学校2017-2018学年高二10月月考化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题
名校
6 . 冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a火烧孔雀石炼铜;b湿法炼铜;现代有:c铝热法炼铁;d光卤石法炼镁。对它们的冶炼方法分析不正确的是
| A.a② | B.b③ | C.c④ | D.d⑤ |
您最近一年使用:0次
2018-08-23更新
|
645次组卷
|
27卷引用:【全国百强校】甘肃省兰州第一中学2017-2018学年高一下学期期末考试化学试题
【全国百强校】甘肃省兰州第一中学2017-2018学年高一下学期期末考试化学试题(已下线)09-10年河南方城二高高一下学期期末化学卷(已下线)2012-2013学年四川省成都七中高一下学期期末考试化学试卷(已下线)2013-2014辽宁省五校第二学期期末联考高一化学试卷广东省佛山市超盈实验中学2016-2017学年高一下学期期末模拟化学试题广东省仲元中学2016-2017学年高一下学期期末考试(理)化学试题甘肃省武威市第一中学2019届高三上学期10月月考化学试题甘肃省武威第一中学2019-2020学年高二10月月考化学试题(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷(已下线)2014年高二化学苏教版选修2 2.4镁和铝的冶炼练习卷2015届浙江省诸暨中学高三上学期期中化学试卷2015届广西玉林市博白县高三下学期返校调研考试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2016-2017学年湖北省黄冈市蕲春县高一下学期期中考试化学试卷陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题广西桂林市桂林中学2016-2017学年高一下学期期中考试化学试题湖北省蕲春县2016-2017学年高一下学期期中考试化学试题山西省太原市黄陵中学高新部2017-2018学年高二上学期开学考化学试题湖北省黄冈中学2016-2017学年高一下学期期中考试化学试题【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试化学(文)试题云南省建水县民中2017-2018学年高一下学期6月份考试化学试题2019年高考化学一轮复习《化学与自然资源的开发利用》专题同步练习卷黑龙江省青冈县一中2018-2019学年高二上学期开学考试化学试题(已下线)2018年11月2日 《每日一题》一轮复习-金属矿物的开发利用(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (教学案)安徽省郎溪县郎溪中学2018-2019学年高一下学期第一次月考化学试题福建省泉州第五中学2020-2021学年高一下学期期中考试化学试题
名校
7 . 化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
| A.能够节约原料和能源 | B.能够提高产品的产量 |
| C.能够提高经济效益 | D.能够提高化学反应速率 |
您最近一年使用:0次
2016-12-09更新
|
1260次组卷
|
16卷引用:【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期末考试化学试题
【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期末考试化学试题【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期中考试化学试题贵州省毕节市纳雍县第一中学2018-2019学年高一下学期期末考试化学试题(已下线)2010—2011学年江西省赣州市高一下学期十一县市期中联考化学试卷(已下线)2011-2012年浙江温州龙湾中学高一期中考试理科化学试卷河北省宣化市第一中学2019-2020学年高一11月月考化学试题(已下线)2.4 化学反应的调控(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)6.2.2 化学反应的限度(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)第14讲 化学反应的限度(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)江苏省徐州市睢宁县2021-2022学年高一下学期期中考试(线上)化学试题宁夏吴忠中学2021-2022学年高一下学期期中考试化学试题广西桂林市第十九中学2021-2022学年高一下学期期中考试化学试题(已下线)课时5化学反应条件的控制河北省唐县第一中学2022-2023学年高一下学期3月月考化学试题第2课时 化学反应的限度、化学反应条件的控制1四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题



