名校
解题方法
1 . 工业上利用黄铁矿(FeS2)制取硫酸,其反应流程如下:

| A.反应①矿石粉碎的目的是提高反应速率 |
| B.反应②中即使通入过量的氧气,也不能将SO2全部转化成SO3 |
| C.接触室选择500℃左右的温度是因为比常温更有利于合成SO3 |
| D.过量的氨水吸收SO2的化学方程式:2NH3·H2O+SO2=(NH4)2SO3+H2O |
您最近一年使用:0次
2024-03-20更新
|
83次组卷
|
2卷引用:广东省惠州一中实验学校2023-2024学年高二上学期期中考试化学试题
2 . 下列实验事实不能 用平衡移动原理解释的是
A.将NO2球浸泡在冷水和热水中 |
B.排饱和食盐水收集Cl2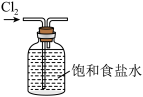 |
C.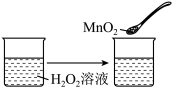 |
D.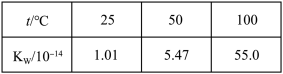 |
您最近一年使用:0次
3 . 下列事实不能用勒夏特列(平衡移动)原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.晒自来水养小金鱼 |
| C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
| D.合成氨时采用铁触媒作反应催化剂 |
您最近一年使用:0次
解题方法
4 . 金属钼具有高强度、高熔点、耐磨抗腐性等优点,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
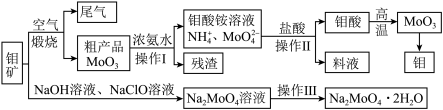
(1)Na2MoO4·2H2O中钼元素的价态为___________ ,煅烧产生的尾气引起的环境危害主要是:___________ 。
(2)用浓氨水溶解粗产品的离子方程式是___________ ,由图中信息可以判断MoO3是___________ 氧化物(填“酸性”“碱性”或“两性”)。
(3)操作Ⅰ是___________ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是___________ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出。
①请配平以下化学反应:_________
NaClO+___________MoS2+___________NaOH=__________Na2MoO4+___________Na2SO4+___________NaCl+___________H2O。
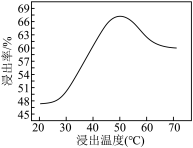
②钼的浸出率随着温度变化如图,浸出反应属于___________ 反应(放热或吸热)。

(1)Na2MoO4·2H2O中钼元素的价态为
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出。
①请配平以下化学反应:
NaClO+___________MoS2+___________NaOH=__________Na2MoO4+___________Na2SO4+___________NaCl+___________H2O。
②钼的浸出率随着温度变化如图,浸出反应属于

您最近一年使用:0次
5 . 已知反应COCl2(g)⇌CO(g) + Cl2(g) ΔH>0,当反应达到平衡时,下列措施中能提高COCl2转化率的是
①升温 ②恒容通入惰性气体③增加CO浓度 ④增大容器的容积 ⑤加催化剂 ⑥恒压通入惰性气体
①升温 ②恒容通入惰性气体③增加CO浓度 ④增大容器的容积 ⑤加催化剂 ⑥恒压通入惰性气体
| A.①②④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |
您最近一年使用:0次
解题方法
6 . 已知 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
Ⅰ.方案讨论
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是___________ (填序号)。
(2)已知 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着___________ (填“正反应”或“逆反应”)方向移动,溶液颜色将___________ (填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
(3)实验ⅰ没有观察到预期现象的原因是___________ ,实验ⅱ的原因与其相似。
(4)通过实验ⅲ和ⅳ得出的结论为___________ 。
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸___________ (填“能”或“不能”)达到预期目的,理由是___________ 。
(6)某同学查阅资料发现: 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
①方案一:取5mL浓盐酸,向其中加入15滴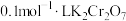 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式___________ 。
②请你设计方案二:___________ 。
 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。 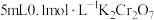 溶液 溶液 | 序号 | 试剂X |
| ⅰ | 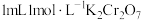 溶液 溶液 | |
| ⅱ | 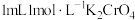 溶液 溶液 | |
| ⅲ | 5~15滴浓盐酸 | |
| ⅳ | 5~15滴 溶液 溶液 |
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是
(2)已知
 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 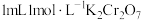 溶液 溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 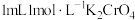 溶液 溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓盐酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴 溶液 溶液 | 溶液变黄 | 溶液变黄 |
(3)实验ⅰ没有观察到预期现象的原因是
(4)通过实验ⅲ和ⅳ得出的结论为
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸
(6)某同学查阅资料发现:
 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。①方案一:取5mL浓盐酸,向其中加入15滴
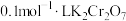 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式②请你设计方案二:
您最近一年使用:0次
名校
7 . 含氯化合物在工农业生产和日常生活中用途十分广泛。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为______ 。
(2)过程Ⅲ中,MnO2 在___________极产生。
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:______ 。
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):______ 。
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为________ 。
(5)从吸收塔流出的溶液中主要含的负离子有___________。
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:________ 。E中的反应的离子方程方程式为________ 。
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是________ 。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为
(2)过程Ⅲ中,MnO2 在___________极产生。
| A.正极 | B.负极 | C.阳极 | D.阴极 |
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为
(5)从吸收塔流出的溶液中主要含的负离子有___________。
| A.OH- | B.Br- | C. | D. |
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是
您最近一年使用:0次
名校
8 . 习近平主席在《中央城镇化工作会议》发出号召:“让居民望得见山、看得见水、记得住乡愁”。
I.CO2捕集技术能有效解决温室效应及能源短缺问题。
CO2催化加氢制CH3OH的反应体系中,发生的反应如下:
反应a:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应b:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应c:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性=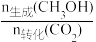 ×100%]随温度变化如图所示:
×100%]随温度变化如图所示:
(1)①ΔH3=______ 。
A.ΔH1+ΔH2 B.ΔH1-ΔH2 C.ΔH1×ΔH2 D.ΔH1÷ΔH2
②反应b的平衡常数表达式为______ 。
(2)电催化还原CO2生成含碳产物(如CO、CH3OH等)原理如图所示:若用Ag负载在TiO2载体上制得Ag/TiO2催化剂,作为电极可促进CO2还原为CO,其机理如图所示。该机理中CO2还原为CO的过程可表述为___________ 。

Ⅱ.NO2和CO是常见的环境污染气体,消除污染对建设美丽家乡,打造宜居环境具有重要意义。
汽车尾气中C、NO2在一定条件下可以发生反应:4CO(g) + 2NO2(g) 4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

(3)①从反应开始到10 min的平衡状态,N2的平均反应速率为______ 。从11 min起,其他条件不变,压缩容器的容积为1 L,则n(NO2)的变化曲线可能为图中的______ (填abcd字母)。
②使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g),该反应过程中的能量变化如图:

途径(Ⅰ)变为途径(Ⅱ):活化分子的百分率______ 。
A.增大 B.减小 C.不变 D.不一定
Ⅲ.SO2是大气的主要污染物,工业上利用钠碱循环法可除去SO2。
(4)已知:25OC时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8 ,Ka3=4.4×10-13;H2SO3的电离常数为Ka1=1.3×10-2,Ka2=6.6×10-8,则下列各组微粒可以大量共存的是_______。
(5)25OC时,H2SO3及其钠盐的溶液中,H2SO3、 、
、 的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。
的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。

①NaHSO3溶液呈酸性,溶液中离子浓度的由大到小排序为_______ 。
②当溶液恰好呈中性时:c(Na+)、c( )、c(
)、c( )的等量关系关系为
)的等量关系关系为_______ 。
I.CO2捕集技术能有效解决温室效应及能源短缺问题。
CO2催化加氢制CH3OH的反应体系中,发生的反应如下:
反应a:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1反应b:CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2反应c:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性=
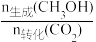 ×100%]随温度变化如图所示:
×100%]随温度变化如图所示:(1)①ΔH3=
A.ΔH1+ΔH2 B.ΔH1-ΔH2 C.ΔH1×ΔH2 D.ΔH1÷ΔH2
②反应b的平衡常数表达式为
(2)电催化还原CO2生成含碳产物(如CO、CH3OH等)原理如图所示:若用Ag负载在TiO2载体上制得Ag/TiO2催化剂,作为电极可促进CO2还原为CO,其机理如图所示。该机理中CO2还原为CO的过程可表述为

Ⅱ.NO2和CO是常见的环境污染气体,消除污染对建设美丽家乡,打造宜居环境具有重要意义。
汽车尾气中C、NO2在一定条件下可以发生反应:4CO(g) + 2NO2(g)
 4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
(3)①从反应开始到10 min的平衡状态,N2的平均反应速率为
②使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g),该反应过程中的能量变化如图:

途径(Ⅰ)变为途径(Ⅱ):活化分子的百分率
A.增大 B.减小 C.不变 D.不一定
Ⅲ.SO2是大气的主要污染物,工业上利用钠碱循环法可除去SO2。
(4)已知:25OC时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8 ,Ka3=4.4×10-13;H2SO3的电离常数为Ka1=1.3×10-2,Ka2=6.6×10-8,则下列各组微粒可以大量共存的是_______。
A. 和H3PO4 和H3PO4 | B.H3PO4和 | C. 和 和 | D. 和 和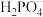 |
(5)25OC时,H2SO3及其钠盐的溶液中,H2SO3、
 、
、 的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。
的物质的量分数随溶液pH变化关系如图所示。钠碱循环法中,吸收液为Na2SO3溶液,可用Na2SO3溶液吸收SO2制备NaHSO3。
①NaHSO3溶液呈酸性,溶液中离子浓度的由大到小排序为
②当溶液恰好呈中性时:c(Na+)、c(
 )、c(
)、c( )的等量关系关系为
)的等量关系关系为
您最近一年使用:0次
名校
解题方法
9 . 在某一恒温体积可变的密闭容器中发生反应:X(g)+Y(g) 2Z(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是
2Z(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是
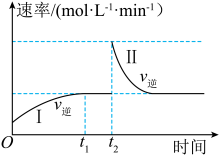
 2Z(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是
2Z(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是
| A.O~t2时,v正>v逆 |
| B.t2时刻改变的条件是向密闭容器中加Z |
| C.t2时刻改变的条件是从密闭容器中抽出了Y |
| D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ |
您最近一年使用:0次
名校
10 . 有一种选择性氧化醇的方法叫欧芬脑尔氧化法,它是指在三级丁醇铝(Al[OC(CH3)3]3)存在的条件下,醇和丙酮发生反应,醇失去两个氢原子被氧化为对应的酮,如下图所示:
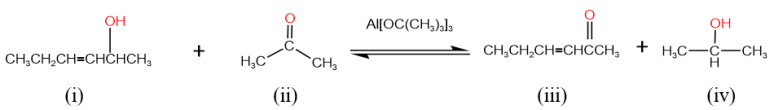
此过程中,只在醇和丙酮之间发生了氢原子的转移,不涉及分子的其他部分。下列说法中不正确的是

此过程中,只在醇和丙酮之间发生了氢原子的转移,不涉及分子的其他部分。下列说法中不正确的是
| A.醇(i)发生了氧化反应,丙酮(ii)对应发生了还原反应 |
| B.该反应的选择性体现在分子中其他易被氧化的结构如碳碳双键未被氧化 |
| C.该反应是一个可逆反应,因此可以通过加入过量2-丙醇(iv)促使反应逆向进行 |
| D.该反应是一个可逆反应,因此可以通过加入金属Na消耗(i)促使反应逆向进行 |
您最近一年使用:0次



