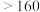解题方法
1 . 镍在工业生产中有重要作用,以粗氧化镍(主要含 、
、 、Fe2O3等)为原料制备纯镍的流程示意图如下:
、Fe2O3等)为原料制备纯镍的流程示意图如下:
(1)已知C与CO的燃烧热分别为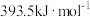 、
、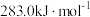 ,则反应
,则反应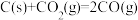
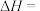
________  。
。
(2)碱洗过程中发生反应的离子方程式为________ 。
(3)羰化反应为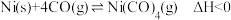 。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
①反应Ⅰ在该温度下的平衡常数K=________ (含x的表达式表示,不考虑单位)。
②下列不能说明反应Ⅲ达到平衡状态的是________ 。
a、平衡常数K不再改变 b.Ni的质量不再改变
c.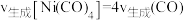 d.容器内的压强不再改变
d.容器内的压强不再改变
③比较平衡时下列物理量的大小:CO的体积分数Ⅰ________ Ⅱ;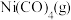 的浓度Ⅰ
的浓度Ⅰ________ Ⅲ(填“>”、“<”或“=”)
(4)羰化后的产物为 、
、 、
、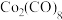 ,有关性质如下表。蒸馏提取
,有关性质如下表。蒸馏提取 应选择的适宜温度范围是
应选择的适宜温度范围是________ 。
(5)采用较高温度下分解 制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:________ 。
 、
、 、Fe2O3等)为原料制备纯镍的流程示意图如下:
、Fe2O3等)为原料制备纯镍的流程示意图如下:
(1)已知C与CO的燃烧热分别为
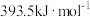 、
、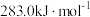 ,则反应
,则反应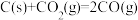
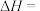
 。
。(2)碱洗过程中发生反应的离子方程式为
(3)羰化反应为
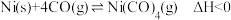 。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:反应时间 |
| CO |
| |
反应Ⅰ:恒温恒容 | 0 min | 足量 | 4 mol | 0 |
| x mol | |||
反应Ⅱ:恒温恒压 | 0 min | 足量 | 4 mol | 0 |
反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 1 mol |
②下列不能说明反应Ⅲ达到平衡状态的是
a、平衡常数K不再改变 b.Ni的质量不再改变
c.
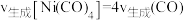 d.容器内的压强不再改变
d.容器内的压强不再改变③比较平衡时下列物理量的大小:CO的体积分数Ⅰ
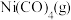 的浓度Ⅰ
的浓度Ⅰ(4)羰化后的产物为
 、
、 、
、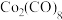 ,有关性质如下表。蒸馏提取
,有关性质如下表。蒸馏提取 应选择的适宜温度范围是
应选择的适宜温度范围是物质 |
|
|
|
沸点/℃ | 106 | 43.2 | 52 |
熔点/℃ |
|
| 31 |
分解温度/℃ |
| 135 | — |
 制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
您最近一年使用:0次
名校
解题方法
2 . 醋酸钠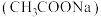 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。
(1)配制 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,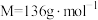 )的质量为
)的质量为_______ 。实验需要的仪器有天平、药匙、玻璃棒、量筒、_______ (从下列图中选择,写出名称)。 水解程度的影响。
水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为 ):
):
i.实验_______ 和_______ (填序号),探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3,探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4,探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_______ 。
②实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据_______ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测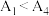 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是_______ 。
(3)小组通过测定不同温度下 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。
查阅资料: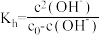 ,
, 为
为 溶液起始浓度。
溶液起始浓度。
试剂: 溶液、
溶液、 盐酸、
盐酸、 计。
计。
实验:测定40℃下 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。
在50℃和60℃下重复上述实验。
数据处理:40℃,
_______ (用含 、
、 、
、 的计算式表示)
的计算式表示)
实验结论: ,温度升高,促进
,温度升高,促进 水解。
水解。
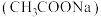 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。(1)配制
 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,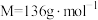 )的质量为
)的质量为
 水解程度的影响。
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
 ):
):i.实验
 水解程度的影响;
水解程度的影响;ii.实验1和3,探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4,探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 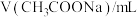 |  | 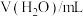 |  |
| 1 | 25℃ | 40.0 | 0 | 0 |  |
| 2 | 25℃ | 4.0 | 0 | 36.0 |  |
| 3 | 25℃ | 20.0 | 10.0 |  |  |
| 4 | 40℃ | 40.0 | 0 | 0 |  |

②实验测得
 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是(3)小组通过测定不同温度下
 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。查阅资料:
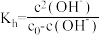 ,
, 为
为 溶液起始浓度。
溶液起始浓度。试剂:
 溶液、
溶液、 盐酸、
盐酸、 计。
计。实验:测定40℃下
 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。| 序号 | 实验 | 记录的数据 |
| 5 | 取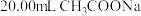 溶液,用 溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为 |
| 6 | 测40℃纯水的 |  |
| 7 |  |
数据处理:40℃,

 、
、 、
、 的计算式表示)
的计算式表示)实验结论:
 ,温度升高,促进
,温度升高,促进 水解。
水解。
您最近一年使用:0次
2023-03-16更新
|
2406次组卷
|
5卷引用:广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题
广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题广东省广州市2023届高三一模考试化学试题(已下线)专题19 实验综合题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(实验综合题)广东省广州市2022-2023学年高三普通高中毕业班综合测试(一)化学试题
解题方法
3 . 丙烯是重要的化工原料,其用量仅次于乙烯,研究丙烯的制取工艺具有重要意义。丙烷催化脱氢制取丙烯的过程中涉及的主要反应有:
Ⅰ.

Ⅱ.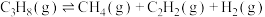
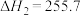 kJ·moL⁻¹
kJ·moL⁻¹
Ⅲ.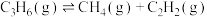
 kJ·moL⁻¹
kJ·moL⁻¹
已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性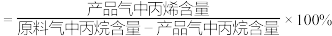
丙烯收率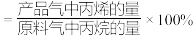
回答下列问题:
(1)下图中能正确表示反应Ⅰ的化学平衡常数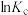 与温度T关系的是
与温度T关系的是_______ (填序号)。
a.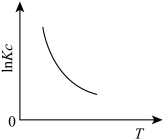 b.
b. 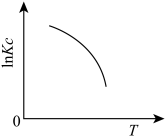 c.
c. 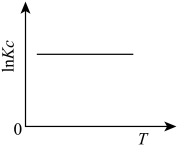 d.
d. 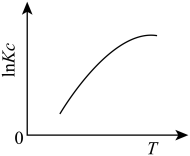
(2)在100kPa的恒压条件下,将1 mol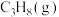 加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
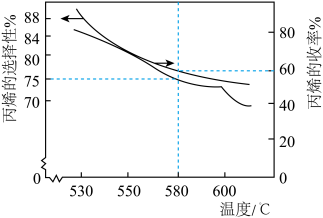
①温度高于600℃时丙烯的选择性降低幅度增大的原因是_______ 。
②580℃,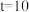 min时,反应体系达到平衡,丙烷的平衡转化率为
min时,反应体系达到平衡,丙烷的平衡转化率为_______ ,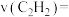
_______ kPa·min⁻¹。反应Ⅰ的压强平衡常数
_______ kPa(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
(3)工业上在保持100kPa的恒压条件下,通常在原料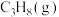 中掺混一定量惰性气体,掺混一定量惰性气体的原理是
中掺混一定量惰性气体,掺混一定量惰性气体的原理是_______ 。
Ⅰ.


Ⅱ.
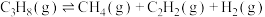
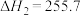 kJ·moL⁻¹
kJ·moL⁻¹Ⅲ.
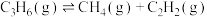
 kJ·moL⁻¹
kJ·moL⁻¹已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性
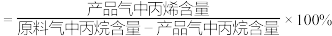
丙烯收率
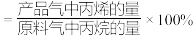
回答下列问题:
(1)下图中能正确表示反应Ⅰ的化学平衡常数
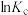 与温度T关系的是
与温度T关系的是a.
 b.
b.  c.
c.  d.
d. 
(2)在100kPa的恒压条件下,将1 mol
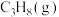 加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
①温度高于600℃时丙烯的选择性降低幅度增大的原因是
②580℃,
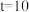 min时,反应体系达到平衡,丙烷的平衡转化率为
min时,反应体系达到平衡,丙烷的平衡转化率为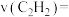

(3)工业上在保持100kPa的恒压条件下,通常在原料
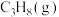 中掺混一定量惰性气体,掺混一定量惰性气体的原理是
中掺混一定量惰性气体,掺混一定量惰性气体的原理是
您最近一年使用:0次
2023-02-22更新
|
0次组卷
|
3卷引用:山东省济宁市泗水县2023-2024学年高二上学期期中考试化学试题
4 . 在Ni/凹凸棒石催化剂下可发生反应:C2H5OH(g) + 3H2O(g)  2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
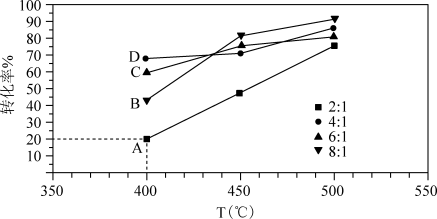
 2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
A.C2H5OH(g) + 3H2O(g)  2CO2(g) +6 H2 (g ) ΔH<0 2CO2(g) +6 H2 (g ) ΔH<0 |
B.若乙醇的起始物质的量为 1 mol, 则 K ( 400°C ) =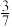 |
| C.B、C 两点一定未达到平衡状态 |
| D.水醇比过高,过多的水分子可能会占据催化剂表面活性位,导致反应速率降低,则相同时间内乙醇转化率降低 |
您最近一年使用:0次
2020-09-03更新
|
924次组卷
|
4卷引用:山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题
山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题山东省名校交流2020届高三下学期六月联考化学试题(已下线)第02章 化学反应的方向、限度与速率(B卷能力提升卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题
5 . 在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
| A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 04 mol·L-1·min-1 |
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的 △H<0,且a =2 zC(g)的 △H<0,且a =2 |
| C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
您最近一年使用:0次
2020-04-30更新
|
1403次组卷
|
25卷引用:2013-2014浙江省温州中学高二下学期期中化学试卷
(已下线)2013-2014浙江省温州中学高二下学期期中化学试卷(已下线)2014届江苏启东中学第二学期期中考试高二实验班化学试卷(已下线)2014届浙江省温州中学高二下学期期中化学试卷 【全国百强校】湖北省黄冈市黄冈中学2018-2019高二上学期期中模考化学试题甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题(已下线)2013-2014学年江苏省扬州中学高二下学期4月阶段测试化学试卷2015届湖南省浏阳一中高三上学期12月联考化学试卷2015届江苏省扬州中学高三4月双周测化学试卷2016届江苏省灌云县第一中学高三上学期第二次学情检测化学试卷2016届天津市六校高三上学期期末联考化学试卷2017届福建省漳州市八校高三上学期期末联考化学试卷山西省孝义市2017届高三下学期考前热身训练理综化学试题安徽省六安市第一中学2018届高三上学期第五次月考化学试题江苏省海安高级中学2019-2020学年高二10月月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题内蒙古阿拉善盟2020届高三上学期月考化学试题江苏省淮阴中学2021届高三上学期开学练习化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 章末综合检测卷(已下线)练习3 化学反应速率的计算及其影响因素-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷湖南省娄底市2021-2022学年高三上学期期末教学质量检测化学试题江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题