解题方法
1 . CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
①根据图表数据分析T1 ℃时,该反应在0~10 min内的平均反应速率v(NO)=_____ mol·L-1·min-1;计算该反应的平衡常数K=_______ 。
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是_____ (填字母编号)。
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率_______ (填“升高”或“降低”),∆H______ 0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式_______
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO )∶c(CO
)∶c(CO ) =
) =______ 。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_____ 。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10 -10]。(忽略溶液体积的变化)
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO
 )∶c(CO
)∶c(CO ) =
) =②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
名校
解题方法
2 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备。铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
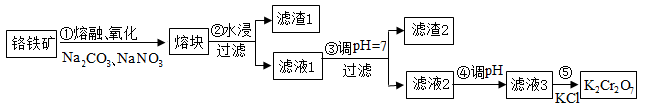
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为____________ 。该步骤不能使用陶瓷容器,原因是________ (用化学方程式表示)。
(2)滤渣1中含量最多的金属元素是____ (填写元素符号),设计实验方案验证滤渣1中经步骤①中反应后的产物_____ 。滤渣2的主要成分是______ (填写化学式)及含硅杂质。
(3)步骤④调滤液2的pH使之变________ (填“大”或“小”),原因是_________ (用离子方程式和适当的文字表述说明)。
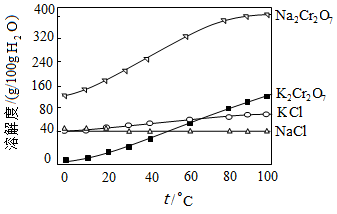
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式____________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式

您最近一年使用:0次
2020-11-19更新
|
226次组卷
|
2卷引用:广东省深圳外国语学校2021届高三第二次月考化学试题
3 . 在Ni/凹凸棒石催化剂下可发生反应:C2H5OH(g) + 3H2O(g)  2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
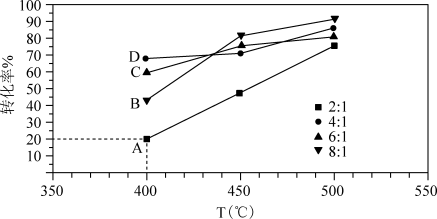
 2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
2CO2(g) +6 H2 (g ),如图为在2 L刚性容器中,相同时间内不同水醇比(乙醇的起始物质的量相同)测得乙醇转化率随温度变化的关系图,其中水醇比为2:1 时,各点均已达到平衡状态,下列说法正确的是( )
A.C2H5OH(g) + 3H2O(g)  2CO2(g) +6 H2 (g ) ΔH<0 2CO2(g) +6 H2 (g ) ΔH<0 |
B.若乙醇的起始物质的量为 1 mol, 则 K ( 400°C ) =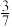 |
| C.B、C 两点一定未达到平衡状态 |
| D.水醇比过高,过多的水分子可能会占据催化剂表面活性位,导致反应速率降低,则相同时间内乙醇转化率降低 |
您最近一年使用:0次
2020-09-03更新
|
924次组卷
|
4卷引用:山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题
山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题山东省名校交流2020届高三下学期六月联考化学试题(已下线)第02章 化学反应的方向、限度与速率(B卷能力提升卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题
4 . 硫的化合物在生产生活、环境保护等领域应用广泛。
(1)NO2与SO2能发生反应,某研究小组对此进行相关实验探究。
已知:2NO(g)+O2(g)=2NO2(g) △H=-113kJ•mol-1
2SO2(g)+O2(g)=2SO3(g) △H=-196.6kJ•mol-1
则NO2(g)+SO2(g)=SO3(g)+NO(g)△H=___ 。
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(SO2):n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率。部分实验结果如图所示:

①如果要将图中B点的平衡状态改为C点的平衡状态,应采取的措施是___ 。
②若A点对应实验中,SO2(g)的起始浓度为amol•L-1,经过tmin达到平衡状态,该时段化学反应速率v(NO2)=___ mol•L-1•min-1。
③图中C、D两点对应的实验温度分别为T1和T2,通过计算判断:T1___ T2(填“>”、“=”或“<”)。
(2)NaHS可用作污水处理沉淀剂。
已知:25℃时,反应Hg2+(aq)+HS-(aq) HgS(s)+H+(aq)的平衡常数K=3.5×1037;H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。Ksp(HgS)=
HgS(s)+H+(aq)的平衡常数K=3.5×1037;H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。Ksp(HgS)=___ 。
(3)过二硫酸钾(K2S2O8)在冲洗胶片、肥皂和染料等领域有重要用途。实验室可用惰性电极电解饱和硫酸氢钾溶液的方法制备过二硫酸钾。

阴极反应式为:___ ;
若通过该电路的电子的物质的量为2mol,测得整个装置生成气体的体积为28L(已换算为标况),则理论上制得过二硫酸钾___ g。
(1)NO2与SO2能发生反应,某研究小组对此进行相关实验探究。
已知:2NO(g)+O2(g)=2NO2(g) △H=-113kJ•mol-1
2SO2(g)+O2(g)=2SO3(g) △H=-196.6kJ•mol-1
则NO2(g)+SO2(g)=SO3(g)+NO(g)△H=
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(SO2):n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率。部分实验结果如图所示:

①如果要将图中B点的平衡状态改为C点的平衡状态,应采取的措施是
②若A点对应实验中,SO2(g)的起始浓度为amol•L-1,经过tmin达到平衡状态,该时段化学反应速率v(NO2)=
③图中C、D两点对应的实验温度分别为T1和T2,通过计算判断:T1
(2)NaHS可用作污水处理沉淀剂。
已知:25℃时,反应Hg2+(aq)+HS-(aq)
 HgS(s)+H+(aq)的平衡常数K=3.5×1037;H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。Ksp(HgS)=
HgS(s)+H+(aq)的平衡常数K=3.5×1037;H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。Ksp(HgS)=(3)过二硫酸钾(K2S2O8)在冲洗胶片、肥皂和染料等领域有重要用途。实验室可用惰性电极电解饱和硫酸氢钾溶液的方法制备过二硫酸钾。

阴极反应式为:
若通过该电路的电子的物质的量为2mol,测得整个装置生成气体的体积为28L(已换算为标况),则理论上制得过二硫酸钾
您最近一年使用:0次
名校
解题方法
5 . 据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=−393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2=−221.0kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___ 。
(2)对于2NO(g)+2CO(g) N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___ (填字母代号)。
A. 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式___ 。用离子方程式表示吸收池中除去NO的原理___ 。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g) 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
①T1温度时 =
=___ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__ T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与 的关系如图所示:
的关系如图所示:

①图中CO2的平衡转化率可用表示___ (L1或L2)
②该温度下,反应X的平衡常数Kp=___ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=−393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2=−221.0kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式
(2)对于2NO(g)+2CO(g)
 N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。下列能说明该反应已经达到平衡状态的是
A.
 比值不变
比值不变B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g)
 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
| n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
 =
=②若将容器的温度改变为T2时其k正=k逆,则T2
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与
 的关系如图所示:
的关系如图所示:
①图中CO2的平衡转化率可用表示
②该温度下,反应X的平衡常数Kp=
您最近一年使用:0次
6 . 在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
| A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 04 mol·L-1·min-1 |
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的 △H<0,且a =2 zC(g)的 △H<0,且a =2 |
| C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
您最近一年使用:0次
2020-04-30更新
|
1403次组卷
|
25卷引用:2013-2014学年江苏省扬州中学高二下学期4月阶段测试化学试卷
(已下线)2013-2014学年江苏省扬州中学高二下学期4月阶段测试化学试卷2015届湖南省浏阳一中高三上学期12月联考化学试卷2015届江苏省扬州中学高三4月双周测化学试卷安徽省六安市第一中学2018届高三上学期第五次月考化学试题江苏省海安高级中学2019-2020学年高二10月月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题内蒙古阿拉善盟2020届高三上学期月考化学试题江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题(已下线)2013-2014浙江省温州中学高二下学期期中化学试卷(已下线)2014届江苏启东中学第二学期期中考试高二实验班化学试卷(已下线)2014届浙江省温州中学高二下学期期中化学试卷 2016届江苏省灌云县第一中学高三上学期第二次学情检测化学试卷2016届天津市六校高三上学期期末联考化学试卷2017届福建省漳州市八校高三上学期期末联考化学试卷山西省孝义市2017届高三下学期考前热身训练理综化学试题【全国百强校】湖北省黄冈市黄冈中学2018-2019高二上学期期中模考化学试题江苏省淮阴中学2021届高三上学期开学练习化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 章末综合检测卷(已下线)练习3 化学反应速率的计算及其影响因素-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题湖南省娄底市2021-2022学年高三上学期期末教学质量检测化学试题
名校
解题方法
7 . H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知H2S的燃烧热为akJ∙mol-1,S的燃烧热为bkJ∙mol-1,则常温下空气直接氧化脱除H2S的反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=______ kJ∙mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如下表,最佳脱硫剂为_________ 。
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生热分解反应H2S(g)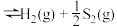 控制不同的温度和压强进行实验,结果如图(a)。
控制不同的温度和压强进行实验,结果如图(a)。
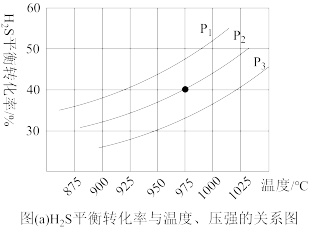
(3)图(a)中压强关系p1、p2、p3由大到小的顺序为______ ,该反应为____ (填“吸热”或“放热”)反应,若要进一步提高H2S的平衡转化率,除了改变温度和压强外,还可以采取的措施有_______ 。
(4)若压强为p、温度为975℃时, 的平衡常数K=0.04,则起始浓度c=
的平衡常数K=0.04,则起始浓度c=______ mol∙Lˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____ 0.04(填“>”1 “<”或“=”)。
Ⅲ.间接电解法脱硫
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,将反应后溶液通过电解再生,实现循环使用,该法处理过程如下图(b)。
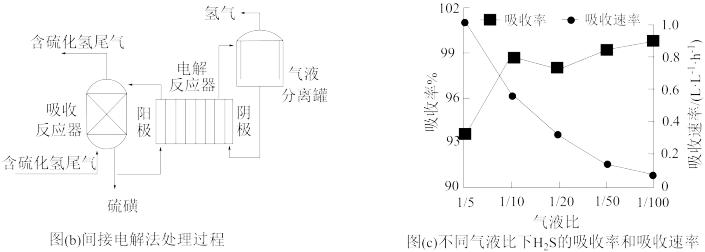
(5)电解反应器总反应的离子方程式为________ 。
(6)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图(c)所示,随着气液比减小,H2S的吸收速率逐渐降低,而吸收率呈上升趋势的原因为____________ 。
Ⅰ.干法脱硫
(1)已知H2S的燃烧热为akJ∙mol-1,S的燃烧热为bkJ∙mol-1,则常温下空气直接氧化脱除H2S的反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=
(2)常用脱硫剂的脱硫效果及反应条件如下表,最佳脱硫剂为
| 脱硫剂 | 出口硫(mg·m-3) | 脱硫温度(℃) | 操作压力(MPa) | 再生条件 |
| 一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸气再生 |
| 活性炭 | <1.33 | 常温 | 0~3.0 | 蒸气再生 |
| 氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
| 锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生热分解反应H2S(g)
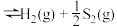 控制不同的温度和压强进行实验,结果如图(a)。
控制不同的温度和压强进行实验,结果如图(a)。
(3)图(a)中压强关系p1、p2、p3由大到小的顺序为
(4)若压强为p、温度为975℃时,
 的平衡常数K=0.04,则起始浓度c=
的平衡常数K=0.04,则起始浓度c=Ⅲ.间接电解法脱硫
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,将反应后溶液通过电解再生,实现循环使用,该法处理过程如下图(b)。

(5)电解反应器总反应的离子方程式为
(6)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图(c)所示,随着气液比减小,H2S的吸收速率逐渐降低,而吸收率呈上升趋势的原因为
您最近一年使用:0次
2020-04-12更新
|
285次组卷
|
2卷引用:广东省深圳市2020届高三下学期第二次线上测试(全国I卷)理综化学试题
名校
解题方法
8 . 二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=____ kJ·mol-1。下列措施中,能提高CH3OCH3产率的有____ 。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____ 。
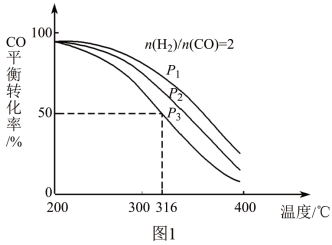

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____ 时最有利于二甲醚的合成。
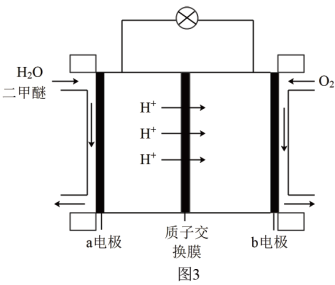
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____ 。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____ 。
① CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1② 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1③ CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是| A.△H < 0 |
| B.P1<P2<P3 |
| C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50% |



(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
您最近一年使用:0次
2018-07-01更新
|
165次组卷
|
3卷引用:江苏省泰州中学2018-2019学年高二下学期第二次月考化学试题



