解题方法
1 . NiS难溶于水,易溶于稀酸,可利用沉淀转化的原理除去镍电解液中的铜离子,NiS在潮湿的空气中可转化为磁式硫化高镍 ,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:______ 。
(2)装置图中,仪器a的名称为______ ,装置Ⅱ中的试剂为______ 。
(3)装置Ⅲ中反应的离子方程式为中。
(4)反应结束后关闭 、
、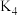 ,在b、c处分别连接下图两个装置,打开
,在b、c处分别连接下图两个装置,打开 、
、 进行抽滤和洗涤。装置Ⅳ接在
进行抽滤和洗涤。装置Ⅳ接在______ (填“b”或“c”)处。______ (用化学方程式结合文字作答)。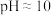 的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
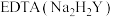 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。滴定达终点时消耗EDTA标准溶液VmL。
。滴定达终点时消耗EDTA标准溶液VmL。
①样品的纯度为______ %。
②滴定过程中,若氨性缓冲溶液pH过低,导致测得的产品纯度______ (填“偏低”、“偏高”或“不影响”)。
 ,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
(2)装置图中,仪器a的名称为
(3)装置Ⅲ中反应的离子方程式为中。
(4)反应结束后关闭
 、
、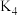 ,在b、c处分别连接下图两个装置,打开
,在b、c处分别连接下图两个装置,打开 、
、 进行抽滤和洗涤。装置Ⅳ接在
进行抽滤和洗涤。装置Ⅳ接在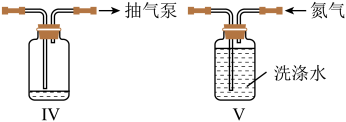

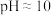 的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
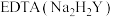 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。滴定达终点时消耗EDTA标准溶液VmL。
。滴定达终点时消耗EDTA标准溶液VmL。①样品的纯度为
②滴定过程中,若氨性缓冲溶液pH过低,导致测得的产品纯度
您最近一年使用:0次
解题方法
2 .  和
和 是两种常见的温室气体,利用
是两种常见的温室气体,利用 和
和 生成高附加值合成气CO和
生成高附加值合成气CO和 ,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
(1)已知: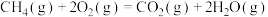
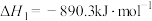 ;
;
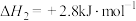 ;
;
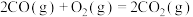
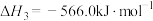 。
。
反应 的
的
________  ;对于该反应,有利于提高
;对于该反应,有利于提高 平衡转化率的条件是
平衡转化率的条件是________ (填字母)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)CO常用于工业冶炼金属,如图是在不同温度下CO还原三种金属氧化物达平衡后气体中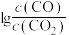 与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
(3)甲烷部分催化裂解制备乙烯的反应原理为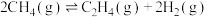
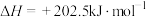 。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入
。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入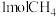 ,平衡时
,平衡时 转化率为40%,若温度、压强和
转化率为40%,若温度、压强和 初始量不变,充入
初始量不变,充入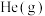 作为稀释气,平衡时
作为稀释气,平衡时 转化率为50%,则充入He的物质的量为
转化率为50%,则充入He的物质的量为________ mol。
(4)一定温度下,将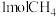 充入2L的固定容积容器中发生反应
充入2L的固定容积容器中发生反应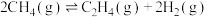
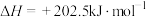 。实验测得容器内各气体分压与时间的关系如图所示。
。实验测得容器内各气体分压与时间的关系如图所示。 的平衡转化率为
的平衡转化率为________ 。
②反应的平衡常数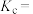
________ 。
③若在该温度下,向容器中再充入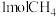 ,达到平衡时,平衡混合物中
,达到平衡时,平衡混合物中 的物质的量分数
的物质的量分数________ (填“增大”“减小”或“不变”)。
 和
和 是两种常见的温室气体,利用
是两种常见的温室气体,利用 和
和 生成高附加值合成气CO和
生成高附加值合成气CO和 ,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:(1)已知:
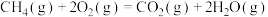
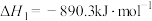 ;
;
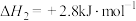 ;
;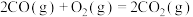
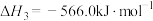 。
。反应
 的
的
 ;对于该反应,有利于提高
;对于该反应,有利于提高 平衡转化率的条件是
平衡转化率的条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)CO常用于工业冶炼金属,如图是在不同温度下CO还原三种金属氧化物达平衡后气体中
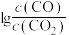 与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
与温度(T)的关系曲线图。下列说法正确的是________(填字母)。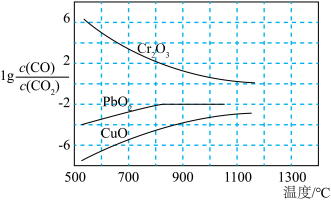
A.CO还原 的反应 的反应 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜时较低的温度有利于提高CO的利用率 |
| D.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
(3)甲烷部分催化裂解制备乙烯的反应原理为
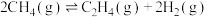
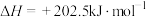 。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入
。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入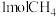 ,平衡时
,平衡时 转化率为40%,若温度、压强和
转化率为40%,若温度、压强和 初始量不变,充入
初始量不变,充入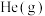 作为稀释气,平衡时
作为稀释气,平衡时 转化率为50%,则充入He的物质的量为
转化率为50%,则充入He的物质的量为(4)一定温度下,将
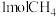 充入2L的固定容积容器中发生反应
充入2L的固定容积容器中发生反应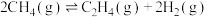
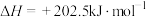 。实验测得容器内各气体分压与时间的关系如图所示。
。实验测得容器内各气体分压与时间的关系如图所示。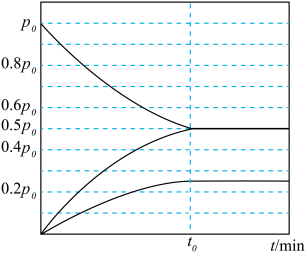
 的平衡转化率为
的平衡转化率为②反应的平衡常数
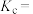
③若在该温度下,向容器中再充入
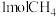 ,达到平衡时,平衡混合物中
,达到平衡时,平衡混合物中 的物质的量分数
的物质的量分数
您最近一年使用:0次
解题方法
3 . 丙烯是一种重要的化工原料,工业上丙烷制丙烯的相关反应如下:
ⅰ.
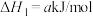
ⅱ.

ⅲ.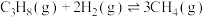
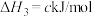
回答下列问题:
Ⅰ.单独投料(副反应抑制法)。
(1)反应: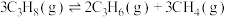

_________  。
。
(2) 时,单独加入
时,单独加入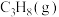 至
至 后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数
后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数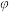 见下表。
见下表。
①若只考虑体系中反应ⅱ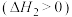 ,以下操作有利于减小
,以下操作有利于减小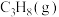 平衡转化率的是
平衡转化率的是___________ (填字母)。
A.通入少量 B.使用高选择性催化剂 C.降温 D.减压
B.使用高选择性催化剂 C.降温 D.减压
② 内
内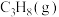 消耗的平均速率:反应ⅰ
消耗的平均速率:反应ⅰ_________ 反应ⅱ(填“<”、“>”或“=”)。
(3)一定温度下,向 恒容密闭容器中通入
恒容密闭容器中通入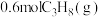 ,压强为
,压强为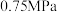 ,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数
,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 ,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
___________ 。
Ⅱ.共进料投料(耦合反应法)。
工业上也常采用 与
与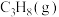 共进料投料,通过发生耦合反应制丙烯,反应如下:
共进料投料,通过发生耦合反应制丙烯,反应如下:
(4) 为用压强表示的反应平衡常数,一定温度下:
为用压强表示的反应平衡常数,一定温度下:
ⅰ.
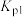
ⅳ.
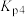
则体系中反应

___________ (用含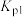 、
、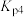 的式子表示)。
的式子表示)。
(5)实际工艺生产中按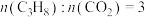 进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:________ (填“吸热”或“放热”)反应,在________ (填“高温”或“低温”)下进行自发反应。
②生产中温度须不低于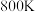 ,原因是
,原因是___________ 。
ⅰ.

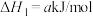
ⅱ.


ⅲ.
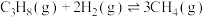
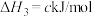
回答下列问题:
Ⅰ.单独投料(副反应抑制法)。
(1)反应:
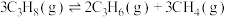

 。
。(2)
 时,单独加入
时,单独加入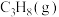 至
至 后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数
后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数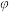 见下表。
见下表。| 物质 |  |  |  |  |
体积分数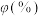 | 18 | 20 | 47 | 0 |
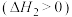 ,以下操作有利于减小
,以下操作有利于减小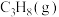 平衡转化率的是
平衡转化率的是A.通入少量
 B.使用高选择性催化剂 C.降温 D.减压
B.使用高选择性催化剂 C.降温 D.减压②
 内
内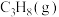 消耗的平均速率:反应ⅰ
消耗的平均速率:反应ⅰ(3)一定温度下,向
 恒容密闭容器中通入
恒容密闭容器中通入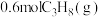 ,压强为
,压强为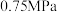 ,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数
,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 ,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
Ⅱ.共进料投料(耦合反应法)。
工业上也常采用
 与
与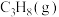 共进料投料,通过发生耦合反应制丙烯,反应如下:
共进料投料,通过发生耦合反应制丙烯,反应如下:
(4)
 为用压强表示的反应平衡常数,一定温度下:
为用压强表示的反应平衡常数,一定温度下:ⅰ.

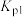
ⅳ.

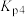
则体系中反应


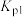 、
、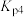 的式子表示)。
的式子表示)。(5)实际工艺生产中按
 进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析: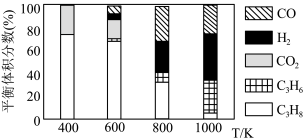
②生产中温度须不低于
 ,原因是
,原因是
您最近一年使用:0次
4 . 硫酰氯(SO2Cl2)在有机合成上可用作磺化剂和氯化剂。无水条件下合成SO2Cl2的反应为:SO2(g)+Cl2(g)⇌SO2Cl2(g) △H=-67kJ/mol。
(1)关于上述反应,下列描述错误的是___________ (填字母)。___________ kJ/mol。
(3)等温下,将等物质的量的反应物加入恒容容器中,起始压强为mkPa,发生上述反应,平衡后压强为nkPa,平衡常数Kp=___________ (kPa)-1(列出表达式)。
(4)硫酰氯对甲苯进行气相催化氯化,某反应机理如图所示(图中 为催化剂表面的催化活性位点)。
为催化剂表面的催化活性位点)。___________ 。
②根据反应机理,当催化剂表面活性位点不足时,分别增大硫酰氯和甲苯的浓度,反应速率的变化情况分别为___________ 。
(5)锂—硫酰氯电池是一种高能锂电池。该电池采用非编织玻璃隔膜,以金属Li为负极,多孔碳为正极(硫酰氯为正极活性物质),溶解有Li[AlCl4]的液态硫酰氯作为电解液。
①电解液中迁移向正极的离子为___________ 。
②负极的电极反应式为___________ 。
③放电时,若正极生成LiCl、Li2S2O4和SO2三种产物,其物质的量分别为a、b和cmol,则c=___________ (用a和b表示)。
(1)关于上述反应,下列描述错误的是

(3)等温下,将等物质的量的反应物加入恒容容器中,起始压强为mkPa,发生上述反应,平衡后压强为nkPa,平衡常数Kp=
(4)硫酰氯对甲苯进行气相催化氯化,某反应机理如图所示(图中
 为催化剂表面的催化活性位点)。
为催化剂表面的催化活性位点)。
②根据反应机理,当催化剂表面活性位点不足时,分别增大硫酰氯和甲苯的浓度,反应速率的变化情况分别为
(5)锂—硫酰氯电池是一种高能锂电池。该电池采用非编织玻璃隔膜,以金属Li为负极,多孔碳为正极(硫酰氯为正极活性物质),溶解有Li[AlCl4]的液态硫酰氯作为电解液。
①电解液中迁移向正极的离子为
②负极的电极反应式为
③放电时,若正极生成LiCl、Li2S2O4和SO2三种产物,其物质的量分别为a、b和cmol,则c=
您最近一年使用:0次
名校
解题方法
5 . 铁酸钡( )是一种压电材料。以重晶石(
)是一种压电材料。以重晶石( ,杂质主要有
,杂质主要有 、
、 等)为原料,采用下列路线可制备粉状
等)为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉将 还原为BaS的化学方程式为
还原为BaS的化学方程式为___________ 。
(2)①用水“浸取”时主要发生反应的离子方程式为___________ 。
②流程中先用水浸取,再用盐酸酸化,相比于焙烧后的产物直接用盐酸浸取主要的优势在于___________ 。
(3)“浓缩结晶”所得 中常含有少量杂质金属离子,因此在制备高纯
中常含有少量杂质金属离子,因此在制备高纯 时需要先将
时需要先将 纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到
纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到 溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度
溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度 。
。
①加入双氧水的作用为___________ 。
②为何不在浓缩结晶之前加入双氧水和氨水除去杂质金属离子?___________ 。
(4)“沉淀”步骤生成难溶的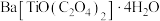
已知: 在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
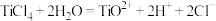 ;
;
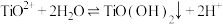 ;
;
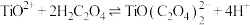
实验表明,“沉淀”反应的最佳pH条件为2.5附近。从平衡移动角度分析pH太高或太低对生成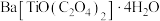 沉淀不利的原因:
沉淀不利的原因:___________ 。
(5)在氮气气氛中“热分解”生成粉状钛酸钡,对应的化学反应方程式为___________ 。
 )是一种压电材料。以重晶石(
)是一种压电材料。以重晶石( ,杂质主要有
,杂质主要有 、
、 等)为原料,采用下列路线可制备粉状
等)为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉将
 还原为BaS的化学方程式为
还原为BaS的化学方程式为(2)①用水“浸取”时主要发生反应的离子方程式为
②流程中先用水浸取,再用盐酸酸化,相比于焙烧后的产物直接用盐酸浸取主要的优势在于
(3)“浓缩结晶”所得
 中常含有少量杂质金属离子,因此在制备高纯
中常含有少量杂质金属离子,因此在制备高纯 时需要先将
时需要先将 纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到
纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到 溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度
溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度 。
。①加入双氧水的作用为
②为何不在浓缩结晶之前加入双氧水和氨水除去杂质金属离子?
(4)“沉淀”步骤生成难溶的
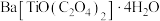
已知:
 在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程: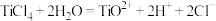 ;
;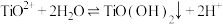 ;
;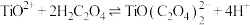
实验表明,“沉淀”反应的最佳pH条件为2.5附近。从平衡移动角度分析pH太高或太低对生成
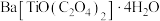 沉淀不利的原因:
沉淀不利的原因:(5)在氮气气氛中“热分解”生成粉状钛酸钡,对应的化学反应方程式为
您最近一年使用:0次
解题方法
6 . 环己烯( )是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。
)是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。


氧化脱氢:

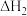
回答下列问题:
(1)已知几种化学键的键能数据如下表所示。
| 化学键 | H-H | C-H | C-C |  |
键能/(kJ | 436 | 413 | 348 | 615 |
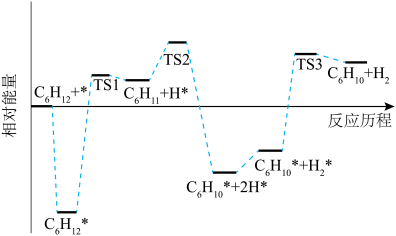
①
 的焓变小于零的原是
的焓变小于零的原是②
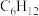 脱氢的速率
脱氢的速率 *脱氢的速率。
*脱氢的速率。③环己烷脱氢制备环己烯的副产物可能有
④在恒容密闭容器中充入一定量的环己烷,其初始压强为p
 ,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ=
,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ= ,Kθ=
,Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。(3)在压强恒为
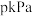 的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为
的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为 
您最近一年使用:0次
2024-06-04更新
|
109次组卷
|
4卷引用:湖北省普通高中2024届高三下学期高考押题预测卷化学试题
7 . 乙烯、丙烯是石油产业的核心,工业上可利用甲醇制备乙烯、丙烯,所涉及的反应如下:
主反应: ;
;
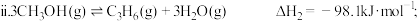
副反应: 。
。
回答下列问题:
(1)已知相关化学键的键能数据如下:

_______  。
。
(2)下列关于反应 的说法正确的是_______(填字母)。
的说法正确的是_______(填字母)。
(3)T℃时,在压强恒定的相同容器中填装催化剂,以恒定的流速通入 ,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。_______ 。
②3h后乙烯和丙烯的选择性均明显下降,可能的原因是_______ 。
(4)只研究温度对反应的影响,向压强恒定为 的密闭容器中通入
的密闭容器中通入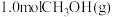 只发生反应
只发生反应 和
和 ,经过相同时间
,经过相同时间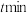 ,乙烯和丙烯的物质的量随温度的变化如图所示。
,乙烯和丙烯的物质的量随温度的变化如图所示。 前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为
前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为_______ 。
② 时,
时, 的平衡转化率为
的平衡转化率为_______ 。
③ 时,反应
时,反应 的平衡常数
的平衡常数
_______  (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)若反应ⅲ的速率方程为 ,其中
,其中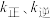 分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数
分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数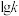 与温度的倒数
与温度的倒数 之间的关系,则
之间的关系,则 时,反应ⅲ的化学平衡常数
时,反应ⅲ的化学平衡常数
_______ 。
主反应:
 ;
;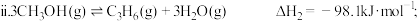
副反应:
 。
。回答下列问题:
(1)已知相关化学键的键能数据如下:
| 化学键 | C-H | C-O | C=C | O-H |
键能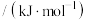 | 413 | 351 | 615 | 463 |

 。
。(2)下列关于反应
 的说法正确的是_______(填字母)。
的说法正确的是_______(填字母)。| A.主反应均为熵增反应 |
| B.乙烯和丙烯的体积分数相等,说明体系达到了平衡状态 |
| C.及时将水蒸气液化并分离,有利于提高甲醇的平衡转化率 |
| D.其他条件相同,反应i分别在恒容和恒压条件下进行,前者甲醇的平衡转化率更高 |
(3)T℃时,在压强恒定的相同容器中填装催化剂,以恒定的流速通入
 ,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
②3h后乙烯和丙烯的选择性均明显下降,可能的原因是
(4)只研究温度对反应的影响,向压强恒定为
 的密闭容器中通入
的密闭容器中通入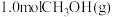 只发生反应
只发生反应 和
和 ,经过相同时间
,经过相同时间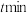 ,乙烯和丙烯的物质的量随温度的变化如图所示。
,乙烯和丙烯的物质的量随温度的变化如图所示。
 前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为
前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为②
 时,
时, 的平衡转化率为
的平衡转化率为③
 时,反应
时,反应 的平衡常数
的平衡常数
 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。(5)若反应ⅲ的速率方程为
 ,其中
,其中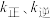 分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数
分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数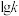 与温度的倒数
与温度的倒数 之间的关系,则
之间的关系,则 时,反应ⅲ的化学平衡常数
时,反应ⅲ的化学平衡常数

您最近一年使用:0次
8 . 乙二醇常用作溶剂、防冻液和合成聚酯的原料。工业上有多种方法可以制备乙二醇。
(1)环氧乙烷( )直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式
)直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式__________ 。
生成的乙二醇可以继续与环氧乙烷发生副反应生成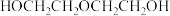 。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
(2)碳酸乙烯酯合成法:
①反应温度为140℃,催化剂用量为2%,反应2h时,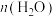 /n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
/n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
根据表中数据分析,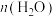 /n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是
/n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是__________ 、__________ 。(写出两条)
②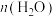 /n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
/n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是__________ 。 、
、 、NO、
、NO、 等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。__________ 。
②已知乙二醇的沸点为197.3℃,甲醇的沸点为64.8℃,二者互溶。分离乙二醇和甲醇的实验操作为__________ ,解释二者互溶的原因__________ 。
(4)乙烯催化氧化一步法:有研究者发现, 能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下,
能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下, 的转化率与利用率如下表所示。
的转化率与利用率如下表所示。
解释60℃后 利用率变化的原因
利用率变化的原因__________ 。
(1)环氧乙烷(
 )直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式
)直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式生成的乙二醇可以继续与环氧乙烷发生副反应生成
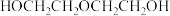 。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。(2)碳酸乙烯酯合成法:
第一步: (碳酸乙烯酯)
(碳酸乙烯酯) 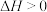
第二步: (碳酸乙烯酯)
(碳酸乙烯酯)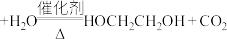
①反应温度为140℃,催化剂用量为2%,反应2h时,
 /n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
/n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
| 1.5 | 2.0 | 2.5 | 3.0 |
乙二醇含量/% | 23.2 | 96.8 | 94.4 | 90.4 |
| 0.8 | 3.2 | 5.6 | 9.6 |
碳酸乙烯酯含量/% | 72.2 | 0 | 0 | 0 |
 /n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是
/n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是②
 /n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
/n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
 、
、 、NO、
、NO、 等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
②已知乙二醇的沸点为197.3℃,甲醇的沸点为64.8℃,二者互溶。分离乙二醇和甲醇的实验操作为
(4)乙烯催化氧化一步法:有研究者发现,
 能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下,
能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下, 的转化率与利用率如下表所示。
的转化率与利用率如下表所示。温度(℃) | 50 | 60 | 80 |
| 84.9 | 98.4 | 99.8 |
| 67.2 | 67.8 | 55.5 |
 利用率变化的原因
利用率变化的原因
您最近一年使用:0次
名校
解题方法
9 . 以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:
反应Ⅰ: 。
。
已知: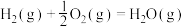
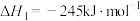
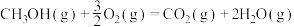
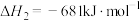
回答下列问题:
(1)计算上述合成甲醇反应的焓变
__________  。合成过程中借助高分子选择性吸水膜可有效提高
。合成过程中借助高分子选择性吸水膜可有效提高 平衡利用率,其原因是
平衡利用率,其原因是__________ 。
(2)关于反应Ⅰ的说法,正确的是__________ 。
A.有利于减少碳排放,实现碳中和
B.降低温度可提高 含量,工业生产时应控制温度越低越好
含量,工业生产时应控制温度越低越好
C.当气体密度保持不变时,反应一定达到平衡状态
(3)在恒压密闭容器中通入 和
和 的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:__________ ℃。
②随着温度升高,反应速率加快,甲醇的时空收率增大。继续升高温度,甲醇的时空收率反而降低的原因可能是__________ 。
③220℃时,氢气的平均反应速率为__________ 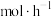 。
。
(4) 催化加氢制甲醇过程中,存在竞争的副反应主要是:
催化加氢制甲醇过程中,存在竞争的副反应主要是:

在恒温、压强为p的反应条件中, 和
和 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
__________ 。(列出计算式即可,用平衡分压代替平衡浓度,分压=总压×物质的量分数,甲醇的选择性 %)
%)
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:反应Ⅰ:
 。
。已知:
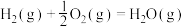
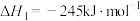
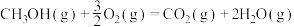
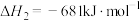
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。合成过程中借助高分子选择性吸水膜可有效提高
。合成过程中借助高分子选择性吸水膜可有效提高 平衡利用率,其原因是
平衡利用率,其原因是(2)关于反应Ⅰ的说法,正确的是
A.有利于减少碳排放,实现碳中和
B.降低温度可提高
 含量,工业生产时应控制温度越低越好
含量,工业生产时应控制温度越低越好C.当气体密度保持不变时,反应一定达到平衡状态
(3)在恒压密闭容器中通入
 和
和 的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
②随着温度升高,反应速率加快,甲醇的时空收率增大。继续升高温度,甲醇的时空收率反而降低的原因可能是
③220℃时,氢气的平均反应速率为
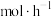 。
。(4)
 催化加氢制甲醇过程中,存在竞争的副反应主要是:
催化加氢制甲醇过程中,存在竞争的副反应主要是:

在恒温、压强为p的反应条件中,
 和
和 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
 %)
%)
您最近一年使用:0次
解题方法
10 . 工业尾气脱硝是减少空气污染的重要举措.回答下列问题:
(1)已知相关反应的热力学数据如下表所示:
①理论上,反应消耗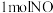 时,反应
时,反应______ (填“吸收”或“释放”)__________  的能量;
的能量;
② 时,另一脱硝反应
时,另一脱硝反应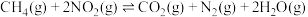 的
的
_______ ;(用含有a、b的式子表示)
(2)模拟工业尾气脱硝:一定条件下,将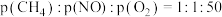 的气体与
的气体与 混合,均匀通过催化脱硝反应器,测得
混合,均匀通过催化脱硝反应器,测得 内
内 去除率与
去除率与 转化率随反应温度的变化如图所示.
转化率随反应温度的变化如图所示. 的去除率最高的原因是
的去除率最高的原因是_________________ ;
②若只考虑反应Ⅰ和Ⅲ,则温度为T时,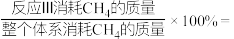
_______ ;(保留到0.1%)
③ 时,为提高反应Ⅲ中
时,为提高反应Ⅲ中 的平衡转化率,理论上能采取的措施是
的平衡转化率,理论上能采取的措施是________ ;(填选项)
A.适当降低温度 B.加入少量生石灰
C.恒容充入更多 D.使用更高效的催化剂
D.使用更高效的催化剂
(1)已知相关反应的热力学数据如下表所示:
| 反应 | 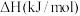 | 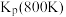 | |
| Ⅰ |  |  | |
| Ⅱ | 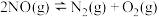 | 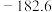 | |
| Ⅲ | 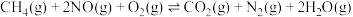 | a | |
| Ⅳ | 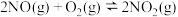 | b |
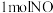 时,反应
时,反应 的能量;
的能量;②
 时,另一脱硝反应
时,另一脱硝反应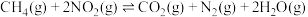 的
的
(2)模拟工业尾气脱硝:一定条件下,将
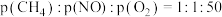 的气体与
的气体与 混合,均匀通过催化脱硝反应器,测得
混合,均匀通过催化脱硝反应器,测得 内
内 去除率与
去除率与 转化率随反应温度的变化如图所示.
转化率随反应温度的变化如图所示.
 的去除率最高的原因是
的去除率最高的原因是②若只考虑反应Ⅰ和Ⅲ,则温度为T时,
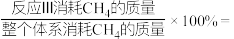
③
 时,为提高反应Ⅲ中
时,为提高反应Ⅲ中 的平衡转化率,理论上能采取的措施是
的平衡转化率,理论上能采取的措施是A.适当降低温度 B.加入少量生石灰
C.恒容充入更多
 D.使用更高效的催化剂
D.使用更高效的催化剂
您最近一年使用:0次

 含量/%
含量/%

