名校
解题方法
1 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
名校
2 . 关于硫酸工业中的催化氧化反应,可以用勒夏特列原理解释的是
| A.升温至450℃左右 | B.选择V2O5做催化剂 |
| C.选择常压条件 | D.通入过量氧气 |
您最近一年使用:0次
2021-06-20更新
|
312次组卷
|
8卷引用:【区级联考】上海市金山区2019届高三上学期高考一模化学试题
【区级联考】上海市金山区2019届高三上学期高考一模化学试题(已下线)2.3.3 温度对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)上海长宁区2021届高三下学期二模化学试题江苏省镇江第一中学2020-2021学年高二下学期期中考试化学试题(已下线)第二章 第三节化学平衡(第3课时 化学平衡常数)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)2.4 化学反应的调控(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第2章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)上海市复兴高级中学2022-2023学年高二上学期期中考试化学(等级考)试题
3 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,涉及如下实验:
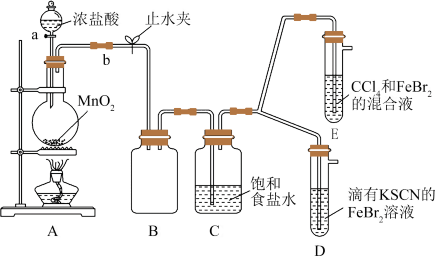
完成下列填空:
(1)装置A中发生反应的化学方程式是___ ,整套实验装置存在的一处明显不足是___ 。
(2)用改进后的装置进行实验,观察到:D中溶液变红;E中水层溶液变黄,振荡后,CCl4层无明显变化。则Cl2、Br2、Fe3+的氧化性由强到弱的顺序为___ 。
因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D中:红色慢慢褪去,E中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
(3)用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因___ 。请设计简单实验证明上述解释:___ 。
(4)欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因___ 。
(5)将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为___ 。

完成下列填空:
(1)装置A中发生反应的化学方程式是
(2)用改进后的装置进行实验,观察到:D中溶液变红;E中水层溶液变黄,振荡后,CCl4层无明显变化。则Cl2、Br2、Fe3+的氧化性由强到弱的顺序为
因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D中:红色慢慢褪去,E中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
(3)用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因
(4)欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因
(5)将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为
您最近一年使用:0次
4 . 羰基硫(COS)可作为一种粮食熏蒸剂。在恒容密闭容器中,将CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: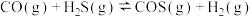
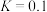 。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
 混合加热并达到下列平衡:
混合加热并达到下列平衡: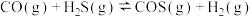
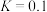 。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是A.若升高温度, 浓度增加,表明该反应是吸热反应 浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率瞬间增大随后逐渐减小,逆反应速率逐渐增大 |
C.反应前 物质的量为8mol 物质的量为8mol |
| D.CO的平衡转化率为80% |
您最近一年使用:0次
5 . 天然气脱硫的方法有多种,一种是干法脱硫,其涉及的反应:H2(g)+CO(g)+SO2(g) H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是
H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是
 H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是
H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是| A.加催化剂 | B.分离出硫 | C.减压 | D.加生石灰 |
您最近一年使用:0次
2019-10-27更新
|
61次组卷
|
3卷引用:上海市金山区2012届高三上学期期末考试化学试题
名校
6 . 容积可变的密闭容器中,反应2SO2(g)十O2(g)  2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:
(1)工业上该反应是在________ (填设备名称)进行的,所用的催化剂是________ 。
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______ (选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________ (选填编号)。

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量_______ (选填“增大”“减小”“不变”)。
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______ 性,理由是____________________ (用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________ 。
 2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:(1)工业上该反应是在
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈
您最近一年使用:0次
9-10高一下·上海金山·期末
7 . (1)在密闭容器中有H2O(g) +C(s)  CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸气浓度,平衡向
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸气浓度,平衡向______ 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将____ 。(填“增大”、“减小”或“不变”下同)
②增加H2浓度平衡向____ 反应方向移动,CO的浓度将____ 。
(2)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:
2NO2(g) N2O4(g) 当活塞迅速向外拉时,平衡向
N2O4(g) 当活塞迅速向外拉时,平衡向____ 反应方向移动,气体的颜色先变_____ (“浅”、“深”或“不变”下同),后变______ ;最终和最初相比,_____ 更深(填“前”或“后”)。
 CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸气浓度,平衡向
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸气浓度,平衡向②增加H2浓度平衡向
(2)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:
2NO2(g)
 N2O4(g) 当活塞迅速向外拉时,平衡向
N2O4(g) 当活塞迅速向外拉时,平衡向
您最近一年使用:0次



